 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2010 年, 第 29 卷, 第 6 篇 doi: 10.5376/gab.cn.2010.29.0006
收稿日期: 2010年11月18日 接受日期: 2010年12月16日 发表日期: 2010年12月21日
朱文奇等, 2010, 高邮鸭NPY (Neuropeptide Y)基因cDNA克隆、表达及序列分析, 基因组学与应用生物学(Online) Vol.29 No.6 (doi: 10.5376/gab.cn.2010.29.0006)
为了掌握NPY基因在高邮鸭产蛋期的组织表达规律,运用RT-PCR克隆高邮鸭NPY基因的核心区域部分序列,结合实时荧光定量(real time quantitative PCR)方法对高邮鸭产蛋期下丘脑、垂体中枢组织以及心脏、肝脏、脾脏、胰腺、肾脏、子宫、卵巢、小肠、胸肌、腿肌等周围组织NPY mRNA相对表达量和扩增产物片段大小检测。结果表明,克隆测序获得了高邮鸭NPY基因的核心区域198 bp序列;鸭NPY核心区域198 bp序列的系统进化分析显示,NPY存在种属差异性,符合鸭在动物进化中的定位;实时荧光定量分析结果显示,NPY基因在下丘脑中,表达量很丰富;在垂体和小肠中,表达量较少;在卵巢组织、心脏组织、肝脏组织、脾脏组织、肾脏组织、胰腺组织、子宫组织、胸肌组织、腿肌组织等九个部位,呈痕量表达;三类间表达量差异极显著(P<0.01),类别内组织表达量差异不显著(P>0.05);表明鸭NPY基因在进化中相对保守,在第三外显子至3'未翻译端之间不存在选择性拼接调控机制。本研究结果为进一步开展高邮鸭繁殖调控机理特别是双黄蛋形成机理及分子标记的研究奠定了基础。
NPY (Neuropeptide Y)激素在下丘脑中分布广泛,以弓状核、室旁核、室周核、视交叉上核、视交叉后区等分布密集,是中枢神经组织含量最高的神经肽之一(Aboumder et al., 1999)。主要参与调节动物的摄食行为、生物节律性、平滑肌的收缩以及影响下丘脑神经内分泌活动(Larhammar, 1996)。NPY最早在猪的脑部组织中分离出来(Tatemoto, 1982),随后在鸟类、两栖类和鱼类中被分离出来(Cerda-Reverter and Larhammar, 2000)。之后在周围神经组织和其它内脏组织中,也发现NPY神经的分布。NPY激素主要是作用于下丘脑-垂体-性腺轴(HPG),以性激素依赖的方式影响性成熟的启动(倪迎东等, 2005)。
目前,在不同动物中,不同的生长发育时期,NPY基因是否表达,以及表达的相对量目前尚无定论,不尽一致(Martí et al., 1992; Barnea et al., 1998;Chen et al., 2005)。本研究以善产双黄蛋而驰名中外的高邮鸭为实验材料,通过RT-PCR克隆出鸭NPY基因的核心区域部分,与其他已知cDNA序列进化比较,并且结合实时荧光定量方法对其在中枢神经组织和内脏各个器官的表达情况进行了相关研究,为进一步研究NPY基因的生理学效应奠定基础。
1 结果与分析
1.1 RNA质量检测
采用BioPhotometer分光光度计检测提取好的RNA样品,结果显示RNA样品的OD260/OD280比值均在1.8~2.0之间,表明所提取RNA纯度较高,蛋白质与DNA污染较少,经1%琼脂糖凝胶检测,无条带弥散现象,18s和28s处条带清晰,符合RT-PCR实验要求,可用于后续试验。
1.2 NPY序列分子进化分析
将克隆得到的NPY序列进行测序,获得198 bp的核心片段,此片段包含可翻译20个氨基酸的密码子序列,以及138 bp 3'未翻译端结构。将此NPY基因前体序列与人(Homo sapiens)、猕猴(Macaca mulatta)、牛(Bos taurus)、小鼠(Mus musculus)、大鼠(Rattus norvegicus)、非洲爪蛙(African clawed frog, Xenopus laevis)、鸡(Gallus gallus)、七鳃鳗(Petromyzon marinus)、蜗牛(Aplysia californica)、斑马鱼(Danio rerio)、大西洋鲑(Salmo salar)、日本青鳉(Oryzias latipes)序列对位排列后,构建NPY基因系统进化树(图1)。图1结果表明NPY存在种属差异性,亲缘关系越近,其同源性越高。
.png) 图1 NPY (Neuropeptide Y)基因系统进化树 |
1.3不同组织部位NPY基因表达水平比较
以ß-actin基因为参照基因,实时荧光定量PCR扩增下丘脑、垂体、卵巢组织,以及心脏、肝脏、脾脏、胰腺、肾脏、子宫、小肠、胸肌和腿肌等内脏和肌肉组织,相同组织取来源不同的四只鸭重复实验,不同组织表达水平如图2、表1所示。
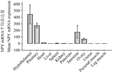 图2 360日龄高邮鸭NPY基因相对表达量 |
 表1 不同组织部位NPY基因表达水平比较 |
由图2和表1可以看出,高邮鸭产蛋期间,NPY基因在组织表达情况可分为三类,第一类下丘脑中,表达量很丰富;第二类在垂体和小肠中,表达量较少,次于下丘脑中表达量;第三类在卵巢组织、心脏组织、肝脏组织、脾脏组织、肾脏组织、胰腺组织、子宫组织、胸肌组织和腿肌组织等九个部位,呈痕量表达。三类间表达量差异极显著(P<0.01),类别内组织表达量差异不显著(P>0.05)。
1.4 不同组织部位是否存在不同剪接体分析
将荧光定量扩增目的片段测序,片段总长130 bp,采用美国国家生物技术信息中心(NCBI)网站的BLAST软件分析,该段序列覆盖第三外显子,第四外显子及部分3‘未翻译端结构。采集溶解曲线信号分析,熔解曲线结果见图3。由图3可知,下丘脑、垂体、卵巢、心脏、肝脏、脾脏、胰腺、肾脏、子宫、小肠、胸肌和腿肌等组织中,在该引物设计区段RT-PCR产物融解温度峰值统一在82℃,在其它温度线上未出现峰值,表明产物在荧光定量PCR引物扩增范围内,其产物长度大小一致,不同组织为扩增出产物一致。由此可以得出结论认为,NPY基因在该区段范围内,在各组织之间不存在不同大小剪接体,无基因选择性剪切。
 图3 不同组织部位RT-PCR产物融解温度峰值图 |
2 讨论
2.1 NPY基因进化和演进
在进化过程中,越是作用机理复杂、调控复杂,分布广泛的蛋白,其编码基因越是保守,越能准确反映远缘物种间的亲缘远近关系。NPY广泛存在于无脊椎动物及所有脊椎动物体内,在脊椎动物的研究中,主要参与调节动物的摄食行为、生物节律性、平滑肌的收缩以及影响下丘脑神经内分泌活动(Larhammar, 1996),甚至能够影响免疫反应,作为影响免疫反应的特殊激活因子(Schwarz et al., 1994),因此在进化中面对的选择压力很大,进化中相对保守,因此,采用NPY基因研究动物进化时间、亲缘关系较为可信度较高。目前NPY基因cDNA序列中被克隆和公布的序列已知的包含哺乳类(Strausberg et al., 2002)、鱼类(Sundstrom et al., 2008)、鸟类(Blomqvist et al., 1992)、两栖类(Griffin et al., 1994)等。本研究通过对扩增出鸭NPY基因核心序列,与其它物种同源性比较,确定所得序列为目的序列。分析鸭NPY基因的序列特征,NPY基因在在不同动物类群间是高度保守的,说明鸭的基因可能有和其它动物具有基因相似的生物学功能。得到NPY系统进化树结果显示,以NPY为基准的进化树准确描述了鸭与两栖类、鸟类、哺乳类、鱼类以及无脊椎动物门等大类群间的亲缘远近关系。
2.2 NPY基因在产蛋期间各组织中表达
一般认为,NPY激素分布于中枢神经系统和外周神经系统中,以及循环系统中分布于支配心脏和血管的神经中,分布于中枢神经系统的NPY激素参与了对于动物食欲调节的过程(Eurin et al., 2000)。在小鼠的研究中,最早在囊胚期就检测到NPY基因的表达(Neveu et al., 2002),在鸭的近源动物鸡的表达研究上,Blomqvist等(1992)采用 Northern杂交的方法,发现在12日龄鸡胚的大脑皮层及其他脑组织检测到mRNA的表达,在肝脏、脾脏、心脏中不表达。也有研究显示,NPY在胃部、卵巢、肝、心脏等非神经细胞中表达(Chen et al., 2005)。本实验采用RT-PCR方法结合实时荧光定量,对于NPY基因转录产物mRNA定量研究表明,在中枢神经系统、内脏、肌肉组织中,均能检测到NPY基因的表达,相对于下丘脑,在心脏、肝脏、脾脏、肾脏、胰腺、子宫、胸肌和腿肌等八个组织中表达量很少,因此,在鸭的这些外周组织中,有可能存在NPY的自分泌或旁分泌方式,来调节其生理机能,与Malmstrom (2001),Chen等(2005)等研究结果一致。
2.3 NPY基因选择性剪切
本研究分析讨论了NPY基因在鸭的不同组织部位,是否存在选择性剪接这一过程。该段序列覆盖第三外显子,第四外显子及部分3'未翻译端结构。因此存在选择性剪切可能性。选择性剪切是一种转录后加工的过程,通过这种加工可以明显地扩大了基因编码蛋白质的能力,在不同组织部位发挥特定的生理学作用。据估计,约有50%的人类基因存在选择性剪接,其中约有75% 都是编码与信号转导和基因调控相关的蛋白,从选择性剪接涉及的基因系统分类来看,选择性剪接多发生在免疫和神经等复杂系统。有报道证明在电鳐mRNA存在不同的翻译起始位点,以及小鼠NPY基因也存在不同长度大小的NPY基因mRNA前体。本实验在鸭的各组织中未发现NPY基因的在该区段存在选择性拼接。
3 材料和方法
3.1实验材料
随机采集处于360日龄处于产蛋期高邮鸭母鸭4只,取其下丘脑-垂体-性腺轴组织,包括下丘脑、垂体、卵巢组织,以及心脏、肝脏、脾脏、胰腺、肾脏、子宫、小肠、胸肌、腿肌等内脏和肌肉组织,保存于5倍体积Sample Protector中,-20℃冻存。
3.2主要仪器和试剂
荧光定量PCR仪器为Mx3000P (Stratagene公司),RNA提取用Trizol试剂购自Invitrogen公司,Sample Protector、AMV反转录酶、DNase Ⅰ(RNase free)、AMV逆转录酶、SYBR Premix Ex Taq荧光定量试剂盒等购自宝生物工程大连有限公司。
3.3引物的设计
由于目前鸭NPY序列未知,依据Genbank中与鸭进化地位比较相近的鸡NPY基因cDNA序列(登录号: NM_205473),参考人序列(登录号: NM_000905)、家兔序列(登录号: NM_001160286),分析NPY基因保守序列片断,应用Primer Premier 5.0软件包设计NPY引物1,上游引物序列5‘-ttgagggaaagcacagaaaaca-3’,下游引物序列5‘-acaaatatgat gaaggaaaactc-3’,扩增出特异性序列后测序,参照测序出的序列信息设计real time PCR 引物序列,目标序列长度130 bp,引物序列为:上游引物5’- ttgagggaaagcacagaaaaca-3‘;下游5‘-gatttgcttcagaggagtggaga-3’。以鸭ß-actin基因(登录号: EF667345.1)作为内参基因并设计其上游引物和下游引物,引物序列为上游引物5‘-accgcaaatgcttctaaacc-3’,下游引物5‘-atcctgagtcaagcgccaaa-3’,目标序列长度132 bp。引物均由上海生物工程有限公司合成。
3.4 RNA的提取和cDNA合成
将各组织样品按每100 mg组织加入1 mL Trizol 匀浆,采用trizol法提取RNA。为克服RNA溶液中痕量基因组DNA对RT-PCR的干扰,采用DNase Ⅰ (RNase free, 5 U/µL),按照使用说明处理后,采用酚-氯仿-异戊醇法抽提后,溶于DEPC水中。cDNA第一链的合成:PCR反应总体积为20 U/μL,包括总RNA 5 μg,oligo (dT)18 (0.5 μg/μL) 1 μL,Random 6 primer (0.2 μg/μL) 1 μL,Buffer 4 μL,dNTP (10 mmol/L each) 2 μL,RNase Inhibitor (20 U/μL) 1 μL,AMV (10 U/μL),加DEPC H2O至20 U/μL。反转录反应条件为:37 ℃ 15 min;然后85 ℃ 30 s。得到第一链cDNA用于下步PCR反应。
3.5 NPY基因cDNA序列的扩增及实时荧光定量
采用特异性NPY引物对1对取下丘脑组织反转录后cDNA溶液PCR扩增,纯化后测序。根据测序结果,设计引物对2采用荧光定量PCR引物,以ß-actin基因为管家基因,反应体系为:模板2 μL,SYBR Premix Ex taq (2×)12.5 μL,ROX Dye Ⅱ(50×) 0.5 μL,dH2O 9.5 μL,上下游引物(20 pmol/uL)各0.25 μL。总体系为25 μL。
实时荧光定量95℃ 30 s变性,共进行40 个循环扩增,每一循环包括95 ℃ 5 s、60 ℃ 20 min,并在每次循环结束后检测荧光;以每一个循环上升1℃,从60 ℃到95℃,全程采集荧光信号,获得熔解曲线。
3.5 统计处理
对于获取的NPY基因核心片断序列,采用美国国家生物技术信息中心(NCBI, National Center for Biotechnology Information, http://www.ncbi.nlm.nih.gov)网站的BLAST软件,将测序后获得的cDNA序列与GenBank数据库中已公布的cDNA序列进行同源性比对,对于得到的进行不同来源的NPY序列采用MEGA4.1软件进行分子进化比较分析。
相对定量分析以鸭ß-actin基因为参照基因,利用Ct 值计算各组织部位中mRNA相对表达量,详见参考文献(Wong and Medrano, 2005),标准其计算公式为:mRNA 相对表达量= 2-ΔΔCt,△△Ct=△Ct目的组织-△Ct标准组织,△Ct目的组织=Ct目的基因-Ct参照基因,△Ct参照组织=Ct目的基因-Ct参照基因。
参照组织样品为每只鸭各组织部位混合后RNA池。利用SPSS 13.0 软件进行统计作图分析。
致谢
感谢国家自然科学基金(30940052)、江苏省科技服务平台项目(BM2008170)、江苏省高技术研究计划(BG2007323)和江苏省六大人才高峰项目的共同资助。
参考文献
Aboumder R., Elhusseing A., Cohen X., Olivier A., Stanimirovic D., Quirion R., and Hamel E., 1999, Expression of neuropeptide Y receptors mRNA and protein in human brain vessels and cerebromicrovascular cells in culture, Blood Floow Metab., 19(2): 155-163 doi:10.1097/00004647-199902000-00007
Barnea A., Aguila-Mansilla N., Bigio EH., Worby C., and Roberts J., 1998, Evidence for regulated expression of neuropeptide Y gene by rat and human cultured astrocytes, Regul Pept., 25;75-76: 293-300
Blomqvist A.G., Söderberg C., Lundell I., Milner R.J., and Larhammar D., 1992, Strong evolutionary conservation of neuropeptide Y: sequences of chicken, goldfish, and Torpedo marmorata DNA clones, Proc. Natl. Acad. Sci. USA., 89(6): 2350-2354 doi:10.1073/pnas.89.6.2350
Cerda-Reverter J.M., and Larhammar D., 2000, Neuropeptide Y family of peptides:structure, anatomical expression, function, and molecular evolution, Biochem. Cell Biol., 78(3): 371-392 doi:10.1139/bcb-78-3-371
Chen R., Li W.S., and Lin H.R., 2005, cDNA cloning and mRNA expression of neuropeptide Y in orange spotted grouper, Epinephelus coioides, Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 142(1):79-89 doi:10.1016/j.cbpc.2005.06.003 PMid:16005251
Eurin J., Barthelemy C., Masson F., Maistre G., Soualmia H., Noé E., Sarfati E., Eurin B., and Carayon A., 2000, Release of neuropeptide Y and hemodynamic changes during surgical removal of human pheochromocytomas, Regul. pept., 86(1): 95-102 doi:10.1016/S0167-0115(99)00092-0
Griffin D., Minth C.D., and William L., 1994, Isolation and characterization of the xenopus laevis cdna and genomic homologs of neuropeptide Y, Molecular and Cellular Endocrinology, 101(1-2): 1-10 doi:10.1016/0303-7207(94)90213-5
Larhammar D., 1996, Evolution of neuropeptide Y, peptide YY and pancreatic polypeptide, Regul Pept., 62(1): 1-11 doi:10.1016/0167-0115(95)00169-7
Malmstro¨m R.E.,2001, Existence of both neuropeptide Y, Y1 and Y2 receptors in pig spleen Evidence using subtype-selective antagonists in vivo. Life Sci.,69(17):1999-2005
doi:10.1016/S0024-3205(01)01286-3
Martí E., Biffo S., and Fasolo A., 1992, Neuropeptide Y m-RNA and peptide are transiently expressed in the developing rat spinal cord, Neuroreport, 3(5): 401-404 doi:10.1097/00001756-199205000-00006 PMid:1633276
Neveu I., Rémy S., and Naveilhan P., 2002, The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum, Neuroscience, 113(4): 767-777 doi:10.1016/S0306-4522(02)00256-7
Ni Y.D., Zhou Y.C., Wang Y.J., Lu L.Z., Chen J., and Zhao R.Q., 2005, Difference in sexual maturation ages and levels of hypothalamic GnRH-1, POMC and NPY mRNA in Shaoxing ducks during long-or short-day photoperoids, Dongwuxue Yanjiu (Zoological Research), 26(5): 539-544 (倪迎东, 周玉传, 王亚菊, 卢立志, 陈杰, 赵茹茜, 2005, 长短日照下绍鸭性成熟时间, 下丘脑GnRH-I、POMC和NPY mRNA表达的差异, 动物学研究, 26(5): 539-544)
Schwarz H., Villiger P., von Kempis J., and Lotz. M., 1994, Neuropeptide Y is an inducible gene in the human immune system, Journal of Neuroimmunology., 51(1): 53-61 doi:10.1016/0165-5728(94)90128-7
Strausberg R.L., Feingold E.A., Grouse L.H., Derge J.G., Klausner R.D., Collins F.S., Wagner L., Shenmen C.M., Schuler G.D., Altschul S.F., Zeeberg B., Buetow K.H., Schaefer C.F., Bhat N.K., Hopkins R.F., Jordan H., Moore T., Max S.I., Wang J., Hsieh F., Diatchenko L., Marusina K., Farmer A.A., Rubin G.M., Hong L., Stapleton M., Soares M.B., Bonaldo M.F., Casavant T.L., Scheetz T.E., Brownstein M.J., Usdin T.B., Toshiyuki S., Carninci P., Prange C., Raha S.S., Loquellano N.A., Peters G.J., Abramson R.D., Mullahy S.J., Bosak S.A., McEwan P.J., McKernan K.J., Malek J.A., Gunaratne P.H., Richards S., Worley K.C., Hale S., Garcia A.M., Gay L.J., Hulyk S.W., Villalon D.K., Muzny D.M., Sodergren E.J., Lu X., Gibbs R.A., Fahey J., Helton E., Ketteman M., Madan A., Rodrigues S., Sanchez A., Whiting M., Madan A., Young A.C., Shevchenko Y., Bouffard G.G., Blakesley R.W., Touchman J.W., Green E.D., Dickson M.C., Rodriguez A.C., Grimwood J., Schmutz J., Myers R.M., Butterfield Y.S., Krzywinski M.I., Skalska U., Smailus D.E., Schnerch A., Schein J.E., Jones S.J., Marra M.A., and Mammalian Gene Collection Program Team, 2002, Generation and initial analysis of more than 15 000 full-length human and mouse cDNA sequences, Proc. Natl. Acad. Sci., USA, 99(26): 16899-16903 doi:10.1073/pnas.242603899 PMid:12477932 PMCid:139241
Sundstrom G., Larsson T.A., Brenner S., Venkatesh B, and Larhammar D., 2008, Evolution of the neuropeptide Y family: new genes by chromosomeduplications in early vertebrates and in teleost fishes, Gen. Comp. Endocrinol., 155(3): 705-716 doi:10.1016/j.ygcen.2007.08.016 PMid:17950734
Tatemoto K., 1982, Neuropeptide Y: complete amino acid sequence of the brain peptide, Proc. Natl. Acad. Sci., USA, 79(18): 5485-5489 doi:10.1073/pnas.79.18.5485
Wong M.L., and Medrano J.F., 2005, Real-time PCR for mRNA quantitation, Biotechniques, 39(1): 75-85 doi:10.2144/05391RV01 PMid:16060372