 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2010 年, 第 29 卷, 第 8 篇 doi: 10.5376/gab.cn.2010.29.0008
收稿日期: 2010年10月28日 接受日期: 2010年12月15日 发表日期: 2010年12月31日
刘福平, 2010, ABA溶液预处理蝴蝶兰类原球茎及脱水耐性的效应, 基因组学与应用生物学(Online) Vol.29 No.8 (doi: 10.5376/ gab.cn.2010.29.0008)
为了解ABA溶液预处理对蝴蝶兰类原球茎(PLB)的影响及对耐脱水性的效应,本研究观测H2O浸泡PLB对耐脱水性的效应,H2O、ABA溶液预处理对PLB的影响, 以及ABA溶液预处理PLB的耐脱水性。结果显示新鲜或浸水的PLB脱水处理后脱水重/鲜重比值相差不大,但浸水PLB的含水率和成活率明显提高。H2O或ABA溶液浸泡1 h的PLB后的重量(浸泡重)差异不显著,H2O或ABA溶液浸泡不能明显改变PLB干物质重量、相对电导率和成活率。80 μmol/L的ABA溶液预处理使PLB脱水处理后的脱水重/鲜重比值提高24.8%,成活率提高51.5%,与用H2O预处理的相比,经ABA处理的PLB能在保持成活率的情况下忍受较高的失水程度。以上结果说明,ABA溶液短时间预处理并不能改变蝴蝶兰PLB重量和造成损伤。ABA预处理能(稍微)提高脱水处理后PLB含水率,只是脱水耐性的提高的原因之一。
脱落酸(ABA)是植物逆境激素,面对水分胁迫它具有维持胞内水分和胁迫修复的双重作用,成功应用于提高愈伤组织耐渗透胁迫、顽拗性种胚耐脱水能力和体细胞胚(人工种子)干化耐受性等。兰科植物种质离体保存日益受到重视和普及,用ABA预处理能提高原球茎或类原球茎(PLB, protocorm-like bodies)干化耐受性,如苞舌兰(Spathoglottis plicata)原球茎(Wang et al., 2002)和铁皮石斛(Dendrobium candidum) PLB(刘伟等, 2006),也提高万带兰(Vanda pumila) PLB (Na and Kondo, 1996)和铁皮石斛原球茎(王君晖等, 1999)玻璃化超低温保存性能,蝴蝶兰(Phalaenopsis)产业的蓬勃发展推动种质方面的应用基础研究,但尚未见有关提高原球茎或PLB耐脱水性的报道,作者已经对不同脱水条件下蝴蝶兰PLB的失水程度与耐脱水性进行了研究(刘福平和陈丽璇, 2010),并阐明以脱水重/鲜重比值表示材料失水程度的可行性,本文进行外源ABA提高蝴蝶兰PLB耐脱水性实验。
植物组织含水率是影响脱水后材料成活率的关键因素,一般认为它们有相同的消长趋势,关于ABA预处理植物离体组织及脱水处理后组织含水率(与其它指标关系)的报道不多。普遍用外源ABA长时间预处理植物材料,以致在脱水处理前材料的耐脱水性指标已经发生改变,如陆旺金和傅家瑞(1997)在梯度蔗糖加ABA预培养黄皮(Clausena lansium)胚轴,吴诗光等(2001)将芦苇(Phragmires communis)胚性愈伤组织在含ABA培养基上预培养,Wang等(2002)在含ABA培养基预培养苞舌兰原球茎。预处理期间耐脱水性相关指标的改变,无疑将影响到脱水期间材料的耐脱水性。本实验中ABA是以水溶液形式处理(浸泡)蝴蝶兰PLB,所以首先测定H2O浸泡对PLB脱水处理后相关指标的影响,比较H2O、ABA预处理PLB后重量和伤害指标变化,分析ABA溶液预处理与PLB的耐脱水性的关系。对ABA溶液预处理提高蝴蝶兰PLB耐脱水性的效应,从过程上以期有较为详细了解。
1结果与分析
1.1 H2O浸泡蝴蝶兰类原球茎的耐脱水性
新鲜PLB和浸水PLB经43%湿度脱水处理2 d后的脱水重/鲜重比值、含水率和成活率变化见表1,脱水后的PLB脱水重/鲜重比值相差不大,即单位鲜重的PLB脱水处理后的失水量相差不大。H2O浸泡的PLB经过43%脱水后的含水率和成活率均较新鲜PLB有较大幅度地提高,分别提高了40.6%和33.3%。
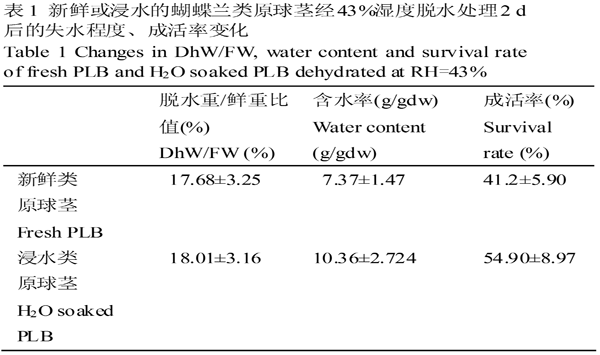 表1 新鲜或浸水的蝴蝶兰类原球茎经43%湿度脱水处理2 d后的失水程度、成活率变化 |
1.2 H2O、ABA预处理蝴蝶兰类原球茎后重量和损伤效应
新鲜PLB和以H2O、80 mmol/L ABA溶液各浸泡1 h的PLB,分别测定PLB取样时鲜重、浸泡吸水后的浸泡重、干重和相对电导率指标,结果见表2。
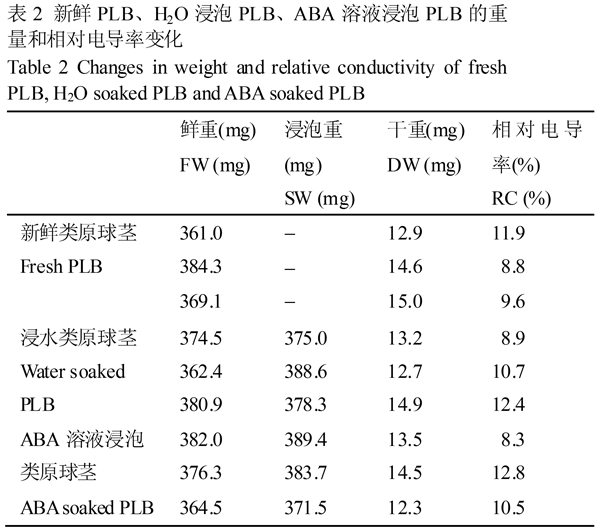 表2 新鲜PLB、H2O浸泡PLB、ABA溶液浸泡PLB的重量和相对电导率变化 |
为了解ABA溶液预处理对PLB重量和相对电导率的效应,对表2的数据进行单因素方差分析,结果见表3。
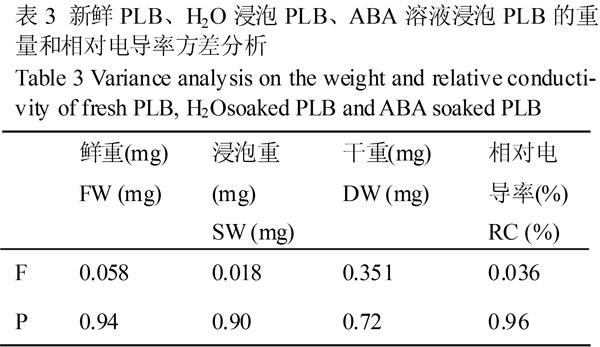 表3 新鲜PLB、H2O浸泡PLB、ABA溶液浸泡PLB的重量和相对电导率方差分析 |
表3中4个指标差异性方差分析,F值都小于1,P值都大于0.05,表明差异不显著。即用于H2O或ABA溶液浸泡的PLB材料鲜重没有显著差异前提下,H2O或ABA溶液浸泡后的PLB浸泡重指标差异不显著,新鲜PLB、PLB用H2O或ABA溶液浸泡后PLB所含的干物质重量、相对电导率也是没有明显变化。PLB经H2O浸泡后的平均重量较浸水前提高了2.15%,PLB经ABA溶液浸泡后的平均重量较浸水前提高了1.95%,PLB浸泡后的干重没有增加而浸泡重增加,可认为只是组织吸收水分所致。此外,三种PLB转入常规培养基,成活率都是100%。
1.3 ABA预处理提高蝴蝶兰类原球茎的耐脱水性
不同浓度ABA溶液预处理蝴蝶兰PLB 1 h,于37%相对湿度下脱水,PLB脱水重/鲜重比值和成活率都有所提高(图1),其中以80 μmol/L的ABA预处理的成活率较对照(H2O浸泡)提高了51.5%,脱水重/鲜重比值较对照提高了24.8%,即单位鲜重的材料脱水处理后的重量较大,所以经ABA处理的PLB脱水处理后能保持较多的水分。以80 μmol/L的ABA预处理PLB脱水后的成活率(56.5±6.69)%,稍高于表1中浸水PLB于43%相对湿度下脱水后的成活率(54.90±8.97)%,经ABA预处理的脱水重/鲜重比值(14.48±0.61)%却明显低于后者的(18.01±3.16)%,脱水重/鲜重比值与单位鲜重PLB脱水后的失水量成反比,即经ABA处理的PLB,脱水后的失水量较大,所以ABA处理的PLB能保持成活率的情况下忍受较高的失水程度。
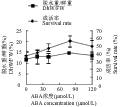 图1 不同浓度ABA溶液预处理蝴蝶兰类原球茎于37%相对湿度下脱水后的失水程度和成活率 |
2讨论
关于H2O浸泡蝴蝶兰PLB对失水程度和成活率的影响,在H2O浸泡1 h后,PLB因吸水而鲜重增加,即含水率提高了,与新鲜PLB经同样相对湿度脱水,H2O浸泡PLB脱水后含水率也相应提高,含水率的提高降低了PLB所受的脱水胁迫损伤程度,以致H2O浸泡的PLB脱水处理后有较高的成活率。
培养基附加ABA预处理植物离体组织后组织含水率与其它指标关系的报道不多。陆旺金和傅家瑞(1997)预培养黄皮胚轴2 d后,组织含水量比对照稍有提高,胚轴活力指数明显降低。吴诗光等(2001)和陈龙等(2002)将两个生态型芦苇胚性愈伤组织预培养15 d,与对照相比相对含水率明显降低,质膜透性明显提高,愈伤组织生长量和细胞相对活力稍有降低。Wang等(2002)预培养苞舌兰原球茎7 d,原球茎含水率比对照明显降低,第14天,原球茎的鲜重、干重增加量明显不如对照。刘伟等(2006)把铁皮石斛PLB粒切块,以ABA溶液预处理24 h,质膜透性提高约40%。在上述例子中,ABA预处理一般时间较长,大部分个案ABA处理使材料质膜透性提高,活力降低。本实验用ABA溶液短时间(1 h)浸泡蝴蝶兰PLB,PLB浸泡重、干重、相对电导率和成活率较对照均没显著变化,即不改变PLB重量指标,也不造成损伤(浸泡期间的生化指标变化将另文发表)。
ABA预处理的植物组织脱水(渗透)处理后,组织含水率与活力指数(陆旺金和傅家瑞, 1997)或生长量(吴诗光等, 2001; 陈龙等, 2002)基本上呈一致的消长趋势。ABA预处理可提高铁皮石斛PLB的可溶性多糖含量(刘伟等, 2006),或提高原球茎可溶性糖(蔗糖)、可溶性蛋白(脱水素)等水平,降低细胞渗透势,耐脱水性的增加主要是原球茎减少了水分丧失(Wang et al., 2002)。所以用ABA预培养的材料,只要在脱水处理之前材料含水率与对照相同,脱水后的含水率较对照有所提高,本实验结果支持这一观点。经ABA处理的蝴蝶兰PLB,能在保持成活率的情况下忍受较高的失水程度,类似的报道有,ABA处理的苞舌兰原球茎有较低的致死临界含水率(Wang et al., 2002),原因可能是ABA促使细胞启动了损伤修复机(如增加抗氧化活性等),虽然组织丧失一定的水分,却能减轻细胞的脱水伤害,以致PLB有较高的成活率。所以ABA预处理提高PLB脱水耐性,并非只是因ABA能(稍微)提高脱水处理后PLB含水率所导致。
植物组织水分状况是影响材料耐脱水性的关键因素,用ABA溶液预处理蝴蝶兰PLB,其实包括H2O和ABA本身的两种效应,H2O浸泡因提高PLB含水量而在脱水处理后获得较高成活率。前人试验发现培养基附加ABA较长时间预培养植物离体材料,组织的生理生化乃至活力指数就有所变化,也就是造成一定的损伤。本实验用ABA溶液短时间浸泡PLB,并不改变脱水处理前的物理指标也不造成损伤,可以较单纯、明确地了解ABA预处理材料在脱水胁迫条件下的反应。虽然ABA溶液短时间预处理的蝴蝶兰PLB脱水后含水量稍有提高,仅是耐脱水性增强的因素之一,本实验间接证明了在受胁迫组织失水情况下,ABA可以启动修复保护机制,减轻脱水伤害。
3材料与方法
3.1实验材料
蝴蝶兰(Phalaenopsis) PLB培养方法见参考文献(刘福平等, 2007),PLB在1/2MS+CW (椰子汁) 20% (v/v)+蔗糖2% (w/v)培养基继代繁衍,得到成熟的PLB团。取材时从PLB团拨下外观匀称的中等大小(350~400 mg/17粒) PLB单粒为实验材料。
3.2 H2O浸泡蝴蝶兰类原球茎的耐脱水性
将新鲜PLB和于25℃下H2O浸泡1 h的PLB,待脱水PLB置入直径2.5 cm、高度4 cm的玻璃称量瓶,每瓶17粒,平铺瓶底,以一层中速定量滤纸封口,称量瓶放入一定湿度的无色透明玻璃干燥器,每个干燥器放4个称量瓶。干燥器下层盛装饱和K2CO3溶液以保持容器上层相对湿度(RH)恒定为43%。以德图608-H2温湿度表(RH精度±2%, 温度精度±0.5℃)测定干燥器内即时温湿度。PLB脱水温度25℃,光照强度1 500 Lux左右,12 h/d,脱水处理2 d后从干燥器取出测定脱水重/鲜重、含水率、成活率指标。
3.3 H2O、ABA溶液浸泡对蝴蝶兰类原球茎重量和损伤的效应
一定鲜重的PLB分别经H2O、80 μmol/L的ABA溶液于25℃下浸泡1 h,吸干表面水分,测定浸泡重、干重和相对电导率,接种在培养基观测PLB成活率。
3.4 ABA预处理对蝴蝶兰类原球茎耐脱水性的效应
PLB分别以各种浓度经过滤除菌的ABA溶液(0、20、40、80、120 μmol/L)于25℃下浸泡1 h,吸干表面水分,脱水方法同“H2O浸泡蝴蝶兰类原球茎对失水程度和脱水损伤的影响”实验步骤,脱水湿度37% (干燥器下层盛50.1% H2SO4溶液),脱水2 d后测定脱水重/鲜重、成活率指标。
3.5检测方法
蝴蝶兰PLB干重测定采用105℃烘干恒重法;PLB含水率单位为g/gdw;PLB耐脱水水能力(或失水程度)以脱水后PLB重/取样鲜重百分比值(脱水重/鲜重)表示来表示;相对电导率(质膜透性)以Thermo 3-STAR电导仪按汤章成(1999, 科学出版社, pp.263-265)介绍方法;测脱水后PLB成活率,将脱水PLB接入配方1/2MS+6BA 3.0 mg/L (培养基)+CW (椰子汁) 20% (v/v)+蔗糖2%(w/v)的培养基,培养温度24~26℃,光照强度1 500 Lux左右,12 h/d,培养1个月计算PLB成活率。每种分析测定重复3次以上记录数据。
致谢
本研究由福建省自然科学基金资助项目(2009J01079)资助。
参考文献
Chen L., Liu H.P., and Zhang C.L., 2002, Response of protein in calluses from reed ecotypes to osmotic stress and exogenous ABA, Huabei Nongxuebao (Acta Agriculturae Boreali-Sinica), 17(3): 41-45 (陈龙, 刘怀攀, 张承烈, 2002, 芦苇愈伤组织中蛋白质对渗透胁迫和外源ABA的响应, 华北农学报, 17(3): 41-45)
Liu F.P., and Chen L.X., 2010, Dehydration degree and dehydration tolerance of Phalaenopsis PLB dryed under different conditions. Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 29(5): 931-936 (刘福平, 陈丽璇, 2010, 不同脱水条件下蝴蝶兰类原球茎的失水程度与耐脱水性, 基因组学与应用生物学, 29(5): 931-936)
Liu F.P., Hong L.P., and Zheng M.Q., 2007, Effects of 6−BA, 2,4−D on PLB explants induction from Phalaenopsis, Jiangxi Nongye Xuebao (Acta Agriculturae Jiangxi), 19(8): 69-71 (刘福平, 洪丽萍, 郑明琼, 2007, 6-BA、2,4-D诱导蝴蝶兰类原球茎外植体的研究, 江西农业学报, 19(8): 69-71)
Liu W., Pan R.C., Leng J.Y., and Ye Q.S., 2006, The influence of abscisic acid treatment on desiccation tolerance in Dendrobium candidum protocorm-like bodies, Zhiwu Shengli Yu Fenzi Shengwuxue Xuebao (Journal of Plant Physiology and Molecular Biology), 32(3): 369-374 (刘伟, 潘瑞炽, 冷佳奕, 叶庆生, 2006, 脱落酸处理对铁皮石斛类原球茎体耐脱水性的影响, 植物生理与分子生物学学报, 32(3): 369-374)
Lu W.J., and Fu J.R., 1997, The induction of desiccation tolerance in wampee (Clausena lansium Skeels) embryo nicaxes, Zhongshan daxue Xuebao (Zirankexue Ban) (Acta Scientiarum Naturalium Universitatis Sunyatseni), 36(4): 118-120 (陆旺金, 傅家瑞, 1997, 黄皮胚轴耐脱水性的诱导, 中山大学学报(自然科学版), 36(4): 118-120)
Na Y.H., and Kondo K., 1996, Cryopreservation of tissue-culture shoot primordial from shoot apices of cultured protocorms in Vanda pumila following ABA preculture and desiccation, Plant Science, 118: 195-201 doi:10.1016/0168-9452(96)04438-X
Wang J.H., Zhang Y.X., Liu F., Huang C.N., and Ge J.G., 1999, Cryopreservation of seeds, protocorm and protocorm-like-bodies of Dendrobium candidum, Yuanyi Xuebao (Acta Hortieculturae Sinica), 26(1): 59-61 (王君晖, 张毅翔, 刘峰, 黄纯农, 葛霁光, 1999, 铁皮石斛种子、原球茎和类原球茎体的超低温保存研究, 园艺学报, 26(1): 59-61)
Wang X.J., Loh C.S., Yeoh H.H., and Sun W.Q., 2002, Drying rate and dehydrin synthesis associated with abscisic acid-induced dehydration tolerance in Spathoglottis plicata orchidaceae protocorms, Journal of Experimental Botany, 53(368): 551-558 doi:10.1093/jexbot/53.368.551 PMid:11847254
Wu S.G., Chen L., Liu H.P., and Zhang C.L., 2001, Some physiological response of the calluses from reed ecotyto osmotic stress and exogenous ABA, Huabei Nongxuebao (Acta Agriculturae Boreali-Sinica), 16(3): 35-39 (吴诗光, 陈龙, 刘怀攀, 张承烈, 2001, 芦苇愈伤组织对渗透胁迫和ABA的若干生理响应, 华北农学报, 16(3): 35-39)