2. 海南省农作物分子育种重点实验室, 三亚, 572025
3. 海南省热带农业资源研究所, 三亚, 572025
4. 浙江嘉兴市蚕种场, 嘉兴, 314000
* 同等贡献作者
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 4 篇 doi: 10.5376/gab.cn.2011.30.0004
收稿日期: 2011年01月08日 接受日期: 2011年01月18日 发表日期: 2011年01月30日
引用格式(中文):
谢柳等,2011, 从僵死家蚕中分离的高毒力Bt菌株W015-1的特征及其cry1Ac22基因鉴定,基因组学与应用生物学(online),Vol.30 No.4 pp.1016-1025 (doi: 10.5376/gab.cn.2011.30.0004)
引用格式(英文):
Xie et al., 2010, Characterization of a new highly toxic isolate of Bacillus thuringiensis from the Diapausing Larvae of silkworm and identification of cry1A22 gene, Bt Research Vol 1 No 1 (doi: 10.5376/bt.2010.01.0001)
我们从浙江省杭嘉湖地区收集了100份滞育僵死家蚕的幼蚕,解剖这些僵死的幼蚕的肠道,从中肠中分离出240份芽孢杆菌,从中鉴定出6株苏云金芽孢杆菌。经过小菜蛾生物测定获得一株高毒力的苏云金芽孢杆菌(Bt)菌株W015-1,菌株编号20050509W015。扫描电镜观察显示该菌株在形成芽孢的同时高产菱形晶体蛋白,SDS-PAGE分析表明,该蛋白约为130 kD的杀虫晶体蛋白。本研究采用脉冲场电泳(pulsed field gel elecctrophoresis, PFGE)用来分析Bt菌株W015-1的大质粒,结果表明Bt W015-1的大质粒的数量、大小及带型谱和Bt模式菌株HD73的几乎没有差异,但与HD1和Bti则有明显的不同。采取了PCR-RFLP方法鉴定W015-1菌株的cry基因型,结果显示与标准菌株HD73的cry1Ac基因型有明显的酶切位点的差异。采用PCR-RFLP结合反向PCR方法克隆了编码该杀虫晶体蛋白的基因。序列分析表明该基因编码序列为3 537 bp,编码1 178个氨基酸残基的蛋白质(accession number EU282379)。和已经克隆的cry1Ac1基因氨基酸序列相似性最高,在233 (T/R)、448 (M/I)和1158 (K/E)3个位点和cry1AC1不同,该cry1Ac基因已经被Bacillus thuringiensis毒素命名委员会正式命名为cry1Ac22。将cry1Ac22基因编码序列克隆到表达载体pQE30,转入大肠杆菌M15中能够表达130 kD的蛋白,表达蛋白进行生物测定表明Cry1Ac22蛋白对鳞翅目昆虫小菜蛾(Plutella xylostella)很高的杀虫活性。鉴于Bt W015-1在质粒谱、Cry基因酶切位点、毒性蛋白产量及对鳞翅目的杀虫活性等方面的不同,我们认为Bt W015-1可用作以Btk菌株为基础的生物杀虫农药的替代菌株。
鳞翅目是继鞘翅目之后最具有生物多样性的昆虫种群,昆虫种类多达160 000种以上。其中,不仅包含多种高危害性农业、林业以及仓存物害虫,也有对人类十分重要的经济昆虫,如家蚕。家蚕或许是被人类高度驯化的具有重要经济价值的鳞翅目昆虫(Kristensen et al., 2007; Khajuria et al., 2009)。
在中国养蚕巢丝有几千年的历史。蚕农在养蚕过程面临最大的问题就是家蚕感染病菌,变得生长缓慢,变成僵蚕而死。众所周知,僵蚕大都是由苏云金芽孢杆菌感染造成的(Ohba, 1996)。仅仅是在中国浙江省杭嘉湖地区,中国著名的丝绸之乡,每年因苏云金芽孢杆菌感染而造成的损失不可估量。
苏云金芽孢杆菌在芽孢形成过程中产生一种伴孢晶体毒蛋白,这种Bt毒素通常在昆虫的中肠发生作用,Bt的原毒素被昆虫中肠道内的蛋白酶激活从而转化为具有活性的毒素物质,激活后的毒素结合到特定的受体上从而表现出毒性。大量的研究表明Bt毒素和昆虫肠道的反应是由许多在昆虫肠道里的许多基因产物所决定的,这些基因产物包括许多涉及到Bt原毒素活性、毒素与受体之间的结合以及毒素的降解的蛋白质和酶。这意味着Bt毒素与昆虫中肠形成了一个体系,在这些体系中的任何的变化都可以影响到Bt的特异性和效率,从而会影响到Bt对各种昆虫的毒杀作用(Crickmore et al., 1998; Knowles, 1994)。
家蚕作为第一个全基因组测序完成的鳞翅目昆虫种类,已经成为研究鳞翅目昆虫的模式昆虫(Mita1 et al., 2004)。在家蚕中肠中分离高毒力Bt菌株,鉴定Bt毒蛋白基因,对进一步直接弄清昆虫对Bt毒素抗性具有重要意义。
本研究在浙江嘉兴地区养蚕户中收集滞育僵死家蚕的幼蚕,解剖这些僵死的幼蚕的肠道,利用采用醋酸钠—温度筛选法从中肠组织和粘液中分离芽孢杆菌,通过染色、晶体形状镜检、SDS-PAGE、质粒谱和生测等手段鉴定Bt菌株,并用分子手段研究菌株的基因型和Bt毒素基因。
1结果与分析
1.1芽孢菌及Bt菌的分离
我们从浙江省杭嘉湖地区收集了100份滞育僵死家蚕的幼蚕,解剖这些僵死的幼蚕的肠道,应用醋酸钠温度分离法从中肠中分离出218株芽孢杆菌,根据光学油镜和扫描电镜观察菌株在芽孢形成期是否产生伴孢蛋白,从中鉴定出6株苏云金芽孢杆菌。利用菌株粗蛋白对鳞翅目昆虫小菜蛾进行生物活性测定,鉴定出具有杀虫活性Bt菌株2株,其中苏云金芽孢杆菌(Bt)菌株W015-1对小菜蛾的活性最强(数据未列出),该菌株保存在HITAR的菌株库,菌株编号20050509W015。
1.2菌株W015-1的晶体蛋白观察
菌株在BP固体培养基上30℃恒温培养3 d,挑取菌苔在扫描显微镜中观察Bt W015-1伴孢晶体蛋白(图1),发现 Bt W015-1菌株的营养体成棒状,两端鞭毛明显,可能有助于菌株运动,芽孢为椭圆形,其伴胞晶体为典型的菱形晶体蛋白。 SDS-PAGE分析Bt W015-1菌株蛋白,如图2所示,菌株Bt W015-1进入生长后期第20小时开始表达为约130 kD的蛋白,而且后面随着培养时间推移130 kD蛋白带逐渐变亮,SDS-PAGE分析表明伴孢晶体蛋白的分子量约为130 kD的蛋白。伴孢晶体蛋白用1 µmol/L的胰蛋白酶处理可水解成约80 kD的活性多肽(图片未列出)。
.png) 图1 扫描电镜观察Bt W015-1芽孢和伴孢(6.6 mm×15 k) |
.png) 图2 SDS-PAGE分析Bt菌株W015-1的晶体蛋白 |
1.3菌株W015-1质粒谱
Bt菌株一般含有大质粒DNA,大多数cry基因都定位于大质粒DNA (Carlson et al., 1996)。因此大质粒数量和分子量大小能够进一步作为Bt菌株自身的特征(Procar et al., 1999; Vilas-Boas et al., 2004)。本研究采用脉冲场电泳(pulsed field gel electrophoresis, PFGE)用来分析Bt菌株W015-1的大质粒,并与标准Bt菌株Bti、HD1和HD73的大质粒谱进行比较(图3),结果表明Bt W015-1的大质粒的数量、大小及带型谱和Bt模式菌株HD73的几乎没有差异,但与HD1和Bti则有明显的不同。
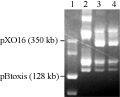 图3 Bt W015-1菌株大质粒谱的脉冲场电泳分析 |
1.4杀虫蛋白的基因型鉴定
利用PCR-RFLP方法对W015-1菌株的cry基因型进行了鉴定(供试的全部通用引物资料未列出),其中引物K5un2/K3un2扩增产物1.6 kb左右,用限制内切酶PstI 和XbaI同时消化,酶切产物片段大小分别为约820 bp、550 bp和320 bp,与理论值分别为801 bp、518 bp和322 bp相比均要大一些。引物K5un3/K3un3扩增产物大小约为1.4 kb,用PstI 和EcoRI同时消化,酶切产物大小分别为800 bp、470 bp和280 bp,与理论值分别为726 bp、434 bp、244 bp和59 bp相比均要大一些,并且缺失了对应的59 bp的酶切带。尽管PCR扩增产物与标准菌株HD73的cry1Ac基因片段大小一致,但是与其PCR-RFLP带谱恰有明显的差异存在(图4),说明菌株W015-1可能含有与标准菌株HD73不同的cry1Ac类基因。纯化的PCR产物插入pMD18-T载体形成重组质粒pMDK2和pMDK3进行测序(BGI, Beijing, China),获得序列通过ncbi网站提供的blastx程序在数据库Non-redundant protein sequences进行序列同源性搜索,结果表明PCR片段序列和cry1Ac1基因表现出最大相似性(结果未列出),因此,可以初步判断Bt菌株W015-1含有cry1Ac类基因。
 图4 PCR-RFLP分析Bt菌株W015-1和HD73中cry1A基因型 |
1.5 cry1Ac22基因克隆及序列分析
为了获得Bt菌株W015-1中cry1Ac基因全序列,本实验采取了反向PCR策略,根据质粒pMDK2和pMDK3序列设计了反向PCR引物cryI5/cryI3,分析已分离的cry1Ac基因序列和已经测序的序列的限制内切酶酶切位点,选择NedⅠ、SalⅠ、BglⅡ和BamHⅠ分别完全消化菌株W015-1质粒DNA,然后65℃水浴15 min使限制性内切酶失活,接着加入T4 连接酶随机将酶切片段自连成环。以酶切片段的自连产物为模板,进行反向PCR扩增,其中NedⅠ酶切连接产物为模板的扩增出了大约1.6 kb片段(图5)。将1.6 kb PCR扩增产物亚克隆到pMD18-T形成重组子质粒pMDIS,测定重组子序列。利用重组子pMDK2、pMD1K3和pMDIS的序列之间重组序列,拼接组装成一段3 772 bp的DNA序列,而且其中含有一个3 534 bp的开放阅读框(ORF),根据拼接的序列,设计引物E1A5/E1A3 用来扩增完整ORF序列,PCR能够扩增出约为3.5 kb片段(图6),亚克隆测序进一步确定该基因的序列。
 图5反向PCR策略扩增cry1Ac基因全序列 |
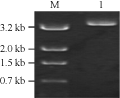 图6 PCR扩增cry1Ac22的全基因序列 |
该基因基因序列递交GenBank数据库(登录号为EU282379),该cry1Ac基因已经被Bacillus thuringiensis Toxin Nomenclature确认为一个新的cry1Ac基因,命名为cry1Ab22 (http://www. biols. susx. ac. uk /Home /Neil2Crickmore /Bt/ toxins. l),成为cry1Ac基因家族中的一个新成员。cry1Ac基因编码序列为3 534 bp,编码1 178个氨基酸,其中亲水性氨基酸占30.90%,疏水性氨基酸占32.64%,酸性氨基酸占13.83%,碱性氨基酸占11.43等电点为5.04,为弱酸性蛋白质。蛋白质的分子量(Mr)为133 kD,将基因序列与其它已报道的cry1Ac基因的核苷酸和氨基酸序列分别进行同源性比较(blastp),结果表明基因的核苷酸序列与已报道的cry1Ac的同源性最高,但在233 (T/R)、448 (M/I)和1158 (K/E) 3个位点和cry1Ac1不同。 利用clustalW和proDom程序(http://www.ebi.ac.uk/Tools/clustalw2/index.html;http://prodom.prabi.fr/prodom/current/html/form.php),Cry1Ac22蛋白与其它已知的Cry蛋白进行多重序列比和保守结构域分析,结果表明Cry1Ac22蛋白具有典型cry蛋白所具有的3个结构域及5个保守区特征(数据未显示)。通过同源建模预测Cry1Ac22的三维空间结构(http://swissmodel.expasy.org/workspace/index.php?func=modelling_simple1) (图7),结果表明Cry1Ac22蛋白三维空间结构与Cry1Aa和Cry3Aa高度一致,后者已经通过X-衍射分析确立了三维空间结构。
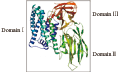 图7 Cry1Ac22蛋白的三维空间结构 |
1.6 cry1Ac22基因表达及生物活性测定
重组质粒pQE30-cry1Ac22转入大肠杆菌M15,含有重组子pQE30-cry1Ac22的M15细胞在TB培养基(Amp 100 µg/mL, Kan 12.5 µg/mL)中37℃,220 r/min培养2 h至OD600约为0.6,加入Isopropyl β-D-1-Thiogalactopyranoside (IPTG)至浓度为0.4 mmol/L,然后在30℃,220 r/min条件培养6~12 h,在T5启动子控制下诱导cry1Ac22基因表达。进行SDS-PAGE分析表明在细胞在IPTG诱导作用下细胞蛋白明显多了130 kD大小的蛋白带,没有IPTG诱导细胞蛋白则没有相应的蛋白带。由于表达Cry1Ac22融合蛋白主要以包涵体形式存在,为了提高其水溶性,将蛋白溶于50 mmol/L的Na2CO3 (pH 10.0)溶液中,并加入胰蛋白酶(Typsin),将表达蛋白水解成约为80 kD大小活性多肽(图8)。
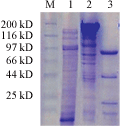 图8 SDS-PAGE分析cry1Ac22基因在大肠杆菌M15细胞中的表达 |
取胰蛋白酶(Typsin)酶解好的蛋白进行杀虫生物活性测定,稀释至适当浓度,涂布于甘蓝叶上,饲喂二龄小菜蛾幼虫,置于25℃培养箱内,观察幼虫生长状态(图9)。涂酶解好的蛋白的的1号,小菜蛾取食的叶片后,食欲减退,行动迟缓,30 h后基本死亡。而未涂酶解好的蛋白的的2号对照,小菜蛾食欲正常,生长状态良好,个体肥大。通过测定W015-1对小菜蛾害虫初孵幼虫的毒力,结果初步表明,Cry1Ac22蛋白对小菜蛾表现出相当高的杀虫活性(LC50: 4.135×108 cfu/mL; 95% FL: 3.368~5.122×108 cfu/mL)。
 图9 涂酶解好的蛋白的菜叶饲养的小菜蛾(A)和对照(B) |
2结论
本研究从僵死的家蚕幼蚕中分离出Bt菌株W015-1,对鳞翅目昆虫有很高杀虫活性。在芽孢形成期能产生菱形伴孢晶体,分子量大小约130 kD。Bt W015-1的大质粒的数量、大小及带型谱和Bt模式菌株HD73的几乎没有差异,但与HD1和Bti则有明显的不同。W015-1菌株的cry基因型与标准菌株HD73的cry1Ac基因型有明显的酶切位点的差异。
本研究克隆了Cry1Ac22基因,编码序列为3 537 bp,编码1 178个氨基酸残基,与cry1Ac1基因氨基酸序列高度相似,但在233 (T/R)、448 (M/I)和1158 (K/E)3个位点和cry1AC1不同。cry1Ac22基因能在大肠杆菌中表达130 kD的包涵蛋白,生物测定表明W015-1的Cry1Ac22蛋白对鳞翅目昆虫小菜蛾(Plutella xylostella)杀虫活性远比模式菌株HD73要高。
鉴于Bt W015-1在质粒谱、Cry基因酶切位点、毒性蛋白产量及对鳞翅目的杀虫活性等方面的不同,我们认为Bt W015-1可用作以Btk菌株为基础的生物杀虫农药的替代菌株。
3材料与方法
3.1僵蚕收集及其解剖
我们在浙江省嘉兴市选择养蚕农户,收集那些生长迟缓、厌食的家蚕放入事先准备好的15 mL试管中,每一条僵蚕为一个蚕样,并做好标记。这些僵蚕通常口腔与肛门常有吐泻排泄物的现象,严重的僵死蚕体色褐色或黑色。供试前,我们对僵蚕进行解剖,收集僵蚕肠道组织和粘液。
3.2芽孢菌的分离
芽孢菌分离方法参考(谢柳等, 2009)采用醋酸钠——温度筛选法,选取适量的僵蚕肠道组织和粘液放入20 mL BPA 培养基中,充分振荡,30℃ 摇床培养4~5 h,75℃水浴15 min,取1 mL 上清用无菌水按倍比法稀释到10-2和10-3涂NB平板(牛肉膏(beef extract) 5 g, 蛋白胨(peptone) 10 g, 氯化钠(NaCl) 34 g, 蒸馏水1 000 mL, pH 值7.0~7.4, 固体培养基为加入1.5% (w/v)琼脂粉, 121℃, 20 min 高压蒸汽灭菌),30℃ 倒置培养3 d,挑取形态各异的单菌落划平板,形成芽孢后,进一步用光学显微镜和电子显微镜观察分离株的形态特征,并细致观察分离株能否明显的看到有伴胞晶体的产生。
3.3菌株、质粒及培养基
本实验的菌株和质粒见表1,Bt W015-1菌株为本研究分离于浙江省杭嘉湖地区收集的僵死幼蚕中。B. thuringiensis subsp. Kurstaki、B. thuringiensis subsp. israelensis 作为参考菌株。载体pMD 18T Vector和pQE30分别用于DNA片段克隆和cry1Ac22的基因表达。Bt菌株在30℃条件生长在BP培养基(Lecadet et al., 1980)和G-Tris (Aronson and Thompson, 1971)大肠杆菌在LB培养基或TB培养基(12 g Bacto-tryptone, 24 g yeast extract, 4 mL glycerol ddH2O to 900 mL)中37℃条件培养。所有的培养基在121℃高压灭菌20 min后使用,固体培养基加入1%的琼脂粉。根据需要加入氨苄(Ampicillin, 100 μg/mL) 和卡娜(Kanamycin, 12.5 μg/mL)。
.png) 表1供试菌株和质粒 |
3.4扫描电子显微镜观察伴胞晶体
菌株在BP固体培养基平板上培养3 d,用灭菌的牙签刮取少量约 0.1 g菌苔,在光学显微镜下观察确认芽孢大量产生,用灭菌的冰冷的双蒸水反复洗涤3次,最后悬100 μL的双蒸水。然后取2 μL混合菌液菌液置于洁净的盖玻片上,涂布均匀,自然风干。然后用1%锇酸(OsO4)固定菌体,再将处理好玻片固定在载样台上,置真空喷镀仪内喷金(喷金厚度约20 nm),于S-3400N扫描电镜(HITACHI Ltd, Japan)在15 k伏电压下观察拍照(张文飞等, 2009)。
3.5 Bt菌株W015-1质粒谱分析
Bt菌株在LB培养基,30℃,220 r/min振荡培养至OD600为2左右,10 000 g,4℃离心收集菌体悬浮于GTE Buffer [2.5 mmol/L Glucose, 25 mmmol/L Tris–Cl 10 mmmol/L EDTA (pH 8)]中,加入lysozyme至终浓度为10 mg/mL,37℃水浴1 h。然后加入2倍体积的溶菌酶(Lysozyme) (1.0% SDS; 0.8 mol/L NaOH),轻轻上下倒置6~8次,然后加入1/2体积冰冷的3 mmol/L sodium acetate (pH 4.8)溶液,立刻轻轻上下倒置6~8次,冰上放置4 h以上,然后4℃,12 000 g离心10 min,上清经过phenol-chloroform-isoamyl alcohol (25:24:1)抽提,冰冷的96%乙醇沉淀获得Bt菌株的质粒DNA。
CHEF Mapper® XA Pulsed Field Electrophoresis System (BioRad, USA)应用于Bt质粒谱进行分析,具体操作按照产品说明书要求进行。电泳参数根据分离15 Kb到500 Kb质粒大小自动设置为:电泳槽温度控制为15℃,电压为5 V/cm,转换角度为120度,起始脉冲时间1.19 s,终止脉冲时间44.69 s,电泳时间为20 h。低熔点琼脂糖的浓度为1% (Amresco, USA),电泳缓冲液为0.5×TBE (45 mmmol/L Tris•Cl, 1 mmmol/L EDTA),电泳完成后琼脂糖胶块用0.5 μg/mL EB 浸泡30 min,再用冰冷的纯水清浸泡2 h,期间换水3次,最后在紫外光成像仪观察。
3.6 Bt菌株蛋白SDS-PAGE
将Bt菌株接种于5 mL液体LB培养基试管中30℃,200 r/min活化过夜,按1%比例转接到200 mL的BP培养基中,30℃,200 r/min培养,每隔2 h取1 000 L菌液至Eppendorf Tube中,12 000 g离心去上清,加入100 L灭菌水,充分悬浮菌体,加入0.5 mmol/L NaOH 25 L,室温放置10 min,加入63 L 3×loading sample buffer (Tris 3.63 g, 溴酚蓝0.3 g, SDS 6 g, 甘油30 mL, b-巯基乙醇15 mL, 调pH 6.8定容至100 mL),100℃煮沸5 min,12 000 g离心5 min,取上清备用。7.5%的SDS-PAGE胶电泳,具体程序参照Laemmli (1970)方法。
3.7 PCR-RFLP鉴定菌株Bt W015-1的cry基因型
PCR模板制备参照Yu等(2006)的方法,共有34对引物鉴定类cry基因(谢柳等, 2009),其中K5un2/ K3un2和K5un3/K3un3用于鉴定cry1基因(表2) (Kuo and Chak, 1996)。PCR反应体系,包括2 μL质粒DNA模板(50~100 ng),上下游引物分别1 μL,加入1 μL Dntp (dATP, dCTP, dTTP, dGTP混合物)至浓度250 μmmol/L,5 μL的10×PCR Buffer (promega, USA),0.5 U Taq酶(4 U/μL) (promega, USA),补40.5 μL双蒸水至50 μL总反应体积。扩增反应按如下程序进入循环:94℃预变性5 min。然后进入30个循环反应, 每个循环为:94℃变性1 min;53℃退火1 min;72℃延伸3 min。最后在72℃延伸10 min。扩增反应结束后,取PCR 产物5 μL,在1%琼脂糖凝胶上电泳检测扩增产物,PCR扩增产物由TIANgen Midi Purification Kit (Tiangen, Beijing, China)进行纯化。PCR-RFLP方法按照Kuo and Chak (1996)的方法进行,表3所示为cry1Ac1基因的PCR片段进行酶切分析的典型带谱,通过酶切片段的多态性来反映基因序列的差异。限制内切酶消化的扩增产物,在2%的琼脂糖胶分析酶切的带型。
| 表2基因鉴定、克隆和表达的引物序列 |
| 表3 Cry1Ac1的PCR-RFLP带谱模式 |
3.8 cry基因的克隆
将引物K5un2/K3un2和K5un2/K3un2的扩增产物连接到克隆载体pMD18T Easy Vector,构建成重组质粒pMDK2 和pMDK3,利用DNA自动测序仪(ABI-3730XL)测定序列(华大, 北京),根据测定的两段PCR序列,设计反向PCR扩增引物cry1I5/cry1I3。取1.0~2.0 μg质粒DNA,分别用NedI、SalⅠ、BglⅡ和BamHⅠ37℃水浴3 h完全消化质粒DNA,然后65℃水浴15 min使限制性内切酶失活。然后分别加入T4 连接酶于4℃反应过夜。连接产物直接作为PCR模板进行扩增。扩增产物与pMD18T载体连接,获得重组质粒pMDIS,序列测定后与质粒pMDK2 和pMDK3的序列进行拼接组装,获得完整的基因序列(Triglia et al., 1988)。
3.9 Cry1Ac22蛋白表达及活性测定
设计表达引物E1A5/E1A3以扩增cry1Ac22基因完整的编码序列,正向和反向引物5端分别引入BamHⅠ和SalⅠ酶切位点,亚克隆到表达载体pQE30形成重组质粒pQE30-cry1Ac22。转入表达宿主E. coli M15细胞中,在TB液体培养基(Kan 12.5 µg/mL)中,37℃培养至OD600nm 为0.5 (约1.5 h),加入IPTG至终浓度1 µmol/L,30℃继续培养4~10 h诱导表cry1Ac22基因。4℃,12 000 r/min离心10 min收集菌体和诱导表达蛋白,充分悬浮于等体积的TE溶液,加入溶菌酶至终浓度为20 mg/mL,37℃,220 r/min振荡培养30 min,然离心收集菌体和蛋白,用等体积冰冷的1 mol/L的NaCl洗涤3次,然后超声波破碎细胞破处理20 min (model VC-130, Sonics and Materials Inc., USA)。SDS-PAGE电泳用来分析蛋白表达情况,BSA蛋白作为标准浓度,Lowry等(1951)方法用来测定表达蛋白的浓度。表达的蛋白溶于50 mmol/L的Na2CO3 (pH 10.0)中溶液中,然后加入胰蛋白酶(Typsin)至浓度为1 mmol/L,37℃水浴1 h,然后稀释成8个浓度,加入0.02% Triton X-100,将切割好的直径为8 cm中国白菜叶片,浸入各个浓度的蛋白样品中约10 s,然后取出自然风干,放入直径为10 cm的塑料平皿中,为了防止叶片干燥枯萎,平皿底下平铺一张湿润的滤纸。每个塑料平皿用毛笔移入二龄幼虫10头(Sayyed et al., 2001)。每个处理设置6个重复,无菌水作为对照。放置25℃光照培养箱中,光照周期为14 h光照:10 h黑暗,相对湿度为65%的条件培养,96 h后观察幼虫死亡率。 利用SPSS软件进行概率回归分析,获得LC50值和95%置信区间值。
作者贡献
谢柳、张文飞及刘卓明是本研究的实验研究执行人;蔡玉根参与了滞育僵死家蚕的收集鉴定工作;谢柳和张文飞完成试验结果分析和初稿写作,李有志参与了研究生管理、实验的指导和论文修改;方宣钧是项目的负责人,指导实验设计,数据分析,论文修改和写作。全体作者都阅读并同意最终的文本。
致谢
作者十分感谢浙江省嘉兴市农业局赵如英女士组织落实滞育僵死家蚕的收集鉴定工作;感谢两位匿名的同行评审人的评审建议和修改建议。本研究受本研究受中国Bt收集与鉴定项目以及国家863计划(项目编号: 2004AA2111112)的资助。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Aronson J.N., and Thompson F.M., 1971, Bacillus thuringiensis sporulation at suboptimal temperature, J. Bacteriol., 105: 445-448 PMid:4322350 PMCid:248373
Carlson C.R., Johansen T., and Kolsto A.B., 1996, The chromosome map of Bacillus thuringiensis subsp. canadensis HD224 is highly similar to that of the Bacillus cereus type strain ATCC 14579, FEMS Microbiol . Lett., 141: 163-167 doi:10.1111/j.1574-6968.1996.tb08379.x PMid:8768518
Crickmore N., Zeigler D.R., Feitelson J., Schnepf E., Van Rie J., Lereclus D., Baum J., and Dean D.H., 1998, Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins, Microbiol. Mol. Biol. Rev., 62: 807-813 PMid:9729610 PMCid:98935
Khajuria C., Zhu Y.C., Chen M.S., Buschman L.L., Higgins R.A., Yao J.X., Crespo A.L.B., Siegfried B.D., Muthukrishnan S., and Zhu K.Y., 2009, Expressed sequence tags from larval gut of the European corn borer (Ostrinia nubilalis): Exploring candidate genes potentially involved in Bacillus thuringiensis toxicity and resistance, BMC Genomics, 10: 286 doi:10.1186/1471-2164-10-286 PMid:19558725 PMCid:2717985
Knowles B.H., 1994, Mechanism of action of Bacillus thuringiensis insecticidal d-endotoxins, Advances in Insect Physiology, 24: 275-308 doi:10.1016/S0065-2806(08)60085-5
Kuo W.S., and Chak K.F., 1996, Identification of novel cry type genes from Bacillus thuringiensis strains on the basis of restriction fragment length polymorphism of the PCR amplified DNA, Applied and Environmental Microbiology, 62: 1369-1377 PMid:8919799 PMCid:167904
Kristensen N.P., Scoble M.J., and Karsholt O., 2007, Lepidoptera phylogeny and systematics: The state of inventorying moth andbutterfly diversity, Zootaxa, 1668: 699-747
Laemmli U.K., 1970, Cleavage of structural proteins during the assembly of the head of bacteriophage T4, Nature, 227: 680-685 doi:10.1038/227680a0 PMid:5432063
Lecadet M.M., Blondel M.O., and Ribier J., 1980, Generalized transduction in Bacillus thuringiensis var. berliner 1715 using bacteriophage CP-54Ber, J. Gen. Microbiol., 121: 203-212 PMid:7252480
Lowry O.H., Rosebrough N.J., Farr A.L., and Randall R.J., 1951, Protein measurement with the folin phenol reagent, J. Biol. Chem., 193: 265-275 PMid:14907713
Mita1 K., Kasahara M., Sasaki S., Nagayasu Y., Yamada T., Kanamori H., Namiki N., Kitagawa M., Yamashita H., Yasukochi Y., Kadono-Okuda K., Yamamoto K., Ajimura M., Ravikumar G., Shimomura M., Nagamura Y., Shin-i T., Abe H., Shimada T., Morishita S., and Sasaki T., 2004, The genome sequence of silkworm, Bombyx mori, DNA Res., 11(1): 27-35
Ohba M., 1996, Bacillus thuringiensis populations naturally occurring on mulberry leaves: A possible source of the populations associated with silkworm-rearing insectaries, Journal of Applied Microbiology, 80(1): 56-64 doi:10.1111/j.1365-2672.1996.tb03190.x
Porcar M., Iriarte J., Cosmao Dumanoir V., Ferrandis M.D., Lecadet M., Ferre J., Caballero P., 1999, Identification and characterization of the new Bacillus thuringiensis serovars pirenaica (serotype H57) and iberica (serotype H59), J. Appl. Microbiol., 87: 640-648 doi:10.1046/j.1365-2672.1999.00863.x PMid:10594703
Sayyed A.H., Crickmore N., and Wright D.J., 2001, Cyt1Aa from Bacillus thuringiensis subsp. israelensis is toxic to the diamondback moth, Plutella xylostella, and synergizes the activity of Cry1Ac towards a resistant strain, Appl. Environ. Microbiol., 67: 5859-5861 doi:10.1128/AEM.67.12.5859-5861.2001 PMid:11722947 PMCid:93384
Triglia T., Peterson M.G., and Kemp D.J., 1988, A procedure for in vitro amplification of DNA segments that lie outside the boundaries of known sequences, Nucleic Acids Res., 16: 8186 doi:10.1093/nar/16.16.8186 PMid:3047679 PMCid:338531
Vilas-Boas G.T., Lemos M.V., 2004, Diversity of cry genes and genetic characterization of Bacillus thuringiensis isolated from Brazil, Can. J. Microbiol., 50: 605-613 doi:10.1139/w04-052 PMid:15467786
Xie L., Zhang W.F., Quan J.X., Liu Z.M., Ye D.W., Li Y.Z., and Fang X.J., 2009, Bacillus thuringiensis collection and isolates identification from Damingshan and Dawangling natural reserves in Guangxi province, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(1): 62-68 (谢柳, 张文飞, 全嘉新, 刘卓明, 叶大维, 李有志, 方宣钧, 2009, 广西大王岭和大明山自然保护区苏云金芽孢杆菌收集与鉴定, 基因组学与应用生物学, 28(1): 62-68)
Yu H., Zhang J., Huang D., Gao J., and Song F., 2006, Characterization of Bacillus thuringiensis strain Bt185 toxic to the Asian cockchafer: Holotrichia parallela, Plasmid, 53: 13-17
Zhang W.F., Quan J.X., Xie L., Wang X., Yi Y.T., Feng M.M., Zhu L., Wang R.P., and Fang X.J., 2009, Collection of Bacillus and identification of Bacillus thuringiensis isolates from tropical rain forest reserves of Hainan island, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(2): 265-274 (张文飞, 全嘉新, 谢柳, 王茜, 易艳桃, 丰玫玫, 朱麟, 王锐萍, 方宣钧, 2009, 海南岛热带雨林区芽孢杆菌收集及Bt 菌鉴定, 基因组学与应用生物学, 28(2):265-274)