2. 福建省烟草专卖局烟草农业科学研究所, 福州, 350003
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 12 篇 doi: 10.5376/gab.cn.2011.30.0012
收稿日期: 2011年02月22日 接受日期: 2011年03月18日 发表日期: 2011年04月07日
引用格式(中文):
陈华等, 2011,优质烤烟翠碧一号果全长cDNA文库的构建及质量分析,基因组学与应用生物学(online), Vol.30 No.12 pp.1073-1080 (doi: 10.5376/gab.cn.2011.30.0012)
引用格式(英文):
Chen et al., 2011, Construction of full-length cDNA library from the fruit of a quality tobacco germplasm and its quality determination, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.12 pp.1073-1080 (doi: 10.5376/gab.cn.2011.30.0012)
烟草果的基因表达直接关系到烟草的生长发育及烤烟品质。为了研究烟草果实基因的表达,并为烟草果实发育的重要功能基因的克隆与功能研究打下基础,本研究以烟草翠碧1号果为材料,采用SMART (switching mechanism at 5’ end of RNA transcript)技术构建了果全长cDNA文库。结果表明初级文库库容为3.01×106个独立克隆,重组率大于99%,插入片段平均长度约为1.3 kb。随机挑取25个克隆进行测序,Blastx比对结果显示:仅有7条序列跟烟草相似性最高,18条序列在烟草上尚未报道。由此可见所构建的文库包含大量烟草果的新基因,为烟草果新基因的发掘及烟草分子育种奠定了良好的基础。
随着分子生物学技术的发展和人类基因组计划的实施,一系列寻找新基因的方法也应运而生,而在众多方法中,能得到完整的基因序列,比较可行和可靠的主要还是cDNA文库的构建和筛选。cDNA文库已经成为发现新基因和研究基因功能的基础工具(王德龙等, 2009; 袁红雨等, 2005),具有迅速、简便、高效、不含内含子等特点。截止到目前,多种植物都有cDNA文库报道,如茶树(李冬花等, 2009)、人参(王昆等, 2006)和石蒜(王春燕等, 2009)等。
目前,全长cDNA文库的构建已成为进行功能基因组学研究的一种经济、快速、有效的途径,克服了传统cDNA文库的缺点(董志敏等, 2006b)。已经报道的全长cDNA文库构建方法很多,主要包括Oligo-Capping法、CAP-ture法、CAP-trappe法、SMART法等(毛新国等, 2006; 朱利军等, 2009)。SMART技术是一项利用较少mRNA甚至总RNA建立cDNA文库的方法(王家保等, 2009; Zhu et al, 2001)。其主要原理是PrimerScript RT反转录酶具有转移酶活性,能够长距离地反转录,当反转录到mRNA 5′帽子结构时,能在相应的核酸3′端补上一段oligo (dC)寡聚核苷酸序列,而对于非全长cDNA,因反转录没有延伸到mRNA 5′端而不能在其3′端加上oligo (dC). 用于合成cDNA第二链的引物只能结合3′端含oligo (dC)的全长cDNA,不能与短片段cDNA结合, 排除了不完整的cDNA片断。实验在引物5′端引入了基因组内极其稀有的Sfi I (A)、Sfi I (B)识别位点,使合成的全长cDNA两端含有Sfi I识别位点,经过Sfi I单酶切,可以实现目的基因的高效、定向克隆。现在,该技术在动植物方面已得到广泛应用,如烟草(高健等, 2004)、毛竹(Liu et al , 2008)、羊草(王丽娟等, 2009)和梅花鹿(郝丽等, 2009)等。
烟草是一种重要的经济作物,同时也作为一种了解植物生命活动的模式植物被广泛研究。为了进行烟草规模EST测序、新基因的发掘、表达和功能研究,建立烟草功能基因组学的基础平台,本研究利用SMART技术,成功构建了烟草果全长cDNA文库。经鉴定:文库库容大小、重组率及重组子插入片段大小等,均符合高质量文库要求,足以满足基因的筛选与克隆,这为烟草果实发育相关基因的克隆奠定了基础并为揭示烟草果发育的分子机制提供了可能。
1结果与分析
1.1总RNA的提取鉴定
采用CTAB法提取总RNA,经电泳分析果(图1),可清晰看见28S rRNA和18S rRNA两条带,还可隐约见到5S条带。28S rRNA亮度约为18S rRNA条带的两倍,紫外分光光度计显示,OD260/OD280为1.93。上述结果表明,所提取的RNA完整性和纯度都比较好,符合cDNA文库构建要求。
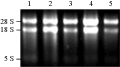 图1 总RNA电泳图 |
1.2双链cDNA合成结果
参照PrimerScript Reverse Transcriptase的说明书,总RNA逆转录得第一链cDNA,然后以抑制PCR方法合成双链cDNA (图2)。从图中可以看出双链大小呈弥散分布,较为完整。条带整体较高,说明经过抑制PCR合成的双链,可以有效抑制小片段的扩增。
 图2 双链cDNA合成结果 |
1.3文库质量鉴定
1.3.1文库库容量及滴度测定
1 μL原始文库菌液涂板后,计算克隆数为1 505个,而原始文库菌液总体积为2 mL,计算得初级文库库容为3.01×106。扩增文库按不同稀释梯度涂板,克隆数如下:104长1 020个克隆、105长135个克隆、106长12个克隆,所以扩增文库滴度cfu/mL=(1 020×104+135×105+12×106)÷3×1 000=1.19×1010 cfu/mL。
1.3.2文库重组率及插入片段鉴定
文库重组率和插入片段大小可以通过菌液PCR鉴定。随机挑取的20个单菌落摇菌后,用M13F和M13R引物PCR扩增,1%的琼脂糖凝胶电泳检测(图3)。如图3所示,20个重组子均有条带,重组率大于99%。片段大小集中在500~2 000 bp之间,平均长度约为1.3 kb。
| 图3 cDNA文库插入片段的PCR检测 |
另外从板上再随机挑取20个克隆,摇菌、提质粒,用限制性内切酶Sfi I酶切后,1%的琼脂糖凝胶电泳检测(图4)。如图4所示,插入片段大小主要集中在0.5~2.5 kb,菌液PCR检测文库插入片段也主要集中在0.5~2.5 kb,说明酶切验证与菌液PCR结果基本一致,进一步验证了文库的质量。
| 图4 质粒酶切电泳图 |
1.4测序结果初步分析
25条测序序列BlastN比对结果见表1,其中与烟草相似性最高的序列有7条,占28%;在剩余的18条序列中,与烟草同属于茄目类的植物比例最高,占60%,分别为番茄(Solanum lycopersicum和Lycopersicon esculentum)13条、辣椒(Capsicum annuum)1条和牵牛花(Petunia)1条。另外,还包括芝麻(Sesamum indicum)、葡萄(Vitis vinifera)等其它科属植物。由测序结果可以初步判断,大部分序列在烟草上尚未报道,这为我们下一步从文库中发掘新基因提供了可能。
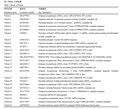 表1 Blastn比对结果 |
2讨论
烟草虽是以叶片为主要收获目标的植物,但是果的基因表达与烟草的生长发育及烤烟品质密切相关。为了研究烟草果实基因的表达,并为烟草果实发育的重要功能基因的克隆与功能研究打下基础,本研究利用SMART技术成功构建了烟草品种翠碧1号果全长cDNA文库。经鉴定该文库信息量丰富,并包含了大量未知功能的新基因。所构建文库的代表性和重组片段的序列完整性达到了用于目的基因的分离筛选和克隆表达的建库要求。
分离得到高质量的RNA,是成功构建一个全长cDNA文库的关键问题和必要前提。通过不同材料RNA提取方法的比较和改良,现已在很多含多酚、多糖和醌等果实材料上成功提取到高质量RNA (Tao et al., 2004; 朱晓琴等, 2008;Mehar et al., 2000; 周波等, 2004)。本研究采用本实验室改良的CTAB法,提取的RNA样品用微量紫外分光光度计测A260/A280=1.93,表明所提RNA纯度高,基本上没有多糖和蛋白等杂质。28S rRNA和18S rRNA两条带清晰且亮度约为两倍,没有基因组DNA污染。但是,CTAB法提取RNA操作繁琐,对操作的要求较高,需要的时间较长,不适合大批量RNA的提取。
SMART技术是近年来运用较广泛的文库构建技术。基于该方法所需的起始RNA量少,对获取大量RNA比较困难的材料,该方法具有独特的优势。另外,文库重组率高是SMART技术另一优点。该技术用的载体是Sfi I (A)和Sfi I (B)双酶消化,两端产生不对称粘性末端,自连的可能性非常小,保证了文库重组率。本研究所构建的文库,随机挑取的20个克隆,经PCR验证均有条带,说明文库的重组率很高。cDNA文库的质量具体反映在两个方面: 一是文库的代表性,可用一个量化的指标来衡量,即文库的库容量(Ruth et al., 2004)。为满足筛到低丰度mRNA 的要求,一般cDNA文库构建要求其库容不小于1×106 cfu/mL。本研究构建的cDNA文库库容为3.01×106,完全达到了这个要求。二是重组cDNA片段的大小。本研究所构建的文库重组子,经菌液PCR和酶切验证,插入片段集中在750~2 500 bp之间,平均长度约为1.3 kb,保证了高比例全长cDNA的获得。目前,利用该技术许多作物如花生(蔡宁波等, 2007; 禹山林等, 2010)、小麦(秘彩莉等, 2006)、大豆(王敏等, 2005; 董志敏等, 2006a)和油菜(董海滨和管荣展, 2005)等均有以某一特定器官、特定时期或特定处理条件下的全长cDNA文库构建,文库的重组率都在90%以上,插入片段大小集中在500~2 000 bp之间,初级文库的库容量都大于1×106 cfu/ml。由此可见,SMART技术构建的全长cDNA文库的质量较高,足以满足基因的筛选与克隆。
烟草是一种模式生物,截止到2011年2月20日网上释放412 170条EST(http://www.ncbi.nlm.nih.gov/nucest/?term=TOBACCO),而释放的Unigene仅为24 434条(http://www.ncbi.nlm.nih.gov/unigene/?term=TOBACCO)。可见,烟草还有大量新基因有待挖掘。高质量cDNA文库的构建有利于规模EST测序、新基因的发掘、表达和功能研究,建立功能基因组学的基础平台。本研究所构建的烟草果全长cDNA文库中,随机挑取的25个克隆经测序初步分析,仅有7条序列在烟草上已经报道,可以推测本研究所构建的文库新基因的数量应该是可观的,进一步弥补了网上烟草基因资源的不足,这为烟草果发育相关功能基因的克隆与功能研究及烟草分子育种奠定了基础。
3材料与方法
3.1实验材料
所用烟草材料为福建烤烟品种翠碧一号,取果实形成时期不同成熟阶段果,迅速置于液氮中冷冻,于-80℃冰箱保存,用于RNA提取。
胶回收试剂盒和质粒提取试剂盒购于博日科技有限公司,PrimerScript逆转录酶,RNase Inhibitor ,Sfi I, Ex-Taq,dNTP (10 mmol/L与2.5mmol/L)、DL2000分子标准和DL15000分子标准均购自大连宝生物公司(TAKARA),连接酶购于NEB,电击转化感受态细胞由本实验室制备,其它试剂采用国产分析纯。实验所用到的引物均按CreatorTM SMARTTM cDNA Library Construction Kit (Clontech公司)由上海生工生物技术服务有限公司合成,名称及序列如下:SMART IV Oligonucleotide:5'-AAGCAGTGGTATCAACGCAGAGTGGCCATTACGGCCGGG-3';3' PCR Primer : 5'-AAGCAGTGGTATCAACGCAGAGTGGCCGAGGCGGCCGA-d(T)30VN-3' (N=A, G, C or T; V=A, G or C);5' PCR Primer:5'-AAGCAGTGGTATCAACGCAGAGT-3';M13 Forward Primer:5’-GTAAAACGACGGCCAG-3’;M13 Reverse Primer:5’-CAGGAAACAGCTATGAC-3’。
3.2总RNA提取
CTAB法适合于烟草各组织RNA的提取,已经得到了证实(鲁黎明等, 2006; 丁福章等, 2007)。本研究采用本实验室改良的CTAB法提取总RNA:取烟草不同生长时期果混合为材料,加液氮充分研磨呈粉末状,迅速转移到5 mL离心管中,加入2.4 mL CTAB提取缓冲液和48 μL β-巯基乙醇(终浓度达到2%),迅速振荡混匀,涡旋3 min,65℃水浴约15~20 min,吸取上清液经过两次等量氯仿/异戊醇(24:1)抽提,去除蛋白后,加入1/3体积浓度为10 mmol/L的LiCl溶液沉淀2次,用75%乙醇洗涤2次,干燥后加入适量的去离子甲酰胺,于-80℃保存。得总RNA后,使用ND-2000C微量紫外分光光度计(NanoDrop ND-2000C)检测总RNA浓度、纯度,1%琼脂糖凝胶电泳检测其完整性。
3.3第一链cDNA的合成
按照宝生物工程(大连)有限公司PrimerScript Reverse Transcriptase的说明书,在10 μL反应体系中加入3μg total RNA、1μL SMART IV Oligonucleotide 、1 μL 3'PCR Primer、1 μL dNTP Mixture (10 mmol/L),用RNase free H2O补足到10 μL。混匀,短暂离心,65℃,5 min;冰上冷却2 min,短暂离心;向反应液中加入5×PrimerScrip Buffer 4 μL、RNase Inhibitor (40 U/μL) 0.5 μL,PrimerScript Reverse Transcriptase (200 U/μL) 1μL, RNase free H2O补足到20 μL,于42℃孵育60 min,70℃保温15 min后,置于冰浴中终止反应,第一链合成完成。
3.4第二链cDNA的合成
反应体系为50 μL:于干净预冷0.2 mL反应管中加入去离子水36.5 μL,第一链产物2 μL,5'PCR引物2 μL,10×Ex Taq Buffer 5 μL,2.5 mmol/L dNTP Mixture 4 μL,Ex Taq酶0.5 μL。PCR程序:95℃预变性1 min;95℃变性15 s,64℃退火30 s,72℃延伸5 min,扩增20个循环结束,取2 μL PCR产物经1%琼脂糖凝胶电泳检测。
3.5 cDNA的蛋白酶K消化和Sfi I酶切
取100 μL cDNA,加入4 μL蛋白酶K,45℃反应20 min,经过抽提去除蛋白后,加入1/10体积的3 mol/L (pH5.2)的醋酸钠、2倍体积的95%酒精和1.3 μL糖原将cDNA沉淀出来,溶于79 μL去离子水中。加入10 μL Sfi I、10 μL 10×Sfi I Buffer、1 μL 100×BSA,于50℃中酶切反应2 h。
3.6胶回收纯化和连接反应
将上述酶切产物经1.5%琼脂糖凝胶电泳,切割回收0.75~5 kb之间的片段,用Biospin Gel Extraction Kit回收,最后溶于7 μL去离子水中,测其浓度。根据浓度取cDNA约200 ng与100 ng经过去磷酸化处理的pDNR-LIB载体连接。
3.7电转化
将连接产物加入到大肠杆菌DH5α感受态细胞中,在1 500 V电压下快速电击,每管立即加入950 μL液体LB培养基,37℃培养1 h,获得原始文库菌液。
3.8 cDNA文库质量鉴定
3.8.1文库库容量及滴度测定
取1 μL原始文库菌液,涂布至含有30 mg/L氯霉素的LB培养板上(规格85 mm×13 mm),37℃过夜培养计算克隆数,得到初级文库库容。将剩余菌液涂布至含有30 mg/L氯霉素的LB培养板上(规格140 mm×15 mm),37℃过夜培养,然后用液体LB培养基洗脱培养板收集菌液即为扩增文库。分别取1 μL扩增文库菌液,稀释104、105和106倍后分别涂布至含有30 mg/L氯霉素的LB培养板上(规格85 mm×13 mm),37℃过夜培养,计算克隆数,得到扩增文库滴度。
3.8.2文库重组率及插入片段鉴定
随机挑取20个克隆,分别以单克隆摇菌过夜后的菌液为模板,以M13F和M13R为引物,进行菌液PCR鉴定。PCR程序:95℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,35个循环;72℃ 延伸10 min。然后用1%的琼脂糖凝胶电泳检测,判断文库重组率和重组子插入片段大小。再随机选取20个克隆,用限制性内切酶Sfi I进行质粒酶切,进一步验证文库的质量。
3.9文库初步测序及BlastN比对
随机挑取25个单克隆送往上海国家人类基因组南方研究中心进行测序,测序结果拼接成完整序列后进行BlastN比对。
致谢
感谢国家烟草局、福建省科技厅福建省烟草公司对本研究的资助。感谢两位匿名的同行评审人的评审建议和修改建议。
作者贡献
陈华,完成实验设计和实验研究,完成数据分析、论文的写作与修改;曾建斌,参与实验设计、实验研究与试验结果分析;陈顺辉,参与实验研究;贺小彦,参与实验研究;张冲,参与实验研究;姜宝杰,参与实验研究;庄伟建,项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改,是本文的责任作者(通信作者)。全体作者都阅读并同意最终的文本。
参考文献
Bei C.L., Guo G.Y., Qi Z.G., and Shen Y.Z., 2006, Construction and detection of a cDNA library of wheat seedling salt stressed for 72 hours, Hebei Shifan Daxue Xuebao (Ziran Kecueban) (Journal of Hebei Normal University (Natural Science Edition)), 30(5): 585-588 (秘彩莉, 郭光艳, 齐志广, 沈银柱, 2006, 小麦苗期盐胁迫72 h cDNA文库的构建及质量检测, 河北师范大学学报(自然科学版), 30(5): 585-588)
Cai N.B., Huang X.W., and Zhuang W.J., 2007, Construction and identification of a full-length cDNA library from peanut seeds, Huasheng Xuebao (Journal of Peanut Science), 36(2): 1-5 (蔡宁波, 黄湘文, 庄伟建, 2007, 花生种子全长cDNA文库的构建和鉴定, 花生学报, 36(2): 1-5)
Ding F.Z., Li J.X., Yuan Y.B., and Lei B., 2007, Effective isolation of total RNA from tobacco tissues, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bullentin), 23(12): 98-101 (丁福章, 李继新, 袁有波, 雷波, 2007, 烟草不同组织总RNA的提取方法初探, 中国农学通报, 23(12): 98-101)
Dong H.B., and Guan R.Z., 2005, Construction of seedling cDNA library of canola variety Huashuang 3 in Brassica napus, Nanjing Nongye Daxue Xuebao (Journal of Nanjing Agricultural University), 28(3): 123-125 (董海滨, 管荣展, 2005, 双低油菜华双3号幼苗全长cDNA文库的构建, 南京农业大学学报, 28(3): 123-125)
Dong Z.M., Li Y.H., Zhang B.S., Guan R.X., Chang R.Z., and Qiu L.J., 2006a, Construction and identification of soybean (Glycine max) leaf, Zuowu Zazhi (Crops), (5): 1-4 (董志敏, 李英慧, 张宝石, 关荣霞, 常汝镇, 邱丽娟, 2006, 大豆叶片全长cDNA文库的构建与鉴定, 作物杂志, (5): 1-4)
Dong Z.M., Zhang B.S., Guan R.X., Chang R.Z., and Qiu L.J., 2006b, The methods of constructing the full-length cDNA Library, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 22(2): 51-55 (董志敏, 张宝石, 关荣霞, 常汝镇, 邱丽娟, 2006, 全长cDNA文库的构建方法, 中国农学通报, 22(2): 51-55)
Gao J., Xu X.F., Wu H.L., Chen X.P., and Zhou J.H., 2004, Construction of full-length cDNA library from a native tobacco germplasm and its quality analysis, Anhui Nongye Dacxue Xuebao (Journal of Anhui Agricultural University), 31(1): 22-25 (高健, 许晓风, 乌慧玲, 陈学平, 周家昊, 2004, 特异种质烟草全长cDNA文库的构建及质量分析, 安徽农业大学学报, 31(1): 22-25)
Hao L., Li H.P., and Yan L., 2009, Construction of full-length cDNA library for antler tip tissue of Sika Deer, Dongbei Linye Daxue Xuebao (Journal of Northeast Forestry University), 37(11): 120-122 (郝丽, 李和平, 严厉, 2009, 东北梅花鹿鹿茸尖端组织全长cDNA文库的构建, 东北林业大学学报, 37(11): 120-122)
Li D.H., Yao L.J., Yu Y.B., Jiang C.J., Zhou T.S., and Wu L., 2009, Construction of cDNA library of Camellia sinensis cv. Ziyang 1 and primary analysis of expressed sequence tags (ESTs), Journal of Anhui Agricultural University, 36(3): 347-350 (李冬花, 姚丽娟, 余有本, 江昌俊, 周天山, 伍丽, 2009, 特异茶树种质紫阳1号cDNA文库构建及ESTs初步分析, 安徽农业大学学报, 36(3): 347-350)
Liu N.T., Wu F.H., Tsay H.S., Chang W.C., and Lin C.S., 2008, Establishment of a cDNA library from Bambusa edulis Murno in vitro-grown shoots, Plant Cell, Tissue and Organ Culture, 95(1): 21-27 doi:10.1007/s11240-008-9409-6
Lu L.M., Wang L.Z. and Yang T.Z., 2006, Study on an efficient method for tobacco RNA extraction, Molecular Plant Breeding, (S2): 157-160 (鲁黎明, 王林忠, 杨铁钊, 2006, 烟草总RNA高效提取方法研究, 分子植物育种, (S2): 157-160)
Mao X.G., Jing R.L., Kong X.Y., Zhao G.Y., and Jia J.Z., 2006, Comparison of methods to construct a full-length cDNA library, Yichuan (Hereditas), 28(7): 865-873 (毛新国, 景蕊莲, 孔秀英, 赵光耀, 贾继增, 2006, 几种全长cDNA文库构建方法比较, 遗传, 28(7): 865-873)
Mehar H.A., Puneet D., and Pravendra N., 2000, A simple procedure for the isolation of high quality RNA from ripening banana fruit, Plant Mol. Biol. Rep., 18(2): 109-115
Tao N.G., Cheng Y.J., Xu J., Xu Q., and Deng X.X., 2004, An effective protocol for the isolation of RNA from the pulp of ripening citrus fruits, Plant Mol. Biol. Rep., 22(3): 305a-305f
Ruth W., Ingo S., Annemarie P., and Stefan W., the German cDNA Consortium, 2004, SMART amplification combined with cDNA size fractionation in order to obtain large full-length clone, BMC Genomics, 5(1): 36
Wang C.Y., Xia B., Li X.D., Jiang Y.M., Mu H.Y., Peng F., and Wang R., 2009, Construction of full-length cDNA library of Lycoris radiate leaves, Jiangsu Nongye Xuebao (Jiangsu Journal of Agricultural Sciences), 25(3): 542-546 (王春燕, 夏冰, 李晓丹, 江玉梅, 穆红梅, 彭峰, 汪仁, 2009, 石蒜叶片全长cDNA文库的构建, 江苏农业学报, 25 (3) : 542-546)
Wang D.L.,; Yu J.W., Yu S.X., Zhai H.H., Fan S.L., Song M.Z., and Zhang J.F., 2009, The construction of cDNA library from cotton seed, Mianhua Kexue (Cotton Science), 21(5): 351-355 (王德龙, 于霁雯, 喻树迅, 翟红红, 范术丽, 2009, 油脂形成期棉花种子全长cDNA文库的构建, 棉花学报, 21(5) :351-355)
Wang J.B., Xu B.Y., Jin Z.Q., and Feng C., 2009, Constructing cDNA library of litchi pericarp using SMART technology, Redai Zuowu Xuebao (Chinese Journal of Tropical Crops), 30(8): 1109-1112 (王家保, 徐碧玉, 金志强, 冯超, 2009, 利用SMART技术构建荔枝果皮cDNA文库, 热带作物学报, 30(8): 1109-1112)
Wang M., Liu P., Shi M.W., and Wang Q.L., 2005, Construction and characterization of cDNA library from seeds of wild soybean (Glycine soja), Shengwu Jishu Tongxun (Letters in Biotechnology), 16(5): 509-511 (王敏, 刘萍, 石明旺, 王清连, 2005, 野生大豆种子cDNA文库的构建与分析, 生物技术通讯, 16 (5): 509-511)
Wang K., Wang Y., Bao Y.L., Meng X.Y., Wu Y., Yi J.W., and Li Y.X., 2006, Construction and sequence analysis of a full-length cDNA library of panax ginseng leaf tissues, Fenzi Kexue Xuebao (Journal of Molecular Science), 22(1): 58-62 (王昆, 王颖, 鲍永利, 孟祥颖, 乌垠, 易静文, 李玉新, 2006, 人参叶全长cDNA文库的构建及部分克隆的序列分析, 分子科学学报, 22(1): 58-62)
Wang L.J., Jin Z.P., Wang N.F., Li X.F., and Liu G.S., 2009, Construction of a cDNA library of the leaf of Leymus chinensis and analysis of partial expressed sequence tags, Caoye Xuebao (Acta Prataculturae Sinica), 18(1): 65-71 (王丽娟, 金治平, 王能飞, 李晓峰, 刘公社, 2009, 羊草叶片cDNA文库的构建及部分表达序列标签的分析,草业学报, 18(1): 65-71)
Yu S.L., Chi X.Y., Yang Q.L., Pan L.J., He Y.N., Chen M.N., and Yang Z., 2010, Construction of a full-length cDNA library from peanut seedlings, Huasheng Xuebao (Journal of Peanut Science), 39(2): 11-15 (禹山林, 迟晓元, 杨庆利, 潘丽娟, 和亚男, 陈明娜, 杨珍, 2010, 花生幼苗全长cDNA文库的构建, 花生学报, 39(2): 11-15)
Yuan H.Y., Zhu L.L., and He G.C., 2005, Construction and screening of a cDNA library from rice seedlings exposed to brown planthopper, Xinyang Shifan Xueyuan Xuebao (Ziran Kexueban) (Journal of Xinyang Normal University (Natural Science Edition)), 18(1): 48-51 (袁红雨, 祝莉莉, 何光存, 2005, 褐飞虱取食水稻幼苗cDNA文库的构建及筛选, 信阳师范学院学报(自然科学版), 18(1): 48-51)
Zhou B., Zhang Y., and Li Y.H., 2004, Improvement of extraction method of total RNA from strawberry fruit with abundant polymeric carbohydrates, Shengwu Jishu Tongxun (Letters in Biotechnology), 15(1): 48-50 (周波, 张旸, 李玉花, 2004, 富含多糖草莓果实总RNA提取方法的改进, 生物技术通讯, 15(1): 48-50)
Zhu L.J., Zhangsun D.T. and Luo S.L., 2009, Methodology of constructing the full Length cDNA library and its application, Hainan Daxue Xuebao (Ziran Kexueban) (Natural Science Journal of Hainan University), 27(2): 185-190 (朱利军, 长孙东亭, 罗素兰, 2009, 全长cDNA文库构建方法及应用研究, 海南大学学报(自然科学版), 27(2): 185-190)
Zhu X.Q., Jin X.L., Feng Y.Q. and Shen Y.Y., 2008, An effective method for isolation of high-quality total RNA from fruit pulps, Beijing Nongxueyuan Xuebao (Journal of Beijing University of Agriculture), 23(2): 16-18 (朱晓琴, 金晓磊, 冯永庆, 沈元月, 2008, 果树果实总RNA提取方法的改良研究, 北京农学院学报, 23(2): 16-18)
Zhu Y.Y., Machleder E.M., Chenchik A., Li R., and Siebert P.D., 2001, Reverse transcriptase template switching: A SMARTTM approach for full-Length cDNA library construction, BioTechniques., 30(4): 892-897