2. 深圳出入境检验检疫局, 深圳, 518045
3. 华南理工大学生物科学与工程学院, 广州, 510640
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 15 篇 doi: 10.5376/gab.cn.2011.30.0015
收稿日期: 2010年12月23日 接受日期: 2011年04月19日 发表日期: 2011年04月28日
引用格式(中文):
罗焕亮等, 2011,植原体膜蛋白及其研究进展,基因组学与应用生物学(online), Vol.30 No.15 pp.1092-1097 (doi: 10.5376/gab.cn.2011.30.0015)
引用格式(英文):
Luo et al., 2011, Advance and application prospect in membrane proteins of phytoplasma, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.15 pp.1092-1097 (doi: 10.5376/gab.cn.2011.30.0015)
植原体是一类危害严重的植物病害,由于其难以体外培养,因此其致病机制尚不完全清楚。由于其无细胞壁,细胞膜蛋白在其致病过程应该发挥了重要作用。本文对植原体膜蛋白的分类及结构进行了初步的总结,重点介绍了植原体的免疫膜蛋白和Sec膜蛋白种类、结构及研究进展,并进一步展望了上述膜蛋白在检测植原体的应用前景。
植原体(类菌原体) (phytoplasma, 原称mycopalsma-like organism, MLO)主要存在于植物韧皮部筛管细胞中,是一类类似植物病原细菌的原核生物,隶属于软壁菌门,柔膜菌纲,植原体属。主要通过韧皮部吸食式昆虫如叶蝉、飞虱、蝽蟓等传播(McCoy et al., 1989; 刘仲健等, 1999)。其侵染性强,危害寄主广泛,易造成严重的经济损失,是一类危害严重的植物病害,易造成植株丛枝、黄化、花变叶、花器退化等症状。至今,国内外已报道的植物植原体病害多达700 余种(刘仲健等, 1999)。由于植原体无细胞壁,难以人工培养,给分类鉴定、传播机制、致病机制带来许多困难。植原体无细胞壁只有细胞膜,推测其膜蛋白能够直接接触植物的细胞质或介体昆虫细胞,引起寄主和病原的相互作用,因此对植原体膜蛋白质种类、结构以及功能的的分析是今后研究焦点之一,目前国内外对该领域的研究尚处于起步阶段(Yu et al., 1998; Berg et al., 1999; Blomquist et al., 2001; Barbara et al., 2002; Morton et al., 2003;Kakizawa et al., 2004)。据此本文就植原体膜蛋白分类和研究进展做了综述并进一步展望了其应用前景。
1植原体的免疫膜蛋白及其分类
由于植原体无细胞壁,其细胞膜蛋白可能在植原体使寄主细胞致病过程中发挥了重要作用。组成大多数植原体总细胞膜蛋白的主要蛋白是免疫主导膜蛋白(immunodominant membrane proteins, IDPs) (Kakizawa et al., 2001; 2004)。植原体可能通过这些免疫膜蛋白直接接触寄主而致病。至今国内外研究者已经从以下10种植原体中得到了编码免疫主导膜蛋白的基因,主要包括:甘薯丛枝病植原体(sweet potato witches’ broom, SPWB, 录入号U15224) (Yu et al., 1998)、苹果丛生植原体(apple proliferation, AP, 录入号AJ011678) (Berg et al., 1999)、桃西方X植原体(western X-disease, WX, 录入号AF225904) (Blomquist et al., 2001)、翠菊黄化植原体(aster yellow, AY, 录入号AF244540)、三叶草绿变植原体(clover phyllody, CP, 录入号AF244541) (Barbara et al., 2002)、梨衰退病植原体(pear decline, PD, 录入号AF400588)、桃黄化卷叶病植原体(peach yellow leaf roll, PYLR, 录入号AF400589)、欧洲石果黄化病植原体(european stone fruit yellows, ESFY, 录入号AF40058)、(Morton et al., 2003)、泡桐丛枝病植原体(paulownia witches’ broom, PWB, 录入号AB124810)和洋葱黄化病植原体(onion yellow, OY, 录入号AB110271) (Kakizawa et al., 2004)。
研究结果表明这些植原体的膜蛋白之间在氨基酸序列以及抗原性方面存在着较大差异。因此,植原体的免疫主导膜蛋白被为三类:(1)第一类型被称为免疫膜蛋白(immunodominant membrane protein, Imp),代表性植原体有SPWB、AP、ESFY、PD和PYLR;(2)第二类型被称为免疫膜蛋白A (immunodominant membrane protein A, IdpA),代表性植原体是WX;(3)第三类型被称为免疫抗原膜蛋白(antigenic membrane protein, Amp),代表性植原体是AY和CP,各类免疫膜蛋白及其代表见图1 (Kakizawa et al., 2001)。
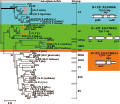 图1 3类免疫膜蛋白的进化关系(Kakizawa et al., 2004) |
这三种类型的免疫膜蛋白定氨基酸序列同源性较低,分别定位位于各基因组的不同位置,而且形成的跨膜结构也有较大不同。所有的IDPs都能形成一个或两个跨膜域亲水区域位于植原体细胞外部(图2)。第一种类型的Imp仅在N-末端形成跨膜域被锚定于细胞膜,第二种类型的IDPA形成两个跨膜区域,N-末端和C-末端各形成一个跨膜域,两端均被锚定且均未断裂。第三种类型的Amp与第二种类型IDPA相似,也形成两个跨膜域,但只有C-末端被锚定,而N-末端断裂(Barbara et al., 2002)。
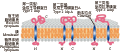 图2 3类膜蛋白的跨膜结构示意图 |
1.1免疫主导膜蛋白(Imp)
Berg等(1999)人从感染了AP的长春花和烟草植物中检测到了一种分子量大约为19 kD大小相似的蛋白,序列分析表明该类蛋白具有整合膜蛋白的典型特征,其N端具有较强的疏水性,形成α螺旋结构锚定在在膜中,亲水C端暴露在细胞膜外,属于IDPs中的第一类Imp,由于这种蛋白是通过疏水作用和其它作用力锚定连接的,因此不能在低离子浓度缓冲液中溶解而是需要合适的表面活性剂助溶(Kakizawa et al., 2001; Wieslander et al., 1992)。而早在1998年,Yu等(1998)人从感染了sweet potato witches’ broom (SPWB)的长春花植株中克隆得到了的一种由172个氨基酸编码的免疫膜蛋白,其分子量为19.15 kD,疏水性分析发现该蛋白N端也具有较强的疏水性且锚定于细胞膜内,而C端具有较强的亲水性暴露于细胞膜外。经分析从上述两种植原体得到的免疫膜蛋白在DNA序列和氨基酸序列具有有高度的同源性。而后,Morton等(2003)克隆得到了与AP植原体类群中另外3个亚组ESFY、PD和PYLR的免疫膜蛋白,蛋白结构分析发现,三种免疫膜蛋白能形成一个跨膜区域,疏水性较强的N末端锚定于膜内,亲水性较强的C末端暴露于膜外,且三种免疫膜蛋白的氨基酸序列与AP植原体膜蛋白的序列具有较高的同源性。
1.2免疫膜蛋白A (IdpA)
Blomquist等(2001)从感染了WX植原体的芹菜中分离到了分子量为32 kD的免疫膜蛋白,利用单克隆抗体进行免疫沉淀反应纯化了这种蛋白,经胰蛋白酶消化得到的2个肽段,分别进行氨基酸测序后,以测序结果为依据设计出的引物扩增出得到了分子量为145 bp的产物,以此产物为探针杂交获得该免疫膜蛋白完整阅读框,全长864 bp。对该IdpA序列的分析显示,该蛋白能形成两个跨膜区域,N末端和C末端均有较强的疏水性锚定于膜内,但两端无裂痕。研究表明从WX植原体中分离到的该免疫膜蛋白基因序列以及氨基酸序列同其它已知植原体免疫膜蛋白无同源性。
1.3抗原膜蛋白(Amp)
抗原膜蛋白Amp,作为免疫膜蛋白中的一类是由三个区域构成的:由分泌转运系统控制的N端信号引导区(amp-E)、暴露于寄主细胞质中的大的亲水区(amp-H)和包含一个短亲水区的C端跨膜区(amp-T) (Kakizawa et al., 2006)。
Barbara等(2002)对AY和CP的免疫主导膜蛋白的结构进行了研究,研究表明AY或CP的Amp序列不管是同AP、SPWB还是WX植原体的免疫膜蛋白序列之间都没有明显的序列同源性。这5种蛋白都有主要疏水区域,AP和SPWB的免疫膜蛋白的疏水面是相似的,在靠近N端有疏水跨膜区,蛋白的其余部分都具有亲水性,暴露于细胞膜外。CP、AY和WX的免疫膜蛋白的疏水面是彼此相似的但是不同于AP和SPWB的,在这三个免疫膜蛋白中有两个疏水区,一个靠近C端,另一个靠近N端,而中心区域则是高度亲水的。但从WX分离得到的IdpA两端无断裂处,N端和C端跨膜区都是锚定在细胞膜上的。而CP和AY的蛋白N端具有可分裂区,只有疏水的C端锚定于膜内,这一结构决定了锚定在膜上的C端的最终定向,细胞膜外的中央亲水区和N端信号序列在转运的过程中会脱去。因此猜测AY和CP植原体属于单个分枝中的两个子枝,Amps的部分区域(N端引导区、跨膜和短的C端区)在两种植原体中是高度一致的,然而主要的亲水区在大小方面很不同(AY是166个氨基酸,CP是99个氨基酸)。
目前对于三种抗原主导膜蛋白功能的研究还不清楚,三种蛋白均具有一定的抗原性,其中以Amp蛋白的抗原性为最佳。
2 Sec系统膜蛋白
研究表明,在进化过程中细菌保留了至少6种被称为转运酶或转运子的蛋白质转运机制。其中Sec转运酶备受关注,大多数的分泌蛋白和一些整合膜蛋白是通过该途径转运。Sec转运酶主要由亚基SecY、SecE、SecG和SecA组成,其中蛋白转运和细胞发育所必需的亚基包含SecA、SecY和SecE。在转运过程中,由SecY、SecE和SecG亚基组成异源三聚体SecYEG,该SecYEG三聚体在细胞上形成跨膜通道,分泌到胞外的蛋白由SecA亚基携带分子伴侣引导到达该通道,进一步利用ATP酶的活性被逐步推动输出至膜外(den Blaauwen et al., 1996; Economou, 1999)。
植原体难以体外培养,因此对植原体的蛋白分泌系统的研究较少。Kakizawa等(2001)对洋葱黄化植原体Sec蛋白基因进行了克隆和表达分析,发现该系统是由SecA、SecY和SecE组成,SecA和SecY蛋白是Sec转运系统必不可少的成分,这一研究表明Sec系统存在于这种植原体中,但其在植原体内的转运机制尚不清楚。岳红妮等(2009)从感染PaWB的植株中扩增得到了SecA、SecY和SecE基因,经预测分析,发现SecA蛋白为非内膜整合蛋白, 无明显跨膜区。SecY和SecE蛋白分别含有10个和3个明显的疏水跨膜区,与大肠杆菌中SecY和SecE蛋白结构相同。因此推测源于PaWB植原体中,SecE 蛋白的第3个跨膜区与SecY的P3 (位于间周质侧的第3个环)和TM7 (第7个跨膜区)相互作用,形成蛋白质跨膜通道。而SecA蛋白功能可能是引导前体蛋白分子进入跨膜通道,与大肠杆菌内膜外周蛋白ATP酶SecA作用相同。由于植原体缺乏细胞壁,其Sec蛋白转运系统能够直接转运毒素、黏附素或溶血素等菌体蛋白到寄主细胞质中,直接或间接地导致寄主植物或介体昆虫发生互作,引起寄主植物染病。
3植原体膜蛋白的应用
3.1免疫膜蛋白的应用
如前所述,由于植原体缺乏细胞壁,难以体外培养,而植原体膜蛋白直接接触寄主植物和昆虫细胞,推测其在寄主与植原体相互作用过程中起到了重要的作用,但具体机制仍需进一步研究。免疫分析方法是较为重要的研究手段。而该方法核心是制备植原体的抗体,国外已经利用多种免疫膜蛋白制备了植原体特异性抗体。Berg等(1999)将AP植原体的Imp基因在大肠杆菌中进行表达,并将表达的产物免疫动物得到了抗AP植原体的特异性抗体。Blomquist等(2001)利用WX植原体IdpA基因制备到了抵抗WX植原体的特异性抗体。相比前两种免疫膜蛋白,抗原膜蛋白(Amp)应用更广泛些,Arashida等(2008)人在大肠杆菌中表达了日本八仙花变叶病植原体(JHP)的抗原膜蛋白基因,得到了抗JHP-Amp的抗体。Kakizawa等(2001)将洋葱黄化Amp基因在大肠杆菌中进行表达,并用此基因表达产物制备了抗OY植原体的特异性抗体。但是Amp基因在大肠杆菌中的表达较难,2002年,Barbara等(2002)研究了植原体Amp对大肠杆菌细胞毒性的作用,当整个OY amp-E/H/T结构引入大肠杆菌中却得不到转化株,因此猜测全长OY Amp对大肠杆菌有一定的毒性。
3.2膜蛋白的应用
与Amp蛋白在制备抗植原体抗体的应用方面相比,Sec系统膜蛋白对植原体的作用更直接。通过分析Sec系统中SecA、SecY和SecE基因结构,预测SecA蛋白具有较好的抗原性。而且许多不同种细菌的SecA蛋白的氨基酸序列子都是高度保守的,因此SecA蛋白可以作为抗原制备抗多种植原体的抗体。Wei等(2004)从洋葱黄化植原体基因中分离提取并且克隆到SecA基因,将SecA在大肠杆菌中表达得到的蛋白免疫得到了抗体。经过免疫印迹和免疫组织化学分析,表明由抗OY植原体SecA得到的抗血清可以用来检测不同的植原体,且OY-SecA和公认的叶绿体SecA序列同源性较低,这种抗血清只会产生较低水平的植物或细胞器背景信号,因此在免疫组织化学分析中SecA抗体能够与植原体发生特异性反应而不与寄主细胞器作用。同时免疫组织化学分析也进一步证实了抗OY-SecA的抗体可以用来检测比较广泛的植原体,在这一点上SecA蛋白明显优于Amp蛋白。
4小结与展望
由于植原体在体外不能人工培养,长期以来主要依靠电镜检查、生物学、抗生素试验结合的传统方法进行检测。自80年代以来,出现了血清学检测和多种分子生物学检测方法如核酸杂交技术、PCR技术,其中血清学方法相对简单、易于操作,可以进行大量检测,成本低,因此在植原体的检测和鉴定上具有及其重要的地位。Lin等(1985)人在1985年成功获得翠菊黄化植原体的单抗之后,现已相继得到了多种植原体的单克隆抗体,目前已广泛用于鉴定和检测寄主植物以及媒介昆虫体内的植原体,并逐步用于鉴定传毒昆虫和病原之间的关系(Chen and Jiang, 1988; Hsu et al., 1990; Jiang et al., 1989; Lin et al., 1990; Schwartz et al., 1989; Lherminier et al., 1994; Guo et al., 1998)。虽然已经研究出了多种植原体膜蛋白的抗体,在前文中也列举了用多种免疫膜蛋白以及SecA膜蛋白制备抗植原体抗体的应用,其中洋葱黄化植原体的SecA膜蛋白是目前较好的一种用来制备抗体的蛋白,但还没有市售的用于检测植原体的抗体,原因是用传统的制备抗体的方法费时费力,应研究采用新型的方法如基因工程抗体技术来制备抗体。
植原体不能体外培养带来的检测难题和植原体致病机制不清楚等问题是解决植原体病害的重大阻碍,随着生物技术的发展和进步,致力于植原体膜蛋白的研究,可为进一步深入研究植原体遗传学特性,根除植原体病害奠定基础。
参考文献
Arashida R., Kakizawa S., Ishii Y., Hoshi A., Jung H.Y., Kagiwada S., Yamaji Y., Oshima K., and Namba S., 2008, Cloning and characterization of the antigenic membrane protein (Amp) gene and in situ detection of Amp from malformed flowers infected with Japanese hydrangea phyllody phytoplasma, Phytopathology, 98(7): 769-775 doi:10.1094/PHYTO-98-7-0769 PMid:18943252
Barbara D.J., Morton A., Clark M.F., and Davies D.L., 2002, Immunodominant membrane proteins from two phytoplasmas in the aster yellows clade (chlorante aster yellows and clover phyllody) are highly divergent in the major hydrophilic region, Microbiology, 148(Pt1): 157-167 PMid:11782508
Berg M., Davies D.L., Clark M.F., Vetten H.J., Maier G., Marcone C., and Seemüller E., 1999, Isolation of the gene encoding an immunodominant membrane protein of the apple proliferation phytoplasma, and expression and characterization of the gene product, Microbiology, 145(Pt8): 1937-1943 doi:10.1099/13500872-145-8-1937 PMid:10463160
Blomquist C.L., Barbara D.J., Davies D.L., Clark M.F., and Kirkpatrick B.C., 2001, An immunodominant membrane protein gene from the Western X-disease phytoplasma is distinct from those of other phytoplasmas, Microbiology, 147(Pt3): 571-580 PMid:11238964
Chen T.A., and Jiang X.F., 1988, Monoclonal antibodies against the maize bushy stunt agent, Can. Microbiol., 34(1): 6-11 doi:10.1139/m88-002
den Blaauwen T., and Driessen A.J., 1996, Sec-dependent preprotein translocation in bacteria, Arch. Microbiol., 165(1): 1-8 doi:10.1007/s002030050289 PMid:8639021
Economou A., 1999, Following the leader: Bacterial protein export through the Sec pathway, Trends Microbiol., 7(8): 315-320 doi:10.1016/S0966-842X(99)01555-3
Guo Y.H., Cheng Z.M., Walla J.A., and Zhang Z., 1998, Diagnosis of X-disease phytoplasma in stone fruits by a monoclonal antibody developed directly from a woody plant, J. Environ. Hort., 16(1): 33-37
Hsu H.T., Lee I.M., Davis R.E., and Wang Y.C., 1990, Immunization for generation of hybridoma antibodies specifically reacting with plants infected with a mycoplasmalike organism (MLO) and their use in detection of MLO antigens, Phytopathology, 80(10): 946-950 doi:10.1094/Phyto-80-946
Jiang Y.P., Chen T.A., and Chiykowski L.N., 1989, Production of monoclonal antibodies to peach eastern X-disease agent and their use in disease detection, Plant Pathol., 11: 325-331
Kakizawa S., Oshima K., and Namba S., 2006, Diversity and functional importance of phytoplasma membrane proteins, Trends Microbiol., 14(6): 254-256 doi:10.1016/j.tim.2006.04.008 PMid:16678420
Kakizawa S., Oshima K., Kuboyama T., Nishigawa H., Jung H., Sawayanagi T., Tsuchizaki T., Miyata S., Ugaki M., and Namba S., 2001, Cloning and expression analysis of phytoplasma protein translocation genes, Mol. Plant Microbe. Interact, 14(9): 1043-1050 doi:10.1094/MPMI.2001.14.9.1043 PMid:11551069
Kakizawa S., Oshima K., Nishigawa H., Jung H.Y., Wei W., Suzuki S., Tanaka M., Miyata S., Ugaki M., and Namba S., 2004, Secretion of immunodominant membrane protein from onion yellows phytoplasma through the Sec protein-translocation system in Escherichia coli, Microbiology, 150(Pt1): 135-142 doi:10.1099/mic.0.26521-0 PMid:14702406
Lherminier J., Courtois M., and Caudwell A., 1994, Determination of the distribution and multiplication sites of Flavescence Dorée mycoplasma-like organisms in the host plant Vicia faba by ELISA and immunocytochemistry, Physiology Mol. Plant Pathology, 45(2): 125-138 doi:10.1016/S0885-5765(05)80071-2
Lin C.P., and Chen T.A., 1985, Monoclonal antibodies against the aster yellows agent, Science, 227(4691): 1233-1235 doi:10.1126/science.227.4691.1233 PMid:17757867
Lin N.S., Hsu Y.H., and Hsu H.T., 1990, Immunological detection of plant viruses and a mycoplasmalike organism by direct tissue blotting on nitrocellulose membranes, Phytopathology, 80(9): 824 -828 doi:10.1094/Phyto-80-824
Liu Z.J., Luo H.L., and Zhang J.N., eds, 1999, Phytoplasma phyopathology, China Forestry Publishing House, Beijing, China, (刘仲健, 罗焕亮, 张景宁, 1999, 植原体病理学, 中国林业出版社, 中国, 北京)
McCoy R.E., Caudwell A., and Chang C.J., 1989, Plant diseases associated with mycoplasma -like organisms, In: Whitcomb R.F., and Tully J.G., (eds), The mycoplasmas, vol. V, spiroplasmas, acholeplasmas, and mycoplasmas of plants and arthropods, San Diego, Academic Press, pp.546-640
Morton A., Davies D.L., Blomquist C.L., and Barbara D.J., 2003, Characterization of homologues of the apple proliferation immunodominant membrane protein gene from three related phytoplasmas, Molecular Plant Pathology, 4(2): 109-114 doi:10.1046/j.1364-3703.2003.00155.x PMid:20569369
Schwartz Y., Boudon-Padieu E., and Grange J., 1989, Monoclonal antibodies to mycoplasma -like organism (MLO) responsible for grapevine flavescence doree, Res. Microbiol., 140: 311-324 doi:10.1016/0923-2508(89)90023-5
Wei W., Kakizawa S., Jung H.Y., Suzuki S., Tanaka M., Nisashigawa N., Miyata S., Oshima K., Ugaki M., Hibi T., and Namba S., 2004, An antibody against the SecA membrane protein of one phytoplasma reacts with those of phylogenetically different phytoplasmas, Phytopathology, 94(7): 683-686 doi:10.1094/PHYTO.2004.94.7.683 PMid:18943899
Wieslander A., Boyer M.J., and Wroblewski H., 1992, Membrane protein structure in mycoplasmas, In: Maniloff J., McElhaney R.N., and Finch L.R., (eds), Molesidor biology and pathogenesis, Washington, DC: American Society for Microbiology, pp.93-112
Yu Y.L., Yeh K.W., and Lin C.P., 1998, An antigenic protein gene of a phytoplasma associated with sweet potato witches’ broom, Microbiology, 144: 1257-1262 doi:10.1099/00221287-144-5-1257 PMid:9611800
Yue H.N., Wu K., Wu Y.F., Zhang Y., and Sun R.H., 2009, Cloning and characterization of three subunits of the phytoplasma Sec protein translocation system associated with the paulownia witches’-broom, Zhiwu Baohu (Plant Protection), 35(2): 25-31 (岳红妮, 吴宽, 吴云锋, 张钰, 孙润红, 2009, 泡桐丛枝植原体Sec分泌蛋白转运系统3个亚基基因的克隆及蛋白特性分析, 植物保护, 35(2) : 25-31)