2. 湘桂集团, 南宁, 530022
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 17 篇 doi: 10.5376/gab.cn.2011.30.0017
收稿日期: 2011年03月31日 接受日期: 2011年04月12日 发表日期: 2011年04月29日
引用格式(中文):
樊宪伟等, 2011,果蔗体细胞胚发育与组织渗透压比关系研究,基因组学与应用生物学(online), Vol.30 No.17 pp.1105-1111 (doi: 10.5376/gab.cn.2011.30.0017)
引用格式(英文):
Fan et al., 2011, The relationship between development of somatic embryogenesis and osmotic pressure ratio of callus tissue in sugarcane, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.17 pp.1105-1111 (doi: 10.5376/gab.cn.2011.30.0017)
以果蔗(Badila)尾梢心叶近生长点部位0~3 cm为外植体,以MS培养基为基本培养基诱导愈伤组织、并在体细胞胚发育的不同阶段采取样品,运用石蜡切片显微技术,结合愈伤组织的渗透势,研究胚性愈伤组织与非胚性愈伤组织形态、体细胞胚的发育类型以及与渗透压比之间的关系。结果表明:不同时期和类型的愈伤组织在细胞形态结构上存在较大差异,胚性愈伤组织呈浅黄色、细胞质浓厚、细胞核较大,且此类型愈伤组织的渗透压比显著高于非胚性愈伤组织;在分化培养基上随着分化的进行,胚性愈伤组织渗透压比和摩尔浓度呈现下降趋势;而具有白色不定芽点时的胚性愈伤组织(分化质量不高)呈现显著下降;研究还发现果蔗Badila的器官建成倾向于以不定芽途径再生植株,同时也伴随体细胞胚的发生,体细胞胚的发育经历多细胞原胚、球型胚、梨型胚、盾片胚和子叶胚几个阶段,这与合子胚的发育途径相似。实验在同一张切片上观察到多个阶段的体细胞原胚,这可能由于细胞分裂及体细胞胚的发育不同步性造成的。本研究明确了细胞在分化过程中愈伤组织的类型与渗透压比的关系,阐明了果蔗Badila体细胞胚的发育特点,这为建立果蔗Badila的高效遗传转化体系奠定了基础。
黑皮果蔗Badila (Saccharum officinarum L.)属于果蔗的一种,是20世纪30年代由国外引进的热带型果蔗品种,在分类上属于禾本科甘蔗属热带种,是果蔗中的当家品种。由于它具有皮薄、茎脆、糖多和纤维少等特点,成为鲜食中的佳品。近十几年来,在南方各省,如广东、广西和福建等大面积种植,占果蔗栽培面积的70%。但目前生产上存在以下主要问题:一、甘蔗长期以种茎进行繁殖(游建华等, 2010, 黑皮果蔗茎尖脱毒种苗生产及繁殖技术, 中国种业, (3): 59),不仅繁殖速度慢,而且对种茎需求量较大,很难满足生产上的需要;二、现有的果蔗品种都存在耐旱性差、感染花叶病、螟害严重、栽培管理粗放和研究手段落后等问题,影响果蔗的开发利用(王水琦等, 2010);三、多年连续种植后极易出现品种退化现象,导致甘蔗植株变矮,节间变短,糖分下降,造成甘蔗减产(梁巧玲和赵鹂, 2007)。针对这些问题,黄诚梅等(2009)等对果蔗Badila脱毒后的光合能力进行了研究,发现脱毒植株的光合效率增强。而利用健壮黑皮果蔗Badila的腋芽(许莉萍等, 2000)和心叶(姚伟等, 2002)也建立了植株的再生体系,但并未对其植株再生途径(器官发生型还是体细胞胚发生型)进行探讨。因此,建立以体细胞胚发生途径的再生体系是果蔗快速繁殖、保持优良种性、通过遗传转化培育新的高产、优质的果蔗新品种的基础。
而有关甘蔗组织培养中体细胞胚胎发生现象很早就有过报道,曾吉恕(1979)就对甘蔗组织培养中胚状体的发生进行了研究,提出高浓度的2,4-D能促进胚性细胞团的繁殖和抑制绿芽的产生,低浓度或除去2,4-D则有利于胚性细胞团产生绿芽。之后,李春瑶等(1989)也对甘蔗体细胞的发生进行了观察和研究。但对于果蔗的研究较少,且多数报道仅在于探讨甘蔗体细胞发育过程的胚性细胞(林庆良等, 2010),或者揭示化学物质(如, 多胺)在渗透胁迫下对甘蔗愈伤组织诱导和分化作用(张木青等, 1996),而没有注意到在器官发生途径中渗透势的变化。本研究以果蔗Badila尾梢心叶作为试验材料,选择附加激素的培养基诱导愈伤组织,并进一步诱导分化成苗。在此过程中,对不同类型和时期的愈伤组织进行组织细胞学研究;并分析胚性愈伤组织的形态与其渗透势变化之间的关系。以期为探讨果蔗Badila体细胞胚胎的发生机理和发育特点提供实验证据。此外,果蔗Badila的胚状体及其植株再生体系是最理想的基因转化受体系统(林生等, 2009; 长孙东亭等, 2006; 罗敬萍, 2003),因此本研究也能够为果蔗Badila转基因研究提供一定的理论基础。
1结果与分析
1.1果蔗胚性愈伤组织与非胚性组织的细胞学差异
在实验过程中能观察到果蔗Badila的非胚性愈伤组织呈灰白色、半透明,水泽粘稠状,结构松软、轮廓不清楚(图1A);组织细胞学观察表明此类愈伤组织细胞体积大、液泡化程度高,细胞质稀少,细胞核相对较小,细胞间排列松散、不规则(图1B)。
果蔗Badila胚性愈伤组织呈浅黄色或紫红色、颗粒状,组织质地较硬、结构紧密,易松散、轮廓清楚(图1C);组织细胞学观察表明果蔗Badila的胚性愈伤组织细胞较小,细胞质浓厚,细胞核大、着色深,位于细胞中央,且细胞间排列紧密(图1D)。胚性愈伤组织细胞极易分化出胚状体,因而在这类愈伤组织上可看到许多大小不同的白色颗粒状芽点结构。
 图1 愈伤组织类型与其显微结构 |
1.2果蔗体细胞胚形态发生过程
果蔗Badila的胚性愈伤组织转接至分化培养基上,在培养3 d后就能观察到表面不定芽细胞分裂的启动,形成明显的细胞团突起,不定芽点的细胞排列紧密,细胞呈方形,细胞核大几乎占满整个细胞(图2A),表明甘蔗不定芽起源于愈伤组织表层,不定芽为多细胞起源,虽能观察到内部的分生细胞团(图2B),但对于其是否分化成不定芽,还有待观察。同时,也能观察到体细胞胚的发育同样经历多细胞原胚、球形胚、梨型胚、鱼雷胚和子叶胚等时期发育成小植株,同一切片上几乎能观察到除子叶型胚之前的所有胚型(图2D, E, F和G),这是因为分化的不同步的原因,且可以看出体细胞胚与其周围的组织存在较明显的界限,甚至脱离原组织;胚的分布有的在表面,也有的存在组织内部,表明体细胞胚既可以起源表面,也有起源于内部胚性细胞。在培养6 d后,能观察到体细胞胚的育过程中的子叶型胚,其具有明显的胚柄和胚根(图2H)。而且组织表面可以观察到不同大小的芽(图2C)。
 图2 果蔗Badila愈伤组织在培养过程中的体细胞胚发生 |
1.3果蔗不同类型的愈伤组织渗透势的差异
体细胞胚是否发生与愈伤组织类型密切相关,体细胞胚发生的不同阶段其细胞的形态均有所变化,对体细胞胚发生过程中不同阶段的愈伤组织的渗透势研究结果表明:果蔗Badila胚性愈伤组织(图3A)的渗透压比和摩尔浓度均显著高于非胚性愈伤组织(图3B)。当胚性愈伤组织接到分化培养基上时,在分化的不同阶段,渗透势也发生一定的变化。未开始进一步分化的胚性愈伤组织的渗透压比和摩尔浓度高于已经分化的胚性愈伤组织(带有绿色不定芽点的愈伤组织,分化培养基7~15 d)。而趋于褐化的黑褐色愈伤组织,不能分化,渗透压比和摩尔浓度显著低于胚性愈伤组织(表1)。当胚性愈伤组织转接到分化培养基上时,随着组织分化的进行(图3C, D, E和F),其渗透势也会发生一定的变化,相对于转接时的胚性愈伤组织,都有所下降,下降比较明显的是分化出白色不定芽点时的胚性愈伤组织(图3C),这类愈伤组织进一步分化苗的质量一般不高。而将胚性愈伤组织转接到不含激素的培养基上生长,一般会褐化,细胞不能正常的分裂,渗透势也与随之降低。
 表1 不同类型的愈伤组织的渗透压比和组织液的摩尔浓度 |
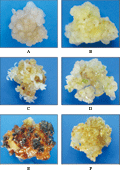 图3 不同分化阶段和类型的愈伤组织 |
2讨论
2.1果蔗Badila愈伤组织的组织细胞学变化
果蔗诱导愈伤组织的材料很多,通过果蔗Badila尾鞘幼叶(唐建平等, 2009),茎尖(李松等, 2010),嫩茎心叶(张木青等, 1996)。本文用尾鞘心叶诱导出的初生愈伤组织经进一步继代后,产生两种不同类型的愈伤组织:胚性愈伤组织和非胚性愈伤织。胚性愈伤组织主要由胚性细胞组成,具有较强的增殖和分化能力。众多研究表明与正常细胞相比,胚性细胞的细胞较小,原生质浓厚,细胞核大且细胞团DNA和蛋白质含量较高(曾吉恕, 1979; 罗紫娟等, 1985; 李春瑶等, 1989)。这类细胞形成胚性愈伤组织,具有较强的分裂和增殖能力,是遗传转化的理想受体(唐建平等, 2009; 于兰, 2007)。而非胚性愈伤组织主要由非胚性细胞组成,增殖能力较弱,基本不具备分化能力。这一结果与林庆良等(2010)研究相一致。
2.2果蔗Badila体细胞胚发生的细胞形态
本文分析了愈伤组织外观形态与细胞发育之间的关系,能够为我们判定愈伤组织类型提供依据。此外,通过对细胞发育变化的观察,探寻愈伤组织诱导不定芽和体细胞发生的再生途径。虽然甘蔗愈伤组织能在不附加任何激素的MS和N6培养基上诱导产生体细胞胚(曾吉恕, 1979; 李春瑶等, 1989),但是诱导率很低。对某些植物,6-BA既能诱导产生不定芽的分化,又能改变细胞极性和分裂平面,进而诱导体细胞胚的发生(崔凯荣和戴若兰, 2000)。本研究表明甘蔗心叶诱导和继代后的胚性愈伤组织在2,6-BA和0.05 mg/L NAA的诱导下,既能产生不定芽,也能形成体细胞胚。二者的发生频率相差很大,前者的发生率几乎达100%,不定芽与母体紧密相连,难以分离;而体细胞胚的发生率很低,只有少数为体细胞胚,具根芽两极性,能进一步发育成小植株。这说明不定芽和体细胞胚发生对激素的要求不同。
2.3果蔗Badila体细胞胚及形成过程中组织渗透势的变化
植物体细胞在离体培养中,通过体细胞胚胎发生途径形成再生植株已是及其普遍的现象,也是植物体细胞离体培养条件下的一个基本途径。崔凯荣和戴若兰(2000)对植物体细胞胚发生的分子生物学做了详尽的研究。虽然,赵小强等(2010)在草地早熟禾的原生质体培养中,得出原生质体培养中渗透压要逐步降低;杨模华(2010)研究马尾松的愈伤和培养基的渗透压的关系得出褐化的发生,可能是愈伤组织细胞内和培养基渗透压之间的不平衡所致的结论;程佑发等(2000)比较不同渗透压下民勤小枣的愈伤,指出高渗透压会造成细胞间生理隔离,保持细胞的相对独立性,这对胚性愈伤组织形成胚状体有利,而对于非胚性愈伤组织来说则对生长不利;王娟等(2010)的实验表明不同植物甚至同一物种不同生理状态的原生质体供体组织所要求的渗透压条件不尽相同,有必要根据具体的供体组织加以确定,以保证原生质体的分离效果;黄磊等(2008)研究表明,创伤和高渗透压预处理可以显著提高蝴蝶兰外植体的原球茎诱导效率。由此可以看出,前人对植物愈伤和渗透压关系的研究较深入且大多集中在原生质体诱导的愈伤,对于体细胞胚发生和组织渗透势的变化关系仍未见有报道。本研究发现胚性愈伤组织与非胚性愈伤组织在渗透压比和摩尔浓度方面存在较大的差异,反映出胚性愈伤组织有较高的渗透势和较低的含水量,这也与胚性细胞具有的较高的代谢速率(李中奎等, 2001)、为胚性细胞的分裂和增殖积累了较多的基本物质相一致。本研究表明,胚性愈伤组织的渗透势变化与其分化能力有密切关系,这为利用渗透势的变化筛选高分化率的愈伤组织提供了科学依据。
3 材料与方法
3.1 植物材料
实验以果蔗Badila尾梢心叶作为试验材料。实验材料来源于广西农业科学院甘蔗研究所的大田试种甘蔗,品种为果蔗Badila。
3.2 材料采集方法
取果蔗Badila组织培养再生植株体系建立过程中的初始愈伤组织,继代2~3次后的胚性与非胚性愈伤组织以及在分化过程中不同时期的组织。对于转接至诱导分化培养基上的愈伤组织,每隔3 d取一次样做石蜡切片,即0 d、3 d、6 d、9 d、12 d和15 d分期取样,连续取5次。
3.3 愈伤组织显微观察
取组织培养再生植株体系建立过程中不同时期的愈伤组织,将愈伤组织分割成大小约0.5 cm3的小块,用FAA固定液(5 mL福尔马林:5 mL冰醋酸:50%的乙醇90 mL)固定24 h,再经各级乙醇梯度(分别在30%, 50%, 70%, 80%, 95%和100%的乙醇)脱水。最后按照常规石蜡切片法制片,切片厚度5~6 μm,铁矾苏木精染色,脱蜡、脱水、封片后,在Olympus DP70显微镜下观察并拍照。
3.4 愈伤组织渗透势测定
取不同时期的愈伤组织块,大小约2倍黄豆大小,置于1.5 mL离心管中,每种组织设3个重复。捣碎后,12 000 rpm,离心5 min,吸取上清组织液约70 μL于1 mL离心管中。使用渗透压测定仪(型号: STY-1A渗透压测定仪, 天大天发科技有限公司)测定渗透势,记录各组织液的摩尔浓度和渗透压比。
作者贡献
本文的通讯作者樊宪伟和李有志是论文的设计者,为本研究提供了实验平台及整体的研究框架和思路;第一作者樊宪伟对实验提供了技术支持,并对论文进行了详细的阅读和细致修改;第二作者熊方杰进行了具体实验操作及论文初稿的撰写;第三作者梁琪,第四作者柳逸月协助了石蜡切片显微照相工作,第五作者陈书琴对本研究的开展提供了建设性的建议。
致谢
本研究选用的材料果蔗Badila是由广西农业科学院甘蔗研究所廖江熊博士的提供,另在论文成稿的过程中硕士生李春艳和宋贤冲对论文的格式做了部分修改,在此对他们的付出深表感谢。感谢两位匿名的同行评审人的评审建议和修改建议。
参考文献
Cheng Y.F., An L.Z., Pu T.L., and Wang X.L., 2000, Induction of callus and plant regeneration of Zizyphus jijuba Mill., Xibei Zhiwu Xuebao (Acta Botanica Boreall-Occidentalia Sinica), 20(3): 364-369 (程佑发, 安黎哲, 浦铜良, 王勋陵, 2000, 枣愈伤组织诱导和再生植株, 西北植物学报, 20(3): 364-369)
Cui K.R., and Dai R.L., eds., 2000, Somatic embryogenesis of molecular biology in plant, Science Press, Beijing, China, pp.1-215 (崔凯荣, 戴若兰, 2000 , 植物体细胞胚发生的分子生物学,科学出版社, 中国, 北京, pp.1-215)
Huang C.M., Li Y.R., Ye Y.P., and Jiang W., 2009, Photosynthetic characteristics of virus-free plantlets for chewing cane Badila, Guangxi Nongye Shengwu Kexue (Agricultural Science of Guangxi), 40(1): 39-42 (黄诚梅, 李杨瑞, 叶燕萍, 江文, 2009, 果蔗Badila脱毒组培苗的光合特性, 广西农业生物科学, 40(1): 39-42)
Huang L., Chen Z.L., Wu K.L., Zeng S.J., and Duan J., 2008, Effects of wound and high osmotic pressure pretreatments on PLB induction from leaf explants in Phalaenopsis amabilis, 2008, Yuanyi Xuebao (Acta Horticuhurae Siniea), 35(7):1039-1046 (黄磊, 陈之林, 吴坤林, 曾宋君, 段俊, 2008, 创伤及高渗透压预处理对蝴蝶兰叶片诱导类原球茎的影响, 园艺学报, 35(7): 1039-1046)
Li C.Y., Li J.S., Liang Q.H., and Yang J.H., 1989, Somatic embryogenesis and plant regeneration from leaf tissues of sugarcane, Guangxi Zhiwu (Guihaia), 9(3): 243-246 (李春瑶, 李军生, 梁倩华, 杨继华, 1989, 甘蔗幼叶切段培养中的体细胞胚胎发生, 广西植物, 9(3): 243-246)
Li S., Yu K.X., Liu L.M., Dan M., Liu H.J., Yang L., Tan F., You J.H., and Dai Y.M., 2010, Sugarcane micropropagation through shoot-tip embryogenesis, Zhongguo Tangliao (Sugar Crops of China) (4): 1-5, 8 (李松, 余坤兴, 刘丽敏, 淡明, 刘红坚, 杨柳, 谭芳, 游建华, 戴友铭, 2010, 甘蔗茎尖胚状体脱毒苗快繁技术研究, 中国糖料, (4): 1-5, 8)
Li Z.K., Liu C.Y., and Liu W.P., 2001, Formation and development of internal embryonic cells in callus of rice [Oryza sativa L.], Zhiwu Yanjiu (Bulletin of Botanical Research), 21(1): 62-67 (李中奎, 刘成运, 刘文平, 2001, 水稻愈伤组织内部胚性细胞的形成及发育, 植物研究, 21(1): 62-67)
Liang Q.L., and Zhao L., 2007, Induction of Callus in Saccharum Sinense and the plant regeneration, Anhui Nongye Kexue (Journal Anhui Agricultural Sciences), 35(32): 10246-10247 (梁巧玲, 赵鹂, 2007, 甘蔗愈伤组织诱导与植株再生研究, 安徽农业科学, 35(32): 10246-10247)
Lin Q.L., Xu L.P., Gao S.W., and Fu H.Y., 2010, Cytohistological examination of embryogenesis sugarcane, Redai Zuowu Xuebao (Chinese Journal of Tropical Crops), 31(8): 1303-1308 (林庆良, 许莉萍, 高世武, 傅华英, 2010, 甘蔗胚性愈伤组织发生与发育的组织细胞学观察, 热带作物学报, 2010, 31(8): 1303-1308)
Lin S., Pan D.R., Zhou Y.F., Chen G.S., and Zhang X.Z., 2009, Construction of antisense expression vector of Rar1 fragment and transforming into chewing cane, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 25(21): 64-68 (林生, 潘大仁, 周以飞, 陈观水, 张绪璋, 2009, 果蔗Rar1基因反义载体的构建及遗传转化初步研究, 中国农学通报, 25(21): 64-68)
Luo J.P., Zhang S.Z., and Yang B.P., 2003, GFP gene transformation of sugarcane mediated by Agrobacterium tumefaciens, Redai Zuowu Xuebao (Chinese Journal of Tropical Crops), 24(4): 23-28 (罗敬萍, 张树珍, 杨本鹏, 2003, 农杆菌介导甘蔗基因转化技术的优化, 热带作物学报, 24(4): 23-28)
Luo Z.J., Tang D.X., Liang Q.H., and Shi G.Y., 1985, Comparison of certain characteristics of embryoids and callus of sugar-cane, Guangxi Zhiwu (Guihaia), 5(1): 60-64 (罗紫娟, 唐典禧, 梁倩华, 石贵玉, 1985, 甘蔗胚性细胞团和愈伤组织某些性质的比较, 广西植物, 5(1): 60-64)
Tang J.P., Cai W.W., Wang J.G., Luo Z.X., Zhang S.Z., and Lin H.M., 2009, Agrobacterium-mediated transformation of sugarcane for sucrose: Sucrose 1-fructosyltransferase gene , Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(3): 579-582 (唐建平, 蔡文伟, 王俊刚, 罗遵喜, 张树珍, 林海妹, 2009, 农杆菌介导蔗糖: 蔗糖果糖基转移酶基因转化甘蔗, 分子植物育种, 7(3), 579-582)
Wang J., Li Y.Z., and Shi S.L., 2010, Dissociation and culture of callus protoplasts of Medicago sativa L., Caodi Xuebao (Acta Agrestia Sinica), 18(2): 258-262 (王娟, 李玉珠, 师尚礼, 2010, 苜蓿愈伤组织原生质体游离与培养, 草地学报, 18(2): 258-262)
Wang S.Q., Tang H., and Zeng D.H., 2001, Present production and situation and recent research progress of chewing cane, Jiangxi Nongye Xuebao (Acta Agriculturae Jiangxi), 13(2): 54-59 (王水琦, 汤浩, 曾东火, 2010, 果蔗生产概况及相关研究新进展, 江西农业学报, 13(2): 54-59)
Xu L.P., Fu H.Y., and Pan D.R., 2000, Selection of constitutions of medium and hormone for flash propagating of axillary buds in sugarcane, Fujian Nongye Daxue Xuebao (Journal of Fujian Agricultural University), 29(4): 401-404 (许莉萍, 傅华英, 潘大仁, 2000, 甘蔗腋芽快速繁殖培养基及激素配方的筛选, 福建农业大学学报, 29(4): 401-404)
Yang M.H., Li Z.H., Zhang D.L., Huang Z., and Ding G.J., 2010, Callus maintenance, proliferation and differentiation of new sprout of Pinus massoniana L., 1-6, http://www.paper.edu.cn (杨模华, 李志辉, 张冬林, 黄振, 丁贵杰, 2010, 马尾松嫩茎愈伤组织保持、增殖与不定芽分化培养, 中国科技论文在线, 1-6, http://www.paper.edu.cn)
Yao W., Zhou H., and Chen R.K., 2002, Tissue culture and plantlet regeneration of sugarcane "Badila", Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 38(3): 251 (姚伟, 周会, 陈如凯, 2002, 果蔗Badila的组织培养和植株再生, 植物生理学通讯, 38(3): 251)
Yu L., Qin X.M., and Huang D.Q., 2007, Studies on BT gene transformation sugarcane by Agrobacterium, Guangxi Nongxuebao (Journal of Guangxi Agriculture), 22(6): 1-4, 67 (于兰, 秦新民, 黄德青, 2007, 农杆菌介导的BT基因导入甘蔗的研究, 广西农学报, 22(6): 1-4, 67)
Zeng J.S., 1979, In vitro embryogenesis from somatic leaf callus of sugar cane, Zhiwu Shengli Xuebao (Acta phytophysiologia Sinica), 5(4): 411-416 (曾吉恕, 1979, 甘蔗体细胞培养中的胚状体发生, 植物生理学报, 5(4): 411-416)
Zhangsun D.T., Luo S.L., Chen R.K., Lin J.Y., and Yan J.Y., 2006, GNA gene genetic transformation of sugarcane by particle bombardment, Shengwu Jishu (Biotechnology), 16(3): 51-55 (长孙东亭, 罗素兰, 陈如凯, 林皎月, 严建燕, 2006, 基因枪法介导GNA基因遗传转化甘蔗的研究, 生物技术, 16(3): 51-55)
Zhao X.Q., Ma H.L., Lin D., Zhou W.H., and Wu X., 2010, Culture and plant regeneration of protoplasts from embryogenic calli of Nuglade (Poa pratensis), Caoye Xuebao (Acta Prataculturae Turae Sinica), 19(2): 55-60 (赵小强, 马晖玲, 林栋, 周万海, 吴翔, 2010, 草地早熟禾新格莱德胚性愈伤组织原生质体培养及植株再生的研究, 草业学报, 19(2): 55-60)