2. 东北林业大学盐碱地生物资源环境研究中心, 哈尔滨, 150040
3. 广西大学生命科学与技术学院, 南宁, 530005
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 6 篇 doi: 10.5376/gab.cn.2011.30.0006
收稿日期: 2011年05月26日 接受日期: 2011年06月30日 发表日期: 2011年06月03日
引用格式(中文):
刘卓明等, 2011,Cry1Ac22全长基因及毒蛋白功能区植物表达载体的构建与拟南芥转化,基因组学与应用生物学(online), Vol.30 No.6 pp.1032-1037 (doi: 10.5376/gab.cn.2011.30.0006)
引用格式(英文):
Liu et al., 2011, Construction of Plant Expression Constructs Harboring Full-length Bt Cry1Ac22 Toxin Gene and Truncated Functional Domains of Bt Cry1Ac22 Toxin and Arabidopsis Transformation, Bioscience Methods, (doi:10.5376/bm.2011.02.0003)
本研究用PCR方法从Bt菌株W015-1中克隆出了cry1Ac22全长基因(3 534 bp)及其毒蛋白功能区片段(1 959 bp),将其连接到用Sal I和BamH I切除了ß-glucuronidase基因的植物表达载体pBI121上,构建了具有卡那霉素抗性的植物表达载体pBI121-Cry1Ac22F和pBI121-Cry1Ac22T。构建的T-DNA植物表达载体pBI121-Cry1Ac22F和pBI121-Cry1Ac22T获得了酶切、PCR扩增的正确性验证。将T-DNA载体pBI121-Cry1Ac22F和pBI121-Cry1Ac22T用农杆菌介导法转化开花期拟南芥,最后,我们获得大量具有卡那霉素抗性的转基因拟南芥植物种子。
苏云金芽孢杆菌毒蛋白基因(Bt-toxin)是最常用的抗虫基因,已经广泛的应用于抗鳞翅目、鞘翅目等害虫的转基因棉花、水稻等农作物以及杨树、桉树等林木(van Wordragen et al., 1993)。cry1Ac基因是一种广泛应用于转基因棉花对鳞翅目昆虫有高毒杀活性的杀虫基因。据研究,Cry1Ac杀虫晶体蛋白的毒性肽由三个典型的结构域组成。结构域I位于肽链的N端,为一组α螺旋束,由6~7个两亲的α螺旋围绕着一个疏水的α螺旋形成的,参与了细胞膜的穿孔;结构域Ⅱ位于肽链的中间,为三组以“希腊钥匙”(Greek key)拓扑结构连接在一起的反平行的β折叠片层,其顶端的突环参与了毒素与受体蛋白的结合;位于C端的结构域Ⅲ是由两组反平行的β折叠片层组成的夹心结构,以β果酱卷(jelly roll)拓扑结构排列,能够防止蛋白酶对毒素分子的过度降解(Schnepf et al., 1998)。
cry1Ac22基因是从僵死蚕幼虫的肠道中分离的菌株W015中克隆出来的(Xie et al., 2010),在大肠杆菌、酵母中能高效表达(Liu et al., 2010a; 2010b),表达产物对小菜蛾具有较强的杀虫活性。cry1Ac22基因在大肠杆菌中表达的毒性蛋白在胰蛋白酶降解后形成一个约65 kD的蛋白,并仍然具有生物活性(Xie et al., 2010),这与cry1Ac基因在苏云金芽胞杆菌中表达毒性蛋白可能降解成65 kD的核心蛋白的报道相一致(Lenin et al., 2001)。因此,对Bt W015-1来源的cry1Ac22全长基因及其部分的功能区进行表达研究是十分重要的。
本试验采用PCR手段克隆了cry1Ac22的全长基因及其基因功能区,分别构建在pBI121植物表达载体上,得到了具有卡那霉素抗性的植物表达载体pBI121-Cry1Ac22F和pBI121-Cry1Ac22T。应用农杆菌介导法转化开花期拟南芥,获得大量具有卡那霉素抗性的转基因拟南芥植物种子,为cry1Ac22基因的转基因植物拟南芥研究奠定了基础。
1结果与分析
1.1 Cry1Ac22全长基因及Cry1Ac22基因功能区的克隆
特异引物分别扩增cry1Ac22基因和cry1Ac22基因功能区,分别获得了3 534 bp的全长基因(图1A)和1 959 bp的功能区基因(图2A)。将目的基因分别克隆至pMD18-T载体上(图1B),采用BamH I和Sal I酶切鉴定阳性克隆。酶切片段分别为3.5 kb和1.9 kb,与理论值大小一致,分别命名为pMD18-T-Cry1Ac22F (图1C)和pMD18-T-Cry1Ac22T (图2B)。再对阳性克隆进行测序,将序列后在GenBank中进行比对,序列与Cry1Ac基因型完全相同。
图1 cry1Ac22的扩增及pMD18-T-Cry1Ac22F的验证 |
.png) 图2 Cry1Ac22T的扩增及pMD18-T-Cry1Ac22T的验证 |
1.2 pBI121-Cry1Ac22F植物表达载体的构建
将pMD18-T-Cry1Ac22重组质粒上的目的基因酶切后连接至pBI121植物表达载体,并转化到大肠杆菌JM109中进行酶切鉴定,BamH I和Sal I酶切鉴定存在一条3.5 kb的目的条带和一条18 kb的载体条带,表明pBI121-Cry1Ac22F表达载体已经构建成功(图3)。
图3 BamHⅠ和SalⅠ酶切重组质粒pBI121-Cry1Ac22F |
1.3 pBI121-Cry1Ac22T植物表达载体的构建
将pMD18-T-Cry1Ac22T重组质粒上的目的基因酶切后连接至pBI121植物表达载体,并转化到大肠杆菌JM109中进行酶切鉴定,BamH I和Sal I酶切鉴定存在一条1.9 kb的目的条带和一条18 kb的载体条带,表明pBI121-Cry1Ac22T表达载体已经构建成功(图4)。
图4 BamHⅠ和SalⅠ酶切重组质粒pBI121-Cry1Ac22T |
1.4农杆菌重组质粒的PCR的鉴定
将构建好的重组植物表达载体转化到农杆菌EHA105中,通过试剂盒提取农杆菌质粒,采用构建植物表达载体的特异引物扩增鉴定阳性克隆。pBI121-Cry1Ac22F扩增出一条3.5 kb的目的条带(图5),pBI121-Cry1Ac22T扩增出一条1.9 kb的目的条带(图6),表明pB1121-Cry1Ac22F和pB1121- Cry1Ac22T已成功转入到农杆菌EHA105中。
图5 pB1121-Cry1Ac22F PCR鉴定 |
图6 pB1121-Cry1Ac22T PCR鉴定 |
1.5转基因拟南芥的分子检测
分别取转入了cry1Ac22F全长基因和cry1Ac22T功能域基因的拟南芥植株及未转基因对照拟南芥的叶片,提取其总DNA进行PCR检测。在cry1Ac22F全长基因检测中,2号(pBI121-Cry1Ac22F阳性对照)、3号、4号、6号、7号、8号和10号植株均扩增出3.5 kb的cry1Ac22F全长片段,而1号阴性对照(未转基因拟南芥)与5号、9号植株无扩增目的产物。结果表明3号、4号、6号、7号、8号和10号拟南芥植株已有cry1Ac22F杀虫基因的整合,为转基因植株(图7)。
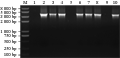 图7 cry1Ac22F转基因植株分子检测结果 |
对转入Cry1Ac22T基因检测中,2号(pBI121-Cry1 Ac22T阳性对照)和3号、5号、6号、9号和10号植株均扩增出1.9 kb的Cry1Ac22T片段, 而1号阴性对照(未转基因拟南芥)与4号、7号、8号植株无扩增目的产物。结果表明3号、5号、6号、9号和10号拟南芥植株已有cry1Ac22T基因的整合,为转基因植株(图8)。
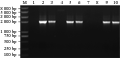 图8 cry1Ac22T转基因植株分子检测结果 |
2讨论
苏云金芽孢杆菌Cry1A类毒蛋白基因是最常用的抗虫目标基因,其中cry1Ac基因广泛的应用于抗虫转基因棉花。大量研究表明,全长的Cry1A类基因转化了许多作物,包括棉花、水稻、马铃薯(1992)、玉米、油菜、大豆、甘蔗、花生等,但这些转基因植株的Bt杀虫蛋白表达量仍然比较低,对害虫缺乏很好的毒杀力(Romeis et al., 2006)。这也表明全长的Cry1A类基因可能并不适合直接转化植物。因此,改造Bt杀虫基因,提高杀虫蛋白在转基因植物中的表达量成为Bt转基因植物研究的主要方向。
本实验中,我们构建了pBI121-Cry1Ac22和pBI121-Cry1Ac22domain两种植物表达载体,并进行了模式植物拟南芥的转化,经过卡那霉素筛选后得到了转基因拟南芥植物种子。分子鉴定结果证实了Cry1Ac22和Cry1Ac22 domain基因的整合,并得到了转基因拟南芥植株。此项工作为下一步通过杀虫生物活性测定来确定杀虫基因活性最适功能区奠定了基础。
3材料与方法
3.1材料与试剂
大肠杆菌JM109、pMD18-T载体和pBI121植物表达载体均由本实验室保存。DNA限制性内切酶SalⅠ、BamHⅠ、DNA Marker、T4 DNA连接酶、Taq DNA聚合酶和DNA凝胶回收试剂盒等购自TaKaRa公司。抗生素、主要生化与分子生物学试剂购自上海生工生物工程有限公司和哈尔滨德美生物公司等。引物由北京奥科生物技术公司合成。其它化学试剂均为国产分析纯。
3.2质粒的提取、纯化及大肠杆菌感受态细胞的制备
利用碱裂解法快速提取大肠杆菌和根瘤农杆菌质粒(张学民等, 2000);CaCl2法制备大肠杆菌感受态细胞(Sambrook et al., 1992)。
3.3 PCR引物设计
根据cry1Ac22基因序列及功能结构特点分析设计两对特异引物(表1),由南京金斯特生物技术公司合成。其中上游引物含有BamHⅠ酶切位点,下游引物含有SalⅠ酶切位点。
.png) 表1 PCR引物 |
3.4 Cry1Ac22F全长基因及Cry1Ac22T功能区基因的获得
以菌株W015基因组为模板采用特异引物分别扩增cry1Ac22F和cry1Ac22T基因。PCR反应程序:94℃预变性5 min;94℃变性1 min,54℃退火1 min,72℃延伸3 min,30个循环,4℃保存,获得了目的片段。将扩增产物进行琼脂糖凝胶电泳,胶回收产物与pMD18-T载体连接,转化后提取重组质粒,用BamHⅠ和SalⅠ酶切鉴定阳性克隆。将阳性克隆测序,测序后在GenBank进行比对分析。
3.5 pBI121-Cry1Ac22F植物表达载体的构建
载体pBI121是由CaMV35S启动子驱动的植物表达载体,带有卡那霉素抗性标记基因。将增设酶切位点BamHⅠ和SalⅠ的pMD18-T-Cry1Ac22F重组质粒用限制性内切酶BamHⅠ和SalⅠ酶切,酶切后的DNA片段与用相同酶切的pBI121载体连接,并转化到大肠杆菌JM109中进行酶切鉴定,酶切鉴定筛选出正确的pBI121-Cry1Ac22F。植物表载体pBI121-Cry1Ac22F重组质粒结构如图9所示。
图9 pBI121-Cry1Ac22F重组质粒结构图 |
3.6 pBI121-Cry1Ac22T植物表达载体的获得
将增设酶切位点BamHⅠ和SalⅠ的pBI121- Cry1Ac22T重组质粒分别用限制性内切酶BamHⅠ和SalⅠ酶切,酶切后的DNA片段与用相同酶切的pBI121载体连接,并转化到大肠杆菌JM109中进行酶切鉴定,酶切鉴定筛选出正确的pBI121-Cry1Ac22T。植物表载体pBI121-Cry1Ac22T重组质粒结构图如图10所示。
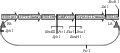 图10 pBI121-Cry1Ac22T重组质粒结构图 |
3.7农杆菌重组质粒的PCR鉴定
将已构建的2个植物表达载体转化农杆菌感受态细胞,采用碱裂试剂盒提取农杆菌质粒DNA,用表1中构建pBI121-Cry1Ac22F和pBI121-Cry1Ac22T重组质粒的引物进行PCR鉴定阳性克隆。反应程序为:94℃预变性5 min;94℃变性1 min,54℃退火1 min,72℃延伸3 min,30个循环,4℃保存。扩增结束后,将PCR产物进行琼脂糖凝胶电泳。
3.8转基因拟南芥
拟南芥的转化采用花序浸润法,参考Clough等(1998)的方法并略作修改进行。挑取含有植物表达载体pBI121-Cry1Ac22F和pBI121-Cry1Ac22T农杆菌落接入10 mL LB液体培养基中,28℃恒温振摇过夜,再将得到的菌液按1%接入500 mL LB液体培养基中,28℃恒温振摇使农杆菌的浓度达到OD600nm=1.0~1.2,在4℃下3 000 rpm离心15 min,弃上清后用浸润培养基(1/2 MS+ 5%(w/v) Sucrose+0.044 μM Benzylamine purine)重新悬浮农杆菌,并加入表面活性剂SilwetL-77,使其终浓度达到5 μL/L。
将拟南芥花盆倒扣于装有500 mL菌悬液的浸润器皿上,使植株的花序浸没在菌液中浸染10~15 min,暗室中培养2天,取出恢复正常培养。按拟南芥培养正常条件,收集种子。
3.9转基因拟南芥的Km选择和PCR检测
Km选择和PCR检测参考Clough等(1998)的方法并略作修改。浸润过农杆菌的拟南芥植株上的种子,采用95%的乙醇处理种子30~60 s,接着用含0.05% Tween的3.0%次氯酸钠处理5 min,然后用无菌水漂洗4~5次。消过毒的种子于2 mL 0.1%无菌琼脂糖中悬浮,并以每个9 mm的培养皿4 mg种子量覆盖培养基的方式播种,选择培养皿中含有1/2×MS+50 μg/mL卡那霉素(Km)+0.8%琼脂。
播有种子的选择培养基先置4℃下冷处理2 d,然后再24℃下23 h光照/1 h 黑暗生长7~10 d,观察所长成植株的颜色与根系发育情况,以鉴别植株是否含有基因。
抗性植株移植到营养钵中正常培养。以具卡那霉素抗性的拟南芥苗幼嫩叶片为材料,用改良CTAB法小量提取的拟南芥基因组DNA。以DNA为模版,非转基因拟南芥基因组DNA阴性为对照,构建好的pBI121-Cry1Ac22F和pBI121-Cry1Ac22T质粒为阳性对照,以cry1Ac22F和cry1Ac22F基因特异引物(预计扩增产物分别为3 534 bp和1 959 bp)进行转基因植株的PCR 鉴定,PCR反应程序为: 94℃预变性5 min,94℃变性1 min;54℃退火1 min,72℃延伸3 min,30个循环。扩增结束后,将PCR产物进行琼脂糖凝胶电泳。
作者贡献
刘卓明是本研究的实验设计和实验研究执行人;刘卓明、张文飞、谢柳和叶大维完成数据分析,论文写作与修改;柳参奎参与实验设计,试验结果分析;方宣钧是项目的负责人,指导实验设计,数据分析,论文修改和写作。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金重大项目(项目编号:30392100)和国家863计划(项目编号:2004AA2111112)共同资助。作者感谢东北林业大学盐碱地资源环境中心张欣欣博士在本实验过程中的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Clough S.J., Bent A.F.,1998, Floral dip: a simplified method for Agrobacterium-mediated transformation of Arabidopsis thaliana, Plant J., 16(6): 735-743 doi:10.1046/j.1365-313x.1998.00343.x PMid:10069079
Lenin K., Mariam M.A. and Udayasuriyan V., 2001, Expression of a cry2Aa gene in an acrystalliferous Bacillus thuringiensis strain and toxicity of Cry2Aa against Helicoverpa armigera, World Journal of Microbiology and Biotechnology, Vol.17 No.3 doi:10.1023/A:1016674417728
Liu S.K., Liu Z.M., Li Y.Z., Fang X.J., 2010, Expression and Localization of Cry1Ac22 Crystal Protein from Bacillus thuringiensis W015-1 in Yeast (Saccharomyces cerevisiae), Bt Research (online), Vol.1 No.2 doi: 10.5376/bt.2010.01.0002
Liu Z.M., Liu S.K., Li Y.Z., Fang X.J., 2010, Heterologous expression and purification of Cry1Ac22 toxin from Bacillus thuringiensis W015-1, Bioscience Methods (online), Vol.1 No.2 doi: 10.5376/bm.2010.01.0002
Romeis J., Meissle M., Bigler F., 2006, Transgenic crops expressing Bacillus thuringiensis toxins and biological control, Nat. Biotechnol., 24(1): 63-71 doi:10.1038/nbt1180 PMid:16404399
Sambrook J., Fritsch E.F., and Maniatis T., eds., Jin D.Y., and Li M.F., trans., 1992, Molecular Cloning: A Laboratory Manual(2nd), Science Press, Beijing, China, pp.16-34 (J. 萨姆布鲁克, E.F.弗里奇, T.曼尼阿蒂斯, 主编, 金冬雁, 黎孟枫, 主译, 1992, 分子克隆实验指南(第二版), 科学出版社, 中国, 北京, pp.16-34)
Schnepf E., Crickmore N., van Rie J., Lereclus D., Baum J., Feitelson J., Zeigler D.R., and Dean D.H., 1998, Bacillus thuringiensis and its pesticidal crystal protein, Microbiol. And Molecular Biology Review, 62(3): 775-806 PMid:9729609 PMCid:98934
van Wordragen M.F., Honée G.,and Dons H.J.M., 1993, Insect-resistant chrysanthemum calluses by introduction of a Bacillus thuringiensis crystal protein gene, Transgenic Research, 2(3): 170-180 doi:10.1007/BF01972611 PMid:8353535
Xie L., Zhang W.F., Liu Z.M., Cai Y.G., Li Y.Z., and Fang X.J., 2010, Characterization of a new highly toxic isolate of Bacillus thuringiensis from the diapausing larvae of silkworm and identification of Cry1A 22 gene, Bt Research, Vol 2010 No 1 doi:10.5376/bt.2010.01.0001
Zhang X.M., and Wang J.S., 2000, A modified alkaline lysis method for thepreparation of plasmid DNA, Anhui Daxue Xuebao (Journal of Anhui University) (Ziran Kexue), 24(4): 75-77 (张学民, 王金生, 2000, 碱裂解法提取质粒DNA方法的改进, 安徽大学学报(自然科学版), 24(4): 75-77)