2. 广西农业科学院植保所, 南宁, 530007
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 33 篇 doi: 10.5376/gab.cn.2011.30.0033
收稿日期: 2011年05月23日 接受日期: 2011年06月17日 发表日期: 2011年07月05日
引用格式(中文):
肖永胜等, 2011,一株水稻细菌性条斑病菌的鉴定与遗传操作系统的建立,基因组学与应用生物学(online), Vol.30 No.33 pp.1211-1217 (doi: 10.5376/gab.cn.2011.30.0033)
引用格式(英文):
Xiao et al., 2011, Characterization of a Xanthomonas oryzae pv. oryzicola strain and the establishment of its genetic manipulation system, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.33 pp.1211-1217 (doi: 10.5376/gab.cn.2011.30.0033)
水稻细菌性条斑病是水稻重要的病害之一,由水稻黄单胞菌栖稻致病变种(俗称水稻细菌性条斑病菌) (Xanthomonas oryzae pv. oryzicola, Xoc)引起。本研究对从广西贺州莲塘镇水稻条斑病发病植株上分离的一株病原分离株进行了表型分析、致病性检测和分子鉴定。该分离株在NA培养基上菌落呈圆形、凸起、乳黄色,表面光滑、湿润,质地粘稠。菌体呈革兰氏阴性反应,胞外蛋白酶活性较强,胞外纤维素酶及胞外淀粉酶活性较弱。针刺接种该分离株,10 d后水稻叶片叶脉间呈条形病斑。该分离株的16S-23S rDNA ITS序列与已发表的水稻细菌性条斑病菌菲律宾菌株BLS256的完全一致,确认该分离株为水稻细菌性条斑病菌。该水稻细菌性条斑病菌的一个表型及致病力与原始分离株较为一致的抗利福平自发突变体,被命名为Xoc GX01菌株。对Xoc GX01菌株进行遗传转化和细菌接合测试,结果表明该菌株能够高效地接受外源DNA。三亲接合pL3A2641质粒(pLAFR3的衍生质粒)的效率为2.3×10-4,电脉冲转化EZ-Tn5的效率为3.94×103 cfu/μg DNA。Xoc GX01菌株遗传操作系统的建立为进一步有效分离鉴定Xoc的致病相关基因、阐明该菌的致病分子机理奠定了基础。
水稻细菌性条斑病(也称水稻细条病或水稻条斑病)是热带、亚热带稻区的主要病害之一,造成严重的水稻减产和经济损失。该病的病原物为水稻黄单胞菌栖稻致病变种(Xanthomonas oryzae pv. oryzicola, 简写为Xoc) (方中达等, 1957; Niño-Liu et al., 2006),俗称水稻细菌性条斑病菌或水稻细条病菌(姬广海等, 2002)。自然条件下,水稻细菌性条斑病菌可侵染水稻、野生稻、李氏禾以及茭白等植物,是我国主要检疫对象。弄清病原菌的致病分子机理是发展高效、有针对性、环境友好的防治病害的药物和方法的前提,而建立完善的遗传操作系统是开展致病分子机理研究和致病功能基因组学研究的基础。
近年来广西局部地区该病发生相当严重(贺文爱等, 2010),迫切需要加强水稻细菌性条斑病防控机理的研究。为此,在对一批广西水稻细菌性条斑病分离株初步评价的基础上,本研究对从广西贺州莲塘镇条斑病发病稻株上分离的一株病原物分离株进行了表型分析、致病力检测和分子鉴定,确认该分离株为水稻细条病菌,并对该菌株进行了遗传转化和接合实验,成功地建立了水稻细菌性条斑病菌广西菌株的遗传操作系统,为下一步开展水稻细菌性条斑病致病机理的功能基因组学研究提供研究材料。
1结果与分析
1.1水稻细条病病原分离株表型鉴定与致病力分析
为了获得一株致病性稳定,并可以进行遗传操作的水稻细菌性条斑病菌菌株,在对一批水稻细菌性条斑病菌分离株初步评价的基础上,我们对从广西贺州莲塘镇水稻条斑病病原分离株LT4进行了表型分析和致病力检测。该分离株呈革兰氏阴性反应。稀释涂板法在NA固体培养基上获得LT4单菌落,菌落呈乳黄色、不透明,圆形、凸起,表面光滑、湿润,质地粘稠。在含有脱脂牛奶、羧甲基纤维素或可溶性淀粉的NA固体培养基上,培养3 d后,并经染色处理后,LT4菌落能产生相应的透明圈(图1A~D)。脱脂牛奶平板上的透明圈直径显著大于菌落直径,而羧甲基纤维素或可溶性淀粉平板上的透明圈直径接近菌落直径。结果表明该病原分离株具有较高的胞外蛋白酶活性,以及较弱的胞外纤维素酶和胞外淀粉酶活性。
采用针刺接种法在水稻日本晴品种上对LT4的致病力进行鉴定。LT4接种10 d后,在水稻叶片上能出现明显的病斑,平均约3 cm长,表明LT4具有较高的致病性。而作为对照的NB培养基不产生病斑(图1E)。

1.2水稻细条病病原分离株16S-23S rDNA ITS序列分析与分子鉴定
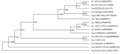
提取LT4分离株的总DNA作为PCR模板,在Ex Taq酶的催化下用通用引物AW39056和AW39057扩增16S-23S rDNA ITS片段,PCR产物由上海鼎安测序公司纯化并测序。LT4分离株16S-23S rDNA ITS片段长度为561 bp (已投GenBank: JF938915),与Gen- Bank数据库中Xoc BLS256菌株(GenBank: AAQN 00000000.1)的16S-23S rDNA ITS完全一致。多序列比对与进化分析结果表明(图2),在黄单胞菌属中,LT4分离株与Xoc BLS256位于同一进化分支,与水稻白叶枯病菌(Xanthomonas oryzae pv. oryzae, Xoo)进化距离较为接近,与辣椒斑点病菌(Xanthomonas campestris pv. vesicatoria, Xcv)的进化关系较远。分子水平上,确认LT4分离株为水稻细菌性条斑病菌。
为了构建水稻细菌性条斑病菌广西分离株的遗传操作系统,我们通过平板筛选,获得了5株抗利福平自发突变体。这些突变体的表型、致病力与LT4分离株的没有显著差异(结果未显示),其16S-23S rDNA ITS序列与原分离株一致。任选一株LT4分离株的抗利福平突变体,将此菌株命名为Xoc GX01菌株。
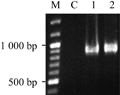
1.3 Xoc GX01菌株的三亲接合测试
以Xoc GX01作为受体菌,将含有pL3A2641 (含有十字花科黑腐病XC2641基因的启动子和编码框的pLAFR3,用于检测三亲接合实验)的大肠杆菌JM109菌株作为供体菌,大肠杆菌ED8767/pRK2073菌株作为帮助菌株,进行三亲本接合实验。在含有50 μg/mL Rif和5 μg/mL Tc的NA固体培养基平板上筛选三亲接合子,接合效率为2.3×10-4。随机选取2个Xoc GX01的三亲接合子,提取质粒,利用XC2641编码框(Qian et al., 2005)的扩增引物A-2641F、A-2641R进行PCR扩增,PCR产物的电泳结果如图3所示,均扩增出目的条带(868 bp),即表明质粒pL3A2641确实已导入Xoc GX01中。
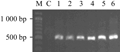
1.4 Xoc GX01菌株的电转化测试
用1 μL的EZ-Tn5转座体电脉冲转化50 μL Xoc GX01感受态细胞,在含有50 μg/mL Rif和25 μg/mL Km的NA平板上筛选转化子,三次转化,平均转化效率为3.94×103 cfu/μg DNA。随机选取6个单菌落,提取总DNA并用Tn5F/Tn5R进行PCR验证。电泳结果如图4所示,突变体均扩增出目的片段,而Xoc GX01未扩增出目的片段(506 bp),表明电转化方法成功地将外源DNA导入Xoc GX01菌株中。
2讨论
水稻细菌性条斑病对水稻生产危害甚重,可造成高达40%的产量损失,已经成为我国南方稻区的主要病害(黄大辉等, 2008)。本研究从广西贺州莲塘镇细条病发病水稻上分离鉴定了一株水稻细菌性条斑病菌,命名为Xoc GX01菌株。广西贺州市位于广西、广东、湖南三省(区)结合部,该地区自古以来就是南岭地区稻米主要产区之一,也是农产品流通、种子交流的中心之一。该菌作为南岭稻区的水稻细菌性条斑病菌的代表,为研究区域水稻细条病发病规律、成灾机理、病原菌进化机理与分布规律提供材料。
本研究在表型鉴定和致病性检测的基础上,采用16S-23S rRNA ITS序列分析方法对病原分离物进行了快速鉴定。分离株16S-23S rRNA ITS序列与GenBank数据库中Xoc BLS256菌株16S-23S rRNA ITS序列完全一致,多重比较发现分离株16S-23S rRNA ITS与Xoo菌株的16S-23S rRNA ITS在有少量碱基差异。基于16S-23S rRNA ITS在序列和长度上的细微变异(Gürtler and Stanisich, 1996),确认本研究中的水稻条斑病分离株属于Xoc。该菌株胞外蛋白酶活性较高,而胞外淀粉酶与纤维素酶活性较低,与已报道的Xoc RS105类似(Zou et al., 2011)。
细菌遗传操作系统是基因克隆、基因功能鉴定和致病分子机理研究的关键。原核生物中广泛存在的限制修饰系统严格限制了外源DNA的入侵,给微生物遗传操作带来很大不便(Kobayashi, 2001; 吴神怡等, 2010)。大量的研究表明,细菌在接合效率和被转化效率方面差别很大,即使是同种细菌的不同菌株间差异也很大。例如,在植物病原细菌中,同一致病变种的不同菌株间,有的接合效率很高,有的几乎不能发生接合,妨碍了这些菌株的功能基因组学方面的研究(吴神怡等, 2010)。Xoc GX01菌株初步实验的接合效率2.3×10-4,电脉冲转化效率为3.94×103 cfu/μg DNA,表明Xoc GX01菌株能够高效地接受外源DNA。Xoc GX01菌株遗传操作系统的建立为进一步有效分离Xoc 的致病相关基因、阐明该菌的致病分子机理、发展防治该病发生的新药物、新方法奠定了基础。
3材料与方法
3.1实验材料
供试水稻品种日本晴(Oryza sativa L. ssp. japonica cv. Nipponbare),由广西大学生命科学与技术学院冯家勋教授课题组惠赠。
本研究使用的菌株和质粒列于表1。供试水稻细条病分离株由广西壮族自治区农业科学院植物保护研究所提供。该分离株是于2005年从广西壮族自治区贺州市莲塘镇水稻条斑病发病晚稻植株上采集并分离,保存于该所菌种库,保藏号为LT4。

表1 本研究中使用的菌株和质粒
大肠杆菌液体培养:LB培养基,37℃,200 r/min。固体培养基LA为LB中加入1.5% (W/V)琼脂。水稻细菌性条斑病菌液体培养:NB培养基(Zou et al., 2011),28℃,200 rpm。固体培养基NA为NB中加入1.5% (W/V)琼脂。
抗生素及用量:固体培养时,大肠杆菌和水稻细菌性条斑病菌均使用50 μg/mL利福平(Rif),25 μg/mL 卡那霉素(Km);对于四环素(Tc),大肠杆菌用量为15 μg/mL,水稻细菌性条斑病菌用量为5 μg/mL。液体培养时,抗生素用量减半。
3.2病原物分离纯化与表型鉴定
从试管斜面上挑取少量LT4菌体,用无菌水梯度稀释涂平板法纯化病原物。纯化后的病原物,用于表型鉴定,观察菌落形态和胞外水解酶活性鉴定。
将LT4接种到NB中,过夜培养。测定OD600吸光值,用 NB培养基稀释菌体浓度为OD600=0.2。分别取2 µL菌液接种于含1%脱脂牛奶、0.1%可溶性淀粉或0.5% (w/v)的羧甲基纤维素的NA平板上,在28℃培养箱中培养48 h。脱脂牛奶平板上可直接测量菌落周围透明圈(Tang et al., 1987)。可溶性淀粉平板,用比例为1:100的I2/KI液染色10 min,再用70%的乙醇冲洗,测量水解圈直径(Jiang et al., 2008)。羧甲基纤维素平板染色时先在平板中加入约20 mL 0.1%的刚果红溶液浸泡染色30 min,流水冲洗,再用20 mL 1 mmol/L的NaCl浸泡脱色20 min,测量水解圈直径。
利福平抗性突变菌株的筛选:挑取少量LT4菌体于NB培养基中摇床培养过夜,取200 μL过夜培养的菌液涂布在含有50 μg/mL利福平的NA平板上,28℃倒置培养3 d。重复上述操作直至在NA (Rif)平板上长出黄色菌落。挑取黄色菌落转接到含Rif的NB培养基中培养过夜,梯度稀释并涂布在NA (Rif)板上,长出的单菌落经鉴定为水稻细菌性条斑病菌,即为利福平抗性菌株。
3.3致病性检测
选取处于分蘖期的水稻植株用于试验,试验前一天将水稻露天盆栽场地移至28℃培养室中以适应环境。Xoc供试菌株接种于NA培养基上培养48 h后,用无菌牙签尖头粘取少许菌体转接至10 mL的含25 μg/mL利福平的NB培养基中,28℃,200 r/min,摇床培养过夜。次日,用NB培养基将菌液稀释至约108 cfu/mL (OD600≈0.2),选择水稻第2、第3片叶,用改良的针刺接种法接种。用灭菌的注射器吸取稀释菌液,推出一滴菌液粘在针头外壁上,针头再从水稻(日本晴)叶片穿过(确保水稻叶片完整),每片叶以叶中脉为分界线,刺平行的两个点。菌液滴在叶片穿刺处稍作停留以便菌液通过穿刺的伤口进入叶片。与岑贞陆等(2007)方法相比,该方法不再用棉花或海绵衬垫叶背,减少了操作难度和污染的机会。以NB培养基为空白对照,重复三组,每组6~8片叶。接种后,保湿、保温28℃,弱光照24 h。然后转为正常光照,10 d后观察病斑长度。
3.4 16S-23S rDNA ITS序列扩增与分子鉴定
细菌总DNA的小量快速提取按照Chen等的方法(Chen and Kuo, 1993)。质粒DNA的碱裂解法提取,限制酶酶切、DNA 的连接转化按Sambrook等方法(Sambrook and Russell, 2001)。限制酶、T4 DNA连接酶购自Promega公司(中国上海),Ex Taq DNA 聚合酶购自TaKaRa公司(中国大连)。
以LT4总DNA为模板,以细菌16S-23S rDNA ITS序列的通用引物AW39056 (AGTCGTAACAAGGTAGCCGT)和AW39057(GTGCCAAGGCATCCACC)为引物,用Ex Taq DNA 聚合酶,在PCR仪上,先95℃变性3 min,再以95℃ 35 s、55℃ 35 s、72℃ 1 min扩增,循环30次。PCR产物由深圳华大基因科技有限公司测序。
采用使用工具Clustal X和Phylip软件对16S-23S rDNA ITS序列进行分析作图,邻位相接法建树,自展值(bootstrap)次数为1 000次。
3.5细菌三亲本接合
分别将供体菌(一般为含重组质粒pL3A2641的E. coli)、帮助菌(ED8767/pRK2073)在LB中过夜培养,受体菌(Xoc)在NB中培养16~20 h至OD600=0.8~1.0。在它们菌体浓度基本一致的前体下,离心收集1.4 mL受体菌,用生理盐水洗两次,再用少量NB悬浮。同时,分别离心收集1.4 mL供体菌、0.7 mL帮助菌,用NB洗一次,再用少量NB悬浮。最后将三者混合在一个EP管中,离心,去掉上清,仅留下极少量NB重悬。最后用移液器将已充分混匀的菌泥转移到放有硝酸纤维素膜的NA平板(不含任何抗生素)上。菌体吸附在膜上后,于32℃,倒置培养2 d,细菌进行三亲接合。接合完成后,将硝酸纤维素膜小片转移至含400 μL NB的EP管中,10 000 r/min离心30 s,将菌体从滤膜上洗脱,将菌体稀释成几个浓度梯度后,约每个平板200 μL涂布于NA (Rif)平板和NA (Rif+Tc)平板,于28℃,3 d培养。NA (Rif+Tc)平板上获得的单菌落,经PCR验证后,确认接合子。统计NA (Rif)平板和NA (Rif+Tc)平板上的菌落总数,计算NA (Rif+Tc)平板上和NA (Rif)平板上菌落数比值,得到三亲接合效率。三亲接合子验证PCR引物分别为A-2641F (GAATTCCTCGGCAAGGTCGGCGGGATGTT)和A-2641R (GAATTCAGGCGACGCCTTCACATCCCGGT)。
3.6电转化方法
将Xoc GX01过夜培养后按10%接种量接种到三角瓶中继续培养8 h,然后冰上预冷30 min (之后均低温操作),分装到50 mL离心管中,4 000 rpm,2℃,离心10 min收集菌体。弃上清,加预冷dd H2O洗涤(用振荡器充分振荡混匀),4 000 r/min,2℃,离心10 min。重复洗涤步骤两次,再用10%预冷甘油按上述方法洗涤3次,用10%甘油重悬菌体,制好的感受态细胞按每管50 μL的体积分装,-80℃保存。电转化时,将1 μL的EZ-Tn5转座酶加入到50 μL感受态细胞中,BIO-RAD电脉冲仪上2.7 kV电压进行电击转化。NB培养基中预培养1 h后稀释涂布在含有50 μg/mL Rif和25 μg/mL Km的NA平板上,挑取转化子菌落转移培养,稳定培养后,根据其转化子数,计算此次电转化的转化效率。
转化效率(cfu/μg DNA)=克隆数(cfu)/DNA量(ng)×103。转化子验证PCR引物分别为:Tn5F (GCAGTGTTCCTGCGCCGGT)和Tn5R (CCGCCGTCCCGTCAAGTCA)。
作者贡献
肖永胜和吴玥负责16S-23S rDNA序列扩增及测序结果分析。韦雪雪和郜惠苹进行了病原菌的表型分析、致病检测等,并参与论文写作。牛祥娜构建了进化树、设计了PCR引物。岑贞陆从田间分离菌株。肖永胜和黄萍建立了遗传操作系统。汪嵘负责菌株培养和保存。何勇强为本研究的项目负责人、通讯作者。
致谢
感谢国家自然科学基金项目(30870071)、教育部高校博士点基金(0094501110001)和微生物及植物遗传工程教育部重点实验室开放课题(J0703)对本研究的资助。本研究得到亚热带农业生物资源保护与利用国家重点实验室和微生物及植物遗传工程教育部重点实验室的支持,特此致谢!感谢两位匿名的同行评审人的评审意见和修改建议。
参考文献
Ceng Z.L., Huang S.L., Li R.B., Li W.M., Qin L.P., Xie L., Hu C.J., Li X.Y., and Fu G., 2007, Identification of resistance of rice materials to bacterial leaf streak, Anhui Nongye Kexue (Journal of Anhui Agriculteral Science), 35(22): 6850-6851, 6853 (岑贞陆, 黄思良, 李容柏, 李卫民, 覃丽萍, 谢玲, 胡春锦, 李小勇, 付岗, 2007, 稻种材料抗细菌性条斑病性鉴定, 安徽农业科学, 35(22): 6850-6851, 6853)
Chen W.P., and Kuo T.T., 1993, A simple and rapid method for the preparation of gram-negative bacterial genomic DNA, Nucleic Acids Res, 21(9): 2260
http://dx.doi.org/10.1093/nar/21.9.2260 PMid:8502576 PMCid:309503
Fang Z.D., Ren X.Z., Chen T.Y., Zhu Y.G., Fan H.Z., and Wu S.Z., 1957, A comparison of the rice bacterial leaf blight organism with the bacterial leaf streak organism of rice and Leersia hexandra Swartz, Zhiwu Bingli Xuebao (Acta Phytopathologica Sinica), 3(2): 99-124 (方中达, 任欣正, 陈泰英, 朱有釭, 范怀忠, 伍尚忠, 1957, 水稻白叶枯病及条斑病和李氏禾条斑病病原细菌的比较研究, 植物病理学报, 3(2): 99-124)
Gürtler V., and Stanisich V.A., 1996, New approaches to typing and identification of bacteria using the 16S-23S rDNA spacer region, Microbiology, 142(1): 3-16 http://dx.doi.org/10.1099/13500872-142-1-3 PMid:8581168
He W.A., Huang D.H., Liu C., Cen Z.L., Zhang Y.X., Ma Z.F., Chen Y.Z., Lu S.N., Liu K.Y., Wu B., and Li R.B., 2010, Inheritance of resistance to bacteria leaf streak in four accessions of common wild rice (Oryza rufipogon Griff.), Zhiwu Bingli Xuebao (Acta Phytopathologica Sinica), 40(2): 180-185 (贺文爱, 黄大辉, 刘驰, 岑贞陆, 张月雄, 马增风, 陈英之, 卢双楠, 刘开勇, 武波, 李容柏, 2010, 普通野生稻抗源对细菌性条斑病的抗性遗传分析, 植物病理学报, 40(2): 180-185)
Huang D.H., Cen Z.L., Liu C., He W.A., Chen Y.Z., Ma Z.F., Yang L., Wei S.L., Liu Y.L., Huang S.L., Yang X.Q., and Li R.B., 2008, Identification and genetic analysis of resistance to bacterial leaf streak in wild rice, Zhiwu Yichuan Ziyuan Xuebao (Journal of Plant Genetic Resources), 9(1): 11-14 (黄大辉, 岑贞陆, 刘驰, 贺文爱, 陈英之, 马增凤, 杨朗, 韦绍丽, 刘亚利,, 黄思良, 杨新庆, 李容柏, 2008, 野生稻细菌性条斑病抗性资源筛选及遗传分析, 植物遗传资源学报, 9(1): 11-14)
Ji G.H., Xu Z.G., and Zhang S.G., 2002, Preliminary analysis of genetic diversity of Xanthomonas oryzae pv. oryzicola and Xanthomonas leersiae strains in China by Rep-PCR, Zhiwu Binli Xuebao (Acta Phytopathologica Sinica), 32(1): 26-31 (姬广海, 许志刚, 张世珖, 2002, Rep-PCR技术对中国水稻条斑病菌的遗传多样性初析, 植物病理学报, 32(1): 26-31)
Jiang B.L., Liu J., Chen L.F., Ge Y.Y., Hang X.H., He Y.Q., Tang D.J., Lu G.T., and Tang J.L., 2008, DsbB is required for the pathogenesis process of Xanthomonas campestris pv. campestris, Molecular Plant-Microbe Interactions, 21(8): 1036-1045 http://dx.doi.org/10.1094/MPMI-21-8-1036 PMid:18616400
Kobayashi I., 2001, Behavior of restriction-modification systems as selfish mobile elements and their impact on genome evolution, Nucleic Acids Research, 29(18): 3742-3756 http://dx.doi.org/10.1093/nar/29.18.3742 PMid:11557807 PMCid:55917
Niño-Liu D.O., Ronald P.C., and Bogdanove A.J., 2006, Xanthomonas oryzae pathovars: Model pathogens of a model crop, Molecular Plant Pathology, 7(5): 303-324 http://dx.doi.org/10.1111/j.1364-3703.2006.00344.x PMid:20507449
Qian W., Jia Y., Ren S.X., He Y.Q., Feng J.X., Lu L.F., Sun Q., Ying G., Tang D.J., Tang H., Wu W., Hao P., Wang L., Jiang B.L., Zeng S., Gu W.Y., Lu G., Rong L., Tian Y., Yao Z., Fu G., Chen B., Fang R., Qiang B., Chen Z., Zhao G.P., Tang J.L., and He C., 2005, Comparative and functional genomic analyses of the pathogenicity of phytopathogen Xanthomonas campestris pv. campestris, Genome Research, 15(6): 757-767 http://dx.doi.org/10.1101/gr.3378705 PMid:15899963 PMCid:1142466
Sambrook J., and Russell D.W., eds., 2001, Molecular cloning: A laboratory manual, Cold Spring Harbor Labor Laboratory Press, Cold Spring Harbor, New York, USA, pp.84-87
Tang J.L., Gough C.L., Barber C.E., Dow J.M., and Daniels M.J., 1987, Molecular cloning of protease gene(s) from Xanthomonas campestris pv. campestris: Expression in Escherichia coli and role in pathogenicity, Molecular General Genetics, 210(3): 443-448 http://dx.doi.org/10.1007/BF00327195
Wu S.Y., Liu S.Y., Liu J.L., Duan C.J., and Feng J.X., 2010, Isolation and identification of a Xanthomonas oryzae pv. oryzae strain capable of efficiently accepting exogenous plasmid by conjugation, Guangxi Nongye Kexue (Guangxi Agricultural Sciences), 41(9): 873-876 (吴神怡, 刘书言, 刘君梁, 段承杰, 冯家勋, 2010, 一株能通过接合导入外源质粒的水稻黄单胞菌水稻致病变种菌株的获得及鉴定, 广西农业科学, 41(9): 873-876)
Zou H.S., Yuan L., Guo W., Li Y.R., Che Y.Z., Zou L.F., and Chen G.Y., 2011, Construction of a Tn5-tagged mutant library of Xanthomonas oryzae pv. oryzicola as an invaluable resource for functional genomics, Current Microbiology, 62(3): 908-916 http://dx.doi.org/10.1007/s00284-010-9804-1 PMid:21046389