 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2010 年, 第 29 卷, 第 2 篇 doi: 10.5376/gab.cn.2010.29.0002
收稿日期: 2010年08月24日 接受日期: 2010年10月09日 发表日期: 2010年10月11日
赵小兰和彭昌操, 2010, DUALmembrane系统——一种膜蛋白质互作的研究方法, 基因组学与应用生物学(Online) Vol.29 No.2 (doi: 10.5376/gab.cn.2010.29.0002)
DUALmembrane 系统是近几年才发展起来的一种酵母双杂交方法。它是基于分离的泛素介导的膜蛋白酵母双杂交系统,主要针对定位于细胞膜上或膜粘连蛋白间的相互作用而开展工作。该系统已成功应用于膜互作蛋白的文库筛选,如检测到B细胞受体相关蛋白(BAP31)的互作蛋白-类B家族的酪氨酸磷酸酶(PTPLB),同时也成功应用于蔗糖转运蛋白同源或异源寡聚体的形成的检测。本文系统介绍了该系统工作的原理、主要特点以及存在的问题,以期为膜蛋白功能的研究提供参考。
体内蛋白-蛋白相互作用分析是了解细胞内蛋白质的功能是重要手段。蛋白质间相互作用的系统综合分析为蛋白质的结构和功能的研究提供了大量的信息。在研究蛋白-蛋白相互作用的实验技术方面,酵母双杂交技术是目前最经典的方法,它具有简便、灵敏和高效的特点(Fields and Song, 1989)。酵母双杂交技术是利用酵母遗传学方法在真核细胞体内研究蛋白质之间相互作用的非常有效的分子生物学技术,在验证已知蛋白质之间的相互作用或筛选与靶蛋白特异作用的目标蛋白的研究中已被广泛的得到证实。但是,传统的酵母双杂交系统仅限于可溶性蛋白或膜蛋白的可溶区的互作分析,不能进行膜蛋白的研究。本文介绍最近几年才发展起来的DUALmembrane系统(DUALmembrane system),该系统首先由瑞士的Dualsystems Biotech AG公司开发出来,是基于分离的泛素(split-ubiquitin)介导的膜蛋白酵母双杂交系统,它提供了不同于常规酵母双杂交系统的蛋白体内分析方法,使得分析膜蛋白间的互作成为现实(Stagljar et al., 1998)。因此,其主要特点是可以进行膜蛋白-膜蛋白、膜蛋白-可溶性蛋白间的互作研究。它既可以用于表达文库的筛选,也可以应用于2个已知蛋白(其中一个属膜蛋白)间互作关系的验证。该系统已成功应用于膜互作蛋白的文库筛选,如检测到B细胞受体相关蛋白(BAP31)的互作蛋白-类B家族的酪氨酸磷酸酶(PTPLB) (Wang et al., 2004),同时也成功应用于蔗糖转运蛋白同源或异源寡聚体的形成的检测(Reinders et al., 2002b)。总体来看,由于该系统建立的时间不长,研究成果多集中于医学领域诸如抗肿瘤药物的靶分子研究(Matsuda et al., 2005; Vitale et al., 2004; Wang et al., 2004),在植物研究方面也取得了一些研究成果(Fan et al., 2009; Reinders等, 2002a; 2002b; Stagljar et al., 1998; Stagljar and Heesen, 2000)。
1 DUALmembrane系统工作原理
该系统由分离的泛素(split-ubiquitin)介导蛋白互作信号的识别。泛素是一种含76个氨基酸的保守蛋白,它经常作为降解信号连接在蛋白质的N端。泛素能被其特异性的蛋白酶(ubiquitin-specific proteases, UBPs)识别并从所连接的蛋白上切割下来,切割位点总是位于泛素蛋白的C端。在酵母细胞中,泛素可以分成两部分分别表达,即其N端部分(NubI, 第1~34位氨基酸)和C端部分(Cub, 第35~76位氨基酸),后者融合有能启动核内报告基因表达的LexA蛋白(Stagljar et al., 1998)。NubI和Cub-LexA在细胞中组成可分离的泛素蛋白([NubI: Cub]-reporter)体系。值得注意的是,野生型NubI与Cub具有高亲和力并能自发重组形成异源二聚体。当野生型NubI 的第13位异亮氨酸被丙氨酸或甘氨酸取代后,NubG与Cub之间的亲和力降低。于是NubG与Cub-LexA之间只有依靠蛋白互作而连接起来,两个互作蛋白分别与NubG和Cub-LexA融合。这样,通过检测转录因子LexA的切割就可以检测2个蛋白之间的互作关系,该系统工作原理示意图如图1。当位于细胞内质网膜上的两个蛋白发生相互作用时,分别融合于其氨基酸C端的泛素蛋白前半部分(Cub)和后半部分(NubG)因距离靠近而形成一个完整的泛素蛋白分子,于是诱导UBPs识别并于其C端进行剪切,从而释放出转录因子LexA,最终启动核报告基因(HIS3 和lacZ)的转录。HIS3 作为营养缺陷型选择标记,而lacZ 转录后的β-Gal活性则作为阳性克隆的主要选择性标记。VP16作为诱饵融合蛋白的识别标签用于融合蛋白的表达和定位检测(Schulze et al., 2003)。
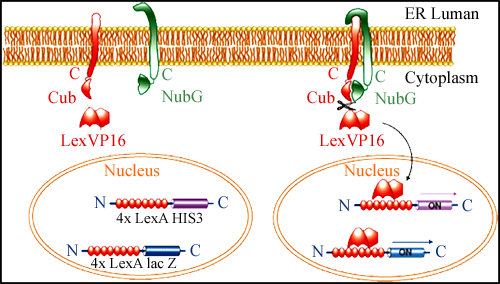 图1 DUALmembrane系统工作原理图(摘自www.dualsystems.com) |
2 DUALmembrane系统的特点
同可溶性蛋白质的酵母双杂交系统相比,膜蛋白酵母双杂交系统的技术体系(DUALmembrane系统)和实现步骤相对比较复杂。这主要体现在诱饵(bait)蛋白的表达需要在细胞膜上准确定位,也就是说与诱饵蛋白融合的Cub-TF必须位于在细胞膜内,这样才能实现UBP的识别和剪切功能。该系统分为两种类型,一种是诱饵蛋白的C端在胞质内,另一种是是诱饵蛋白的C端在胞质外(或者位于内质网、高尔基体等细胞器的腔内) (Stagljaret al., 1998)。无论那种类型,Cub-TF融合蛋白必须位于胞质内才能启动下游反应。前者的Cub-TF被融合于诱饵蛋白的C端,而后者Cub-TF被融合于诱饵蛋白的N端。与此同时,猎物(prey)蛋白的氨基酸C端也必须在胞质中或者至少保证其下游的NubG能与诱饵端的Cub部分具有互作的物理空间。在此基础之上,NubG与Cub融合之后UBPs的识别和剪切步骤也很重要,它是释放转录因子(TF) LexA并启动报告基因表达的前提。总体来说,DUALmembrane系统具有以下优点:(1)在体内原位检测蛋白-蛋白间的相互作用而无需核定位信号;(2)使用小的泛素结构域(NubG/Cub)使得相互作用蛋白质之间的空间位阻最小化。(3)蛋白间的互作信号靠泛素特异性结合蛋白(UBPs)剪切人工转录因子(LexA)启动,而不是靠转录,因此可以检测蛋白自身的转录激活或抑制序列。(4)此体系可以用来研究两个膜蛋白的相互作用和一个膜蛋白与一个胞质蛋白的相互作用。(5)任何一种膜蛋白都可以作为诱饵,能使与待检测蛋白融合的相互作用模块(Cub-PLV-NubG)定位在细胞质内(Stagljar et al., 1998; Reinders et al., 2002b)。
3应用情况
在两个已知膜蛋白互作关系的鉴定方面,DUALmembrane系统已经成功地应用于膜蛋白相互作用的检测。Stagljar等(1998)利用啤酒酵母寡糖转移酶膜蛋白Wbp1p和Ost1p证明了Split Ubiquitin System可以检测到两个蛋白间的相互作用。随后,Yan等(2005)利用该系统证实了酵母寡糖转移酶亚基Ost2p、Ost3p、Ost5p 和 Ost6p均能发生互作而形成功能复合体。此外,DUALmembrane系统还可以检测到Gcn4p蛋白拉链区的体内特异性同源互作(Johnsson 和Varshavsky, 1994), 这为研究蛋白质分子内互作开辟了道路。在此基础上,Reinders等(2002b)曾经用该检测了蔗糖转运蛋白形成同源或异源寡聚体的可能性,结果显示SUT1和SUT2都能形成同源寡聚体,且SUT1、SUT2和SUT4之间能形成异源寡聚体,而作为对照的质膜蛋白如K+通道蛋白和单糖转运蛋白则不能与SUTs发生互作。这一结果进一步被分别表达的两个蔗糖转运蛋白半区的功能重组分析实验所证实(Reinders et al., 2002a)。另外实验还发现所检测的蛋白质互作是特异性的。
除此之外,DUALmembrane系统在筛选文库方面也获得了一些成果。已经通过筛选表达文库得到与预定靶膜蛋白结合的蛋白质(Matsuda et al., 2005; Vitale and Buxbaum, 2004)。Wang等(2004)利用此系统成功筛选出BAP31蛋白的互作蛋白-类B家族的酪氨酸磷酸酶(PTPLB),后者是代替调节蛋白酶降解系统的开关。最近,Miller等(2005)用高通量的DUALmembrane系统蛋白质芯片技术对涉及536种膜蛋白的1985对可能互作因子进行了筛选,结果发现高可信度互作因子131对,次高可信度互作因子209对,中等可信度互作因子468对,低可信度互作因子1 085对。这说明DUALmembrane系统已经渗透到蛋白质组学的研究领域。令人遗憾的是,在文库筛选方面DUALmembrane系统所应用的对象多为动物(包括人)或者酵母,而应用于植物上的这方面的研究至今还鲜见报道。最近,我们采用DUALmembrane系统以苹果蔗糖转运蛋白和苹果山梨醇转运蛋白为诱饵筛选苹果果实cDNA 表达文库,获得苹果蔗糖转运蛋白和苹果山梨醇转运蛋白共同的互作因子——苹果细胞色素b5蛋白, 糖转运蛋白——细胞色素b5复合体的结合程度调节糖的转运效率(Fan et al., 2009),同时还筛选到苹果液泡膜H+-ATP酶等互作因子(未发表资料)。
4存在问题
同所有酵母双杂交系统一样,膜蛋白酵母双杂交系统也存在缺陷,主要表现在以下几个方面:(1)使用方法上的局限性。该系统所研究的蛋白质融合表达的Cub端必须定位于胞质内,才能激活报告基因的表达。因此,并非所有的膜蛋白都适用该系统,比如那些N、C端同时在细胞质膜外侧或内质网腔内的蛋白质则不适用于这种方法(Stagljar et al., 1998)。(2)实验结果的假阳性。即通过酵母双杂交实验所筛选到的蛋白质互作因子在细胞内不一定是真实发生的。这是酵母双杂交技术普遍存在的现象。据统计,在已筛选出的约八万种蛋白质相互作用中,只有2 400种相互作用得到了多于一种方法的确认(Auerbach et al., 2003),验证成功率只有3%左右。因此,在酵母双杂交系统的应用中必须考虑产生假阳性的因素。该系统筛选表达文库产生假阳性的途径可能来自两个方面,其一是表达的诱饵(bait)融合蛋白和空猎物(prey)载体(NubG)结合启动下游的转录;其二是表达的诱饵(bait)融合蛋白和任意的猎物(prey)载体(NubG)结合启动下游的转录。一般情况下,前者的可能性比较小,因为空猎物(prey)载体在没有目标蛋白基因插入的情况下其下游的NubG不能正常表达,实验中可用阴性对照加以排除,或者使用3-AT (3-Aminotriazole, 3-氨基三唑)作为竞争抑制剂将本底控制在可接受水平。后者则需要结合阳性对照和3-AT的使用来降低干扰背景。双筛选系统和假阳性显示分析法可基本消除这两种情况下的假阳性。当然,要获得更加确切的信息还需要结合免疫共沉淀、双分子荧光标记互补法等实验结果加以分析。(3)实验结果的假阴性。有些融合蛋白表达后会对酵母细胞产生毒性,从而抑制系统下游报告基因(如-his, lacZ)的表达或影响酵母细胞的正常生长,甚至碰到蛋白间相互作用较弱的情况,使得报告基因不表达或表达程度低而检测不到信号,这些原因都可以导致酵母双杂交呈现假阴性的实验结果(Stagljar and Fields, 2002)。所以,目的蛋白的正确翻译与定位是该系统正常运转的前提,考虑到膜蛋白表达的困难性,该系统采用了不同类型的启动子来诱导蛋白质的表达,实验中可根据目的蛋白的性质灵活选择。由于DUALmembrane系统是近几年才发展起来的酵母双杂交衍生体系,应用范围还不是很广,实验结果积累不够充分,因此其文库筛选效率还有待于更进一步的实验证实。
在研究蔗糖转运蛋白(典型的膜蛋白)的过程中,有人注意到泛素蛋白结构域的存在可能对转运蛋白存在空间位阻,因而某种程度上改变了后者的动力学属性(Stagljar et al., 1998)。这让人们担心因为泛素的存在影响蛋白属性从而影响蛋白质相互作用的真实性。事实上,功能互补和蔗糖转运实验证实了泛素的存在不会影响到转运蛋白的蔗糖转运功能,也就是说泛素与目标蛋白的融合并不影响蛋白的互作功能。因为酵母蔗糖转运蛋白的功能重组与复合体内的泛素蛋白部分的稳定性并无关系,因为去掉泛素蛋白的两部分后,蔗糖转运蛋白的两个半区仍然能形成有功能的转运蛋白(Reinders et al., 2002a; 2002b)。另外,还有实验证据表明乳糖透性酶第七和第十个跨膜区内的Asp237和Lys358之间的盐桥辅助转运蛋白C端半区插入膜内(Dunten et al., 1993)。不过,盐桥对N端半区和C端半区的结合不起作用。当这两个氨基酸残基被无电荷残基取代时,对乳糖透性酶的转运活性仅有较小的影响。这就是说,盐桥的形成对蛋白质间的互作影响较小。尽管从部分的实验结果看,泛素和盐桥的存在对膜蛋白质间互作所形成的影响可能可以忽略或根本不存在,但从理论上讲,泛素蛋白有可能影响到与之融合的膜蛋白的功能,加上蛋白的不同跨膜区之间还可能形成盐桥而影响蛋白的构象变化等等。鉴于此,同其它任何一种双杂交系统一样,使用DUALmembrane系统筛选的互作蛋白结果还必需有其它体内或体外并列的实验证据作为补充才能充分地说明问题。
5展望
膜蛋白酵母双杂交技术DUALmembrane系统问世十余年来,已经在蛋白质之间的相互作用研究、筛选新的多肽药物以及基因和蛋白质的功能等研究方面发挥了重要作用。诸如蔗糖转运蛋白(具有12个跨膜结构域的典型膜蛋白)的膜整合或膜结合蛋白在植物光合产物的运输、生长与发育过程中扮演着重要的角色,我们有望通过膜蛋白酵母双杂交技术筛选到更多的蛋白互作因子,解释膜蛋白的作用位点在哪里、蛋白及其亚基的构象如何等理论性问题,为阐明膜蛋白的功能以及揭示膜蛋白在细胞信号转导过程中的作用开辟道路。随着该系统在生物学各个研究领域中不断深入地应用,生物体内膜蛋白之间纷繁复杂的作用关系将进一步的揭示出来。DUALmembrane系统及其相关技术将在细胞周期调控、细胞信号转导和药物靶基因筛选等领域的研究中将发挥越来越重要的作用。可以预见,在包括植物在内的更多生物体基因组测序完成后,DUALmembrane系统将在功能基因组学和蛋白质组学的研究领域尤其是靶蛋白的筛选中成为一种有效的研究手段。
致谢
本研究由国家自然科学基金(30771759; 30972388)、广东省自然科学基金团队项目(9351064201000002)和广东省自然科学基金重点项目(7118121)共同资助
参考文献
Auerbach D., Fetchko M., and Stagljar I., 2003, Proteomic approaches for generating comprehensive protein interaction maps, TARGETS, 2(3): 85 - 92 doi:10.1016/S1477-3627(03)02316-X
Dunten R.L., Sahin-Toth M., and Kaback H.R., 1993, Role of the charge pair aspartic acid-237-lysine-358 in the lactose permease of Escherichia coli., Biochem., 32: 3139-3145 doi:10.1021/bi00063a028 PMid:8457574
Fan R.C, Peng C.C., Xu Y.H., Wang X.F., Li Y., Shang Y., Du S.Y., Zhao R., Zhang X.Y., Zhang L.Y., and Zhang D.P., 2009, Apple sucrose transporter sut1 and sorbitol transporter sot6 interact with cytochrome b5 to regulate their affinity for substrate sugars. Plant Physiol., 150: 1880-1901 doi:10.1104/pp.109.141374 PMid:19502355 PMCid:2719124
Fields S., and Song O., 1989, A novel genetic systemto detect protein-protein interactions. Nature, 340 (6230): 245 - 246 doi:10.1038/340245a0 PMid:2547163
Johnsson N., and Varshavsky A., 1994, Split ubiquitin as a sensor of protein interactions in vivo, Proc. Natl. Acad. Sci., USA, 91: 10340-10344 doi:10.1073/pnas.91.22.10340
Matsuda S., Giliberto L., Matsuda Y., Davies P., McGowan E., Pickford F., Ghiso J., Frangione B., and D’Adamio L., 2005, The familial dementia BRI2 gene binds the Alzheimer's gene APP and inhibits Abeta production. J. Biol. Chem., 280: 28912-28916 doi:10.1074/jbc.C500217200 PMid:15983050
Miller J.P., Lo R.S., Ben-Hur A., Desmarais C., Stagljar I., Noble W.S., and Fields S., 2005, Large-scale identification of yeast integral membrane protein interactions. Proc. Natl. Acad. Sci., USA, 102: 1212-1218 doi:10.1073/pnas.0505482102 PMid:16093310 PMCid:1189342
Reinders A., Schulze W., Kühn C., Barke L., Schulz A., Ward J.M., and Frommer W.B., 2002b, Protein–protein interactions between sucrose transporters of different affinities colocalized in the same enucleate sieve element. Plant Cell, 14: 1567-1577 doi:10.1105/tpc.002428 PMCid:150707
Reinders A., Schulze W., Thaminy S., Stagljar I., Frommer W.B., and Ward J.M., 2002a, Intra- and intermolecular interactions in sucrose transporters at the plasma membrane detected by the split-ubiquitin system and functional assays. Structure, 10: 763~772 doi:10.1016/S0969-2126(02)00773-6
Schulze, 2003, Interactions between co-expressed Arabidopsis sucrose transporters in the split-ubiquitin system. BMC Biochemistry, 4, (3):1~10
Stagljar I. and Fields S., 2002, Analysis of membrane protein interactions using yeast-based technologies. TRENDS in Biochemical Sciences, 27, (11):559~563 doi:10.1016/S0968-0004(02)02197-7
Stagljar I., and Heesen S., 2000, Detecting interactions between membrane proteins in vivo using chimeras. Methods Enzymol., 327: 190–198 doi:10.1016/S0076-6879(00)27276-5
Stagljar I., Korostensky C., Johnsson N., and te Heesen S., 1998, A new genetic system based on split-ubiquitin for the analysis of interactions between membrane proteins in vivo. Proc. Natl. Acad. Sci., USA, 95: 5187-5192 doi:10.1073/pnas.95.9.5187
Vitale R., and Buxbaum J.D., 2004, Use of the split-ubiquitin two-hybrid system to identify proteins interacting with the Alzheimer proteins APP and LRP. Biol. Bull., 207:167
Wang B., Pelletier J., Massaad M.J., Herscovics A., and Shore G.C., 2004, The yeast split-ubiquitin membrane protein two-hybrid screen identifies BAP31 as a regulator of the turnover of endoplasmic reticulumassociated protein tyrosine phosphatase-like B. Mol. Cell Biol., 24: 2767-2778 doi:10.1128/MCB.24.7.2767-2778.2004 PMid:15024066 PMCid:371098
Yan A., Wu E., and Lennarz W.J., 2005, Studies of yeast oligosaccharyl transferase subunits using the split-ubiquitin system: topological features and in vivo interactions. Proc. Natl. Acad. Sci., USA, 102: 7121-7126 doi:10.1073/pnas.0502669102 PMid:15886282 PMCid:1129144