2陕西延长石油集团公司科技部, 西安, 710069
 作者
作者  通讯作者
通讯作者
基因组学与生物技术, 2012 年, 第 1 卷, 第 8 篇 doi: 10.5376/gb.cn.2012.01.0008
收稿日期: 2012年07月11日 接受日期: 2012年09月21日 发表日期: 2012年12月24日
引用格式(中文):
赵鑫等, 2012, 铜绿假单胞菌生物降解特性的研究进展, 基因组学与生物技术(online) Vol.1 No.8 pp.45-53 (doi: 10.5376/gb.cn.2012.01.0008)
引用格式(英文):
Zhao et al., 2012, Progress on Biodegradating Characteristic of Pseudomonas aeruginosa, Jiyinzuxue Yu Shengwu Jishu (online) Vol.1 No.8 pp.45-53 (doi: 10.5376/gb.cn.2012.01.0008)
近年来在环境污染物的生物降解研究方面有了很大进展。铜绿假单胞菌(Pseudomonas aeruginosa, PA)作为重要的降解菌株之一,具有较强的降解能力,可降解物质种类广泛,在环境污染物的生物降解中具有重要作用并占据重要地位。本文综述了PA的降解特性、代谢途径、遗传基础与酶系及促降解物质在生物降解方面的研究进展。
随着环境污染问题日益严重,人类试图寻求一种经济有效的治理环境污染的策略。生物降解具有低成本、效果佳、无二次污染等优势,受到全世界的广泛关注。微生物因分布广泛并具有降解各种环境污染物的能力而成为生物修复的最佳选择。微生物在降解有机污染物时会受到多种因素的影响,而通过研究生物降解的代谢途径、代谢机制以及相关的代谢酶,可以有效发现影响生物降解的重要因素(Seo et al., 2011)。
铜绿假单胞菌(Pseudomonas aeruginosa, PA)是假单胞菌属的代表菌株,革兰氏阴性菌,主要分布于各种废水污泥环境中,多属专性好氧、好能营养型。PA的营养要求简单,大部分菌种在不含维生素、氨基酸的合成培养基中仍能良好生长,对环境适应能力强,且其降解能力和范围较强,此外,PA自身可产生促降解物质,因此,其具有良好的应用前景(Arino et al., 1998)。研究者已从不同环境污染地区分离的PA菌种可以降解多种不同化合物,如氯化联苯(Hatamian-Zarmi et al., 2009)、苯酚(Afzal et al., 2007)、硝基酚(刘和等, 2004; Zheng et al., 2009)、多环芳烃、正构烷烃(Zhang et al., 2011)等,因此,PA在环境微生物学领域受到越来越多的关注。
本文总结了国内外对PA生物降解方面的一些研究工作,同时结合作者所在实验室前期的研究工作(张丹, 2010; 李兆格, 2011),就PA对各种不同环境污染物的降解特性与代谢途径、其自身在生物降解方面的遗传基础与酶系和PA分泌的相关促降解物质的研究进展进行综述,并对当前PA生物降解研究工作中的一些问题和发展方向进行了讨论,以期为PA生物降解研究工作提供参考。
1 PA对不同物质的降解特性
1.1 PA对正构烷烃的降解特性
正构烷烃是原油的重要组成部分,近年来原油污染问题已威胁到人类和其他生物的生存和发展。Zhang等(2011)发现铜绿假单胞菌DQ8可以正构烷烃为唯一碳源和能源进行生长和代谢,2 d内将 100 mg/L的正四十烷烃降解到6 mg/L,4 d内完全降解。同时发现碳链越长降解速率越低,这可能是因为其具有更高的分子量和疏水性。Das和Mukherjee (2007)分离到铜绿假单胞菌M和NM、M和NM菌株可将原油中47.0 g/kg的正构烷烃经60 d降解为24.0 g/kg,120 d后剩余9.0 g/kg,同时还发现培养基质的pH对M和NM菌株生长的影响很小。与环烷烃和芳香烃相比,PA在原油中会优先降解正构烷烃(C14-C30),且具有更高的降解效率,这可能是因为正构烷烃结构简单、降解步骤少以及参与降解的相关酶量多等原因导致的。
1.2 PA对单苯环物质的降解特性
1.2.1 PA对苯酚类物质的降解特性
对氯苯酚和硝基酚都是苯酚的衍生物,这三种物质因其本身含有芳环结构、氯原子或硝基,使得其具有很强的毒性和抗生物降解能力。Afzal等(2007)对两株苯酚降解菌进行初试降解浓度、降解效率、化学耗氧量(COD)以及生化需氧量(BOD)的比较,结果PA均优于另一株惠特莫尔氏杆菌(P. pseudomallei),可有效降解苯酚,高盐环境对PA降解影响很小,PA最大利用苯酚浓度为2 600 mg/L,生长速率为0.016/h,苯酚降解速率为26.16 mg•L-1•h-1,苯酚的浓度(<1 000 mg/L)较低时,几乎对PA的生长和降解作用没有延迟作用。刘和等(2004)从农药厂二沉池污泥中分离到铜绿假单胞菌ZD4-3,该菌可高效降解苯酚,但最终不能将其完全矿化。
对氯苯酚的氯原子的p电子和苯环上的π电子可形成稳定的共价键结构,此外,氯原子还可抑制苯环裂解酶的活性,增加了其抗生物降解能力,因此氯取代基的去除是其最重要的限速步骤。李晓菊等(2010)对一株对氯苯酚降解菌—铜绿假单胞菌TBPY进行了驯化,经过4次驯化后可以将100 mg/L的对氯苯酚在2 d内完全降解,但驯化前后菌体形态发生很大变化。该菌的优化降解条件为温度30℃、培养基初始条件为 pH7.5、接种量2.0%,发酵1 d后100 mg/L对氯苯酚降解率达99%以上。与上面苯酚降解浓度相比,氯原子的增加,使得对氯苯酚有效降解浓度偏低。
苯酚中引入硝基形成硝基酚,与苯酚相比,硝基酚的毒性更强,氧化性升高,在生物降解硝基酚过程中,硝基脱去或者还原是其关键环节,因此硝基酚的生物降解研究主要处于低浓度(50~150 mg/L)。郑永良等(2006)从甲基对硫磷污染的土壤中分离到一株铜绿假单胞菌HS-D38,研究发现菌株HS-D38能以甲基对硫磷的中间产物硝基酚为唯一碳源、氮源和能源进行生长,还能利用苯胺类物质为唯一氮源、对苯二酚为唯一碳源进行生长。在前面研究基础上,Zheng等(2009)进一步研究发现HS-D38菌株降解硝基酚的最大浓度为500 mg/L,在24 h之内,该菌将硝基酚矿化为无机盐,当硝基酚浓度超过600 mg/L时会对细胞产生毒性,抑制菌体的生长,添加氯化铵可促进硝基酚的降解,添加葡萄糖则会抑制和延迟其降解。
1.2.2 PA对敌螨普的降解特性
敌螨普又叫二甲基苯乙基甲醇,是一种接触性杀真菌剂,含有两个硝基团,有毒性。Dinu等(2011)从敌螨普污染的土壤中分离到一株以敌螨普(敌螨普最高浓度为1%)为唯一碳源和能源进行生长的铜绿假单胞菌S3,研究发现S3菌株的接种量和最初的pH对降解过程中生物量的增长没有重大影响,培养基中附加0.3%的葡萄糖和1%的玉米粉能获得S3菌株更高的生物量,在生物反应器中S3菌株对含0.2%敌螨普的土壤的修复效率达45.80%。与上面的单苯环物质相比,该物质的生物降解效率不高,这可能与其含有多种抑制降解的化学基团有一定关系。
1.3 PA对多苯环物质的降解特性
多氯联苯(polychlorinated biphenyls, PCBs)具有两个苯环,是通过氯原子取代联苯的氢形成的,随着氯原子数的增加,其稳定性和疏水性都会增加,从而增加了生物好氧降解难度,逐步脱氯是其降解关键环节。Hatamian-Zarmi等(2009)通过富集培养分离到一株多氯联苯、氯化二苯降解菌-铜绿假单胞菌TMU56,该菌可在单氯苯甲酸上生长,降解多氯联苯时不需要联苯作为诱导剂,此外菌株TMU56能以2,4,4-三氯联苯、2,2,5,5-四氯联苯和2,2,4,4,5,5-六氯联苯为唯一碳源进行生长,这是首次报道假单胞菌属即能在PCBs上生长又可在多氯苯甲酸(parachlorobenzoic-acid)上生长。同时发现,联苯上氯原子的增加几乎不会影响TMU56菌株的降解模式,PCBs代谢途径中的酶除了能降解PCBs和其代谢产物外,还可降解几种其他异源物质。
多环芳烃(polycyclic aromatic hydrocarbons, PAHs)是一类由两个或两个以上苯环组成的稠环化合物,其物理性质和化学性质随着苯环个数和分子量的不同而不同,具有致癌、致畸、致突变的效应,其可被多种微生物作为唯一碳源和能源进行降解,随着苯环数目的增加,PAHs的降解难度不断增加(Seo et al., 2009)。1984年,高才昌等报道铜绿假单胞菌AS1.860具有降解萘(Naphthalene)的能力(王岳五等, 1985)。目前,PAHs的生物降解已经研究较深。张丹(2010)研究铜绿假单胞菌PAO1发现其最佳生长温度与最佳降解温度均为37℃,最佳生长pH和最佳降解pH均为7.0,这一降解特性有利于将该菌株应用于环境修复。Zhang等(2011)研究发现DQ8菌株可降解3个和4个苯环的PAHs,且四环PAHs比三环PAHs更难降解,菲(Phenanthrene)和芴(Fluorene)可以在7 d之内被完全降解,但蒽(Anthracene)和芘(Pyrene)在12 d之内分别只被降解了40.5% 和34.5%。厌氧降解方面,Ma等(2011)分离到一株厌氧生长和降解PAHs的PAH-1菌株,该菌以蒽醌-2,6-蜘磺酸盐(AQDS)为唯一电子受体,这是首次报道假单胞菌属利用AQDS进行厌氧降解与生长,添加小分子有机物(果糖)可将菲的降解能力从46.5%提高到56.7%,而且菲降解过程满足一级动力学方程,添加果糖和不添加果糖的速率常数分别为0.0233/d (R2=0.934)、0.0328/d (R2=0.933)。
Hatamian-Zarmi等(2009)发现TMU56菌株可以降解多环芳烃,如萘、菲、蒽,但其不能降解芘。刘和等(2004)发现菌株ZD4-3在受到苯酚诱导后可降解其他芳香化合物,如萘、蒽、菲,其降解效率会受到pH的影响,最佳降解pH为7.0。
与PAHs相比,酸性兰113虽是多苯环物质,但其苯环是由多个偶氮双键连接,因此菌株对其降解与PAHs不同。Nachiyar和Rajakumar (2003)分离到一株降解酸性兰113的铜绿假单胞菌,其降解浓度可达1200 mg/L,其还可在不同水平降解各种其它染料,但在降解中需要与铵盐和葡萄糖进行共代谢。添加无机氮(NH4NO3)对菌体生长和染料褪色均有促进,而有机氮则没有影响。此外还发现当菌体生长到达指数增长晚期时,酸性兰113才开始被降解,但24 h后菌体可将浓度为100 mg/L的染料降解掉90%。
2 PA对不同物质的代谢途径
2.1 PA对正构烷烃的代谢途径
通常PA会利用单加氧酶将正构烷烃的末端甲基氧化,首先将其转化成相应的伯醇,再被氧化成相应的醛,最终转变成脂肪酸,然后脂肪酸经 β-氧化作用生成乙酰辅酶A, 随后进入三羧酸(TAC)循环,正构烷烃被彻底降解为CO2和H2O。但目前降解研究大多局限在较短的链烃(≤C20)。Zhang等(2011)发现DQ8菌株能够利用自身一氧化物酶将正二十二烷在其末端位置氧化成二十二醇,随后二十二醇被进一步氧化成二十二烷酸。杨国君(2004)利用GC/HPLC发现两株铜绿假单胞菌在降解十六烷时首先利用单加氧酶将其末端甲基氧化,生成十六醇,随后经两次脱氢依次形成十六醛和十六酸,十六酸经β-氧化形成乙酰辅酶A,最终通过TCA循环被彻底降解。
2.2 PA对苯酚类物质的代谢途径
一般苯酚的好氧降解是先在苯酚羟化酶的作用下经其氧化作用将苯酚转变成邻苯二酚,然后再经间位或邻位环裂解酶开苯形成己二烯半醛酸,最后形成TCA循环的中间产物,经TCA循环被彻底矿化。刘和等(2004)利用紫外光谱扫描和双加氧酶检测的方法证明ZD4-3菌株可利用2,3-双加氧酶通过间裂解途径将苯酚开环转变为邻苯二酚。
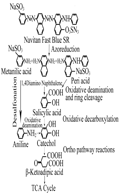
硝基酚是在苯酚的苯环上增加了一个硝基,从而使其降解难度相比苯酚有所增加,降解途径也发生了较大的改变。大多细菌好氧代谢对硝基酚(p-Nitrophenol, PNP)的两种代谢途径的最初步骤已经报道,第一种是PNP经对苯二酚途径(HQ pathway)除去硝基形成对苯二酚,第二种是PNP通过4-硝基儿茶酚(4-NC)去除硝基被转变为偏苯三酚,然后这些产物最终在加氧酶作用下开环被转变为马来醋酸盐,进而形成TCA循环的中间产物被彻底降解(Zheng et al., 2009)。他们通过HPLC-DAD和LC-ESI/MS技术研究了HS-D38菌株对PNP的降解机制与途径,结果表明对苯二酚、4-硝基儿茶酚、1,2,4-三苯酚和醌均能被HS-D38菌株当作降解底物,从而推测出HS-D38菌株是通过HQ途径降解PNP,在HQ途径,4-硝基儿茶酚被转化为ρ-苯醌,ρ-苯醌经对苯二酚再转变成γ-羟基粘康酸半醛,然后最终被氧化为马来醋酸,这种降解机制是首次在假单胞菌属中报道,如图1所示。
|
|
2.3 PA对多苯环物质的代谢途径
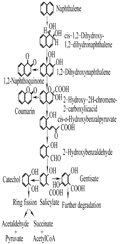
萘、菲、蒽和芴都属于低分子量PAHs,多被用作PAHs降解的模式化合物。萘是最简单、可溶性最强的多环芳烃,细菌降解萘的研究结果被用于理解和预测细菌对三环或更多环PAHs的降解途径(Seo et al., 2009)。目前对萘在假单胞菌属中代谢过程研究的较为清楚,首先萘在萘双加氧酶催化下生成顺-萘二氢二醇,接着经1,2-双羟萘转变成2-羟-2H-苯并吡喃-2-羧酸,这两步分别由顺-萘双氢二醇脱氢酶、1,2-双羟萘双加氧酶催化进行,随后其被2-羟-2H-苯并吡喃-2-羧基异构酶转变成顺-o-羟基-苯亚甲基-丙酮酸,最终在顺-o-羟基苯脱萘丙酮酸水合-醛缩酶作用下形成水杨酸(Seo et al., 2009;张春阳, 2006; 张丹, 2010)。水杨酸可在水杨酸羟化酶作用下转化成邻苯二酚,或者在相应羟化酶作用下生成龙胆酸,随后邻苯二酚既可在邻苯二酚-2,3-双加氧酶催化下在间位裂解开环,经己二烯半醛酸生成丙酮酸及乙醛,还可以在邻苯二酚-1,2-双加氧酶催化下在间位裂解酶裂解开环,经己二烯半醛酸生成乙酰辅酶A及琥珀酸,这些代谢物通过TCA循环最终被彻底矿化为二氧化碳和水(Harayama et al., 1987;张丹, 2010),如图2所示。萘降解为水杨酸的上游途径中所涉及的酶也可通过相似的催化作用参与菲、蒽的降解,此时菲被转变成1-羟-2-萘酸,而蒽被转变成2-羟-3-萘酸(张春阳, 2006)。
|
|
李兆格(2011)发现铜绿假单胞菌PAO1代谢菲的过程中产生了水杨酸、邻苯二酚、邻苯二甲酸和原儿茶酸,并由此推测出菌株PAO1在降解菲时,存在水杨酸—邻苯二酚途径和邻苯二甲酸—原儿茶酸途径;代谢萘时检测到了水杨酸和邻苯二酚,从而推测菌株PAO1在降解萘时存在水杨酸—邻苯二酚途径。此外,他还在铜绿假单胞菌PAO1数据库中检索到了菲双加氧酶基因(pahQ)、萘双加氧酶基因(doxA)、邻苯二酚-2,3-双加氧酶基因(cat2-3),从而证实了上面的推测。这一结果与推测的假单胞菌属细菌降解萘、菲途径吻合。
菲、萘、蒽均为苯环相连组成,但芴是由一条链烃和C-C单键连接两个苯环形成的,这种结构上的差异,导致芴的降解途径也发生了改变。Zhang等(2011)利用GC–MS技术深入研究芴的代谢产物发现DQ8菌株存在两条代谢芴的途径,一条是芴在C9位被氧化成9-芴醇,然后脱氢形成9-芴酮;另一条途径是在芴在C3和C4位进行脱氧生成9H-芴-3,4-二醇,然后9H-芴-3,4-二醇经间裂解途径转化为2-hydroxy-4-(1-oxo-1H-inden-2(3H)-ylide- ne)but-2-enoic acid,再经过3-(1-oxo-2,3-dihydro-1H- inden-2-yl)propanoic acid、2-(1-oxo-2,3-dihydro-1H- inden-2-yl)acetic acid和1-氧-2,3-二氢-1H-茚-2-羧酸最终被转变成1-二氢茚酮。随后1-二氢茚酮可被转化为水杨酸,进入和萘降解一样的途径,被彻底矿化(Seo et al., 2009)。
酸性兰113的苯环是由N=N和氮原子连接,其中也存在苯环直接相连的结构。Nachiyar和Rajakumar (2004)研究发现PA降解酸性兰113时,首先通过偶氮还原途径裂开其偶氮环,生成间氨基苯磺酸、1,4-二氨基萘和周位酸苯,前者通过脱磺酸基反应生成苯胺,再经氧化脱氨基作用转变为邻苯二酚,后两种物质均先转变成水杨酸,随后的反应与PAHs的代谢途径相似,水杨酸经氧化脱羰基作用形成邻苯二酚,邻苯二酚再经间裂途径开环形成β-酮己二酸,最终进入TCA循环,被彻底降解成CO2、H2O,如图3所示。
|
|
3 PA生物降解的遗传基础及酶系
3.1PA生物降解的遗传基础
PA的染色体与质粒均可编码参与生物降解的酶,随着有机物结构复杂程度的增加,其降解过程还可同时涉及到染色体与质粒编码的降解酶。研究发现铜绿假单胞菌Pak1降解基因簇pahA1A2A3A4B-FCQED、铜绿假单胞菌JB2降解基因簇hybABCD都存在染色体上(Hickey et al., 2001; 张春阳, 2006)。郑永良等(2006)用SDS或吖啶橙消除HS-D38菌株质粒后发现该菌降解甲基对硫磷和PNP的能力丧失,说明HS-D38菌株降解甲基对硫磷和PNP的酶是质粒DNA编码。此外,假单胞菌属编码降解酶的基因一般位于相同的操纵子中,并且被协同调控,这种基因调控的经典例子是TOL或NAH质粒编码的降解氯化邻苯二酚的间位裂解途径(van der Meer et al., 1992;Yen and Serdar, 1988),而pahA1A2-A3A4BFCQED基因簇和NAH质粒都属于经典的nah-样基因(张春阳, 2006)。
PA在传递遗传物质过程中,一方面存在染色体基因横向转移机制,另一方面,具有降解功能的质粒也可以在PA和不同菌种之间转移,这些机制可使PA获得新降解基因及途径,提高其生物降解能力、扩大降解范围和缩短污染地区生物修复时间。van der Meer等(1992)推测降解基因的水平转移可能是不同菌种之间发生基因重组的结果,这是菌株适应环境的一种方式。Hickey和Focht (1990)研究发现JB2菌株中具有降解功能的hybABCD基因簇可以被另一株假单胞菌属细菌所捕获,并使其具有相应的降解能力,这一结果证实了PA与其它菌种之间的部分功能基因可以进行横向转移。此外,Yeldho等(2011)通过对铜绿假单胞菌S7降解SDS的质粒的接合转移、消除、分子杂交以及将具有降解作用的质粒导入大肠杆菌E. coli DH5中进行表达的研究,结果证明S7菌株编码降解SDS酶的基因位于质粒上,在适当的自然环境中,质粒可在细菌群中扩撒,使受体菌获得SDS降解能力。总之,这种机制为菌株适应污染环境提供了分子基础(van der Meer等, 1992; 王岳五等, 1985; Hickey et al., 2001)。
3.2 PA生物降解酶系
一氧化物酶在PA降解饱和烃过程中发挥主要作用,如醇脱氢酶和醛脱氢酶等。在PA降解芳香族化合物的过程中,催化开环是降解的关键步骤,开环主要是在加氧酶作用下进行,并且是限速环节,目前已发现有单加氧酶和双加氧酶,而且不同加氧酶所加氧原子的位置不同(张丹, 2010; 李兆格, 2011)。如多环芳烃双加氧酶是PA降解PAHs的关键酶系,负责打开苯环结构,由多聚体和许多亚基组成:包括一个还原酶亚基,一个铁氧还蛋白酶亚基,一个大的α亚基和一个小的β亚基组成的铁硫蛋白。此外还有其它酶的参与,如脱氢酶、醛缩酶和异构酶、羟化酶等,最终将开环后的物质降解(王岳五等, 1985)。
张丹(2010)通过PCR的方法从菲、萘降解菌株PAO1中扩增到了菲双加氧酶基因。Chen等(2004)研究了菌株ZD4-3的邻苯二酚2,3-双加氧酶基因(pheB)并将其在E. Coli BL21 (DE3)中成功表达,证实其具有间位裂环活性。研究加氧酶活性时发现,2,3-双加氧酶催化的间裂解途径要比1,2-双加氧酶催化的邻裂解途径更高效,而且两种双加氧酶的活性都强烈地依赖于其诱导底物的出现(刘和等, 2004)。另外,Hickey and Focht (1990)通过同源比对发现基因簇hybABCD结构大部分与萘双加氧酶相似,由十九个开放阅读框组成,基因簇可以编码ABC转运蛋白、雌二醇环裂解双加氧酶、转录控制蛋白、邻苯二酚降解酶以及转座酶,推定其功能是编码单环羟基化加氧酶。此外,除了一些降解的关键酶外,在生物降解进程中,还有很多与降解相关的酶。如张丹(2010)和李兆格(2011)通过筛选菌株PAO1的随机启动子库,获得20个与菲、萘降解相关的基因,包括参与生物合成和能量代谢的酶、转运有关的酶、膜蛋白等。
4 PA分泌的促降解物质
4.1表面活性物质
生物表面活性剂能提高微生物对多种有机化合物的降解效率,具有生物可降解性、对环境的友好性、高效性、低毒性等优势,在石油开采、环境生物修复等领域得到了广泛应用(钟华等, 2005, 环境科学与技术, 28(1): 9-11, 114; Dusane et al., 2010)。PA在代谢有机污染物时,利用碳源不同,产生的表面活性化合物也不同(Das and Mukherjee, 2007), 如利用液体石蜡产生的是胞外鼠李糖脂,利用十六烷培养基可分离出来一种蛋白质组分-类蛋白活化剂,利用固液混合石蜡产生的表面活性物质是含有多种氨基酸和不同碳链长度脂肪酸组成的混合物(钟华等, 2006)。鼠李糖脂是研究最早和最多的生物表面活性剂之一,Javris和Johnson在1949年最早发现PA可以产生鼠李糖脂(Nachiyar and Rajakumar, 2003),目前已报道多株PA在正构烷烃中生长时会分泌鼠李糖脂,其性质与功能已得到较为深入的研究(钟华等, 2006; Itoh and Suzuki, 1972)。
4.1.1鼠李糖脂促降解特性
鼠李糖脂可促进多种疏水性有机物质降解,钟华等(2005, 环境科学与技术, 28(1): 9-11, 114)发现鼠李糖脂在颗粒状或片状有机固体表面或在其间隙液相中的分散对这些有机物质的降解作用有重要影响。随后在进一步研究铜绿假单胞菌AB93066降解颗粒有机质的过程中证实鼠李糖脂促降解与其具有保持基质水分、促进有机质在基质液相中的分散、改变与生物膜形成相关的菌体吸附性能和改变有机质降解方式等能力有关(钟华等, 2006)。那么可以猜想在极低水分环境中鼠李糖脂的促降解能力应该很低或没有。这一猜想在Holden等(2002)研究鼠李糖脂编码基因在以十六烷为唯一碳源的不饱和多孔渗水培养基中的表达情况时所证实,他们检测到了鼠李糖脂编码基因的表达,但产生的鼠李糖脂却不能促进生物降解。此外,鼠李糖脂不能被源菌PA所降解,但可以被其他非源菌降解。研究发现鼠李糖脂在堆肥有机质介质中能被降解的较为彻底,但降解不具有优先性,不会对环境产生二次污染(傅海燕等, 2009)。
4.1.2鼠李糖脂促降解机制
鼠李糖脂具有脂肪酸型和甲酷型两种存在形式,菌株通过调节这两种形式鼠李糖脂的浓度来适应各种环境。PA在降解烷烃过程中,鼠李糖脂一方面可刺激菌体细胞外排多糖类物质,通过乳化作用或增溶作用提高细胞表面的疏水性和烷烃在水相中的溶解度,使得菌体更易吸收和摄取烷烃(Zhang et al., 2005);另一方面其作用于降解菌细胞表面后,可大大增强细胞对烷烃的亲和力,促进烷烃从胞外向胞内的输运,两种作用协同,大大提高了降解菌对烷烃的吸收转化速率,但目前人们对鼠李糖脂在PA摄取疏水性有机物过程中的作用机理还不是十分清楚(梁生康等, 2006)。
4.2酰基高丝氨酸内酯
PA的QS系统可分泌两种酰基高丝氨酸内酯(AHLs),它们是PA的自分泌信号分子,又称作自诱物(Autoinducers, AIs),这两种自诱物分别是:N-丁酰基-L-高丝氨酸内酯(PAI-2)和N-己酰基-L-高丝氨酸内酯(PAI-1),研究显示PA的自诱物参与许多生物学过程的调控(Dusane et al., 2010; Reis et al., 2011)。
4.2.1 N-酰基高丝氨酸内酯促降解特性
Yong和Zhong (2010)分离到一株具有降解芳香烃和产生酰基高丝氨酸内酯能力的铜绿假单胞菌CGMCC1.860,通过酰基高丝氨酸内酯平板生物测定发现CGMCC1.860菌株在降解苯酚、苯酸盐、ρ-羟基-苯酸盐、水杨酸盐和萘时可产生PAI-1和PAI-2两种AHLs。研究发现外加AHLs提取物或者菌株内过表达AHLs编码基因可促进降解苯酚,阻断菌体产生AHLs则会抑制降解作用,添加不含AHLs的菌体提取物则对降解无影响,因此AHLs可以促进PA降解苯酚等物质。
4.2.2 N-酰基高丝氨酸内酯促降解机制
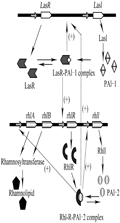
鼠李糖脂由rhlAB操纵子编码的鼠李糖基转移酶1和rhlC编码的鼠李糖基转移酶2参与合成,在PA中鼠李糖脂的产量受rhl与las两个QS系统控制,转录调节子rhlR直接控制其产量,las系统中,lasR编码LasR调节蛋白,lasI编码合成PAI-1的乙酰高丝氨酸内酯合成酶LasI;在rhl系统中,rhlR编码RhlR调节蛋白,rhlI编码催化合成PAI-2的丁酰基高丝氨酸内酯合成酶RhlI (Dusane et al., 2010)。PA分泌的自诱物能与其相应的调节蛋白LasR和RhlR结合,从而调节受QS系统调控的基因(Reis et al., 2011)。rhl系统依赖于las系统,rhlR的转录是受LasR-PAI-1的激活,随着细菌群体密度的增加,las系统会产生感应,从而使得PAI-1浓度的增加,然后PAI-1与LasR调节蛋白结合,LasR-PAI-1复合物会诱导rhlR和lasI基因的表达,产生更多的AIs (Dusane et al., 2010)。当RhlR与PAI-2结合后,其复合物RhlR-PAI-2一方面可以激活rhlR的表达产生RhlR蛋白,另一方面可以激活rhlAB操纵子和rhlC的转录表达产生大量的鼠李糖脂,此外该复合物还对lasI有激活作用,在没有PAI-2时,RhlR蛋白则是rhlAB的抑制物(Dusane et al., 2010; Reis et al., 2011)。因此推测PA分泌的N-酰基高丝氨酸内酯PAI-1和PAI-2是通过促进鼠李糖脂的分泌来促进生物降解,具体调节机制如图4所示。
|
|
5展望
目前PA生物降解研究多限于菌株分离鉴定、降解条件和降解效率等方面,对于降解基因、降解酶以及降解机理方面的研究报道较少,而且对其生物降解功能的研究主要是实验室的摇瓶培养,而环境污染往往需要原位修复,所以今后研究可以尝试面向已污染土壤或水体的原位修复。此外,对于一些重要污染物的代谢途径研究的不是很透彻,这将为降解工程菌的构建带来障碍。在表面活性物质研究中,对PA、表面活性物质及被降解底物之间的作用的认识还不够彻底,有待进一步研究。同时PA能够耐受贫营养环境,环境适应性强,对多环芳烃类、农药类等难降解的环境污染物均有很好的生物降解效果,无二次污染,在实验室研究的基础上应用到实际的环境生物修复工程中,将会为人类解决环境污染问题提供巨大的帮助,而且PA的全基因序列已经公布,这将有助于对铜绿假单胞菌的基因组进行分子生物学操作、进行降解酶基因的研究和克隆、构建高效多功能降解基因工程菌应用于生物修复以及进行降解酶的研制,这也将是今后研究的一个重点。
作者贡献
作者赵鑫主要负责论文的撰写;韩妍和郭坚参与论文的修改;梁文和李博共同负责文献资料的收集;沈立新为通讯作者,负责论文框架的指导、修改和定稿。
致谢
本研究获得陕西省科技厅基金(2011JM4013)、陕西省教育厅基金(11JK0611)和西北大学校级大学生创新性实验计划项目(校2011002, 校2011002)的资助。
参考文献
Afzal M., Iqbal S., Rauf S., and Khalid Z.M., 2007, Characteristics of phenol biodegradation in saline solutions by monocultures of Pseudomonas aeruginosa and Pseudomonas pseudomallei, J. Hazard. Mater., 149(1): 60-66
http://dx.doi.org/10.1016/j.jhazmat.2007.03.046 PMid:17459580
Arino S., Marchal R., and Vandecasteele J.P., 1998, Involvement of a rhamnolipid-producing strain of Pseudomonas aeruginosa in the degradation of polycyclic aromatic hydrocarbons by a bacterial community, J. Appl. Microbiol., 84(5): 769-776 PMid: 10528035
Chen Y.X., Liu H., Zhu L.C., and Jin Y.F., 2004, Cloning and characterization of a chromosome-encoded catechol 2, 3-dioxygenase gene from Pseudomonas aeruginosa ZD 4-3, Microbiol.,73(6): 802-809 PMid: 19126194 PMCid: 2667167
Das K., and Mukherjee A.K., 2007, Crude petroleum-oil biodegradation efficiency of Bacillus subtilis and Pseudomonas aeruginosa strains isolated from a petroleum-oil contaminated soil from North-East India, Bioresour. Technol., 98(7): 1339-1345 http://dx.doi.org/10.1016/j.biortech.2006.05.032 PMid:16828284
Dinu L.D., Matei P.S., Jurcoane S., and Stoica I., 2011, Biodegradation of karathane using adapted Pseudomonas aeruginosa in scale up process, Rom. Biotech. Lett., 16(2): 6048-6054
Dusane H.D., Zinjarde S.S., Venugopalan V.P., Mclean R.J.C., Weber M.M., and Rahman P.K.S.M., 2010, Quorum sensing: Implications on rhamnolipid biosurfactant production, Biotechnol. Genet. Eng. Rev., 27: 159-184
PMid:21415897
Fu H.Y., Chai T., and Jin L., 2009, Biodegradation of rhamnolipid in the liquid culture media and composting matrix, Xiamen Ligong Xueyuan Xuebao (Journal of Xiamen University of Technology), 17(2): 52-56 (傅海燕, 柴天, 金磊, 2009, RL在液态培养条件及堆肥介质中的生物降解研究, 厦门理工学院学报, 17(2): 52-56)
Harayama S., Rekik M., Wasserfallen A., and Bairoch A., 1987, Evolutionary relationships between catabolic pathways for aromatics: Conservation of gene order and nucleotide sequences of catechol oxidation genes of pWW0 and NAH7 plasmids, Mol. Gen. Genet., 210(2): 241-247 http://dx.doi.org/10.1007/BF00325689 PMid:3481421
Hatamian-Zarmi A., Shojaosadati S.A., Vasheghani-Farahani E., Hosseinkhani S., and Emamzadeh A., 2009, Extensive biodegradation of highly chlorinated biphenyl and aroclor 1242 by Pseudomonas aeruginosa TMU56 isolated from contaminated soils, Int. Biodter. Biodegr., 63(6): 788-794 PMid: 16410924
Hickey W.J., and Focht D.D., 1990, Degradation of mono-, di-, and trihalogenated benzoic acids by Pseudomonas aeruginosa JB2, Appl. Environ. Microbiol., 56(12): 3842- 3850 PMid:18853023
Hickey W.J., Sabat G., Yuroff A.S., Arment A.R., and Pérez- Lesher J., 2001, Cloning nucleotide sequencing and functional analysis of a novel mobile cluster of biodegradation genes from Pseudomonas aeruginosa Strain JB2, Appl. Environ. Microbiol., 67(10): 4603-4609 http://dx.doi.org/10.1128/AEM.67.10.4603-4609.2001 PMid:11571162 PMCid:93209
Holden P.A., LaMontagne M.G., Bruce A.K., Miller W.G., and Lindow S.E., 2002, Assessing the role of Pseudomonas aeruginosa surface-active gene expression in hexadecane biodegradation in sand, Appl. Environ. Microbiol., 68(5): 2509-2518 http://dx.doi.org/10.1128/AEM.68.5.2509-2518.2002 PMid:11976128 PMCid:127520
Itoh S., and Suzuki T., 1972, Effect of rhamnolipids on growth of Pseudomonas aeruginosa mutant deficient in n-paraffin utilizing ability, Agric. Biol. Chem., 36: 2233-2235
http://dx.doi.org/10.1271/bbb1961.36.2233
Liang S.K., Su R.G., Wang X.L., Zhou A.H., and Wang W.D., 2006, Biosurfactant-enhanced mechanisms during uptake of alkane, Yingyong Yu Huanjingshengwu Xuebao (Chinese Journal of Applied & Environmental Biology), 12(4): 566-569 (梁生康, 苏荣国, 王修林, 周爱华, 汪卫东, 2006, 生物表面活性剂对铜绿假单胞菌摄取烷烃的强化机制, 应用与环境生物学报, 12(4): 566-569)
Liu H., Wu J.Y., and Chen Y.X., 2004, Biodegradation mechanism of aromatic compounds by Comamonas testosteroni ZD4-1 and Pseudomonas aeruginosa ZD4-3, Weishengwu Xuebao (Acta Microbiologica Sinica), (1): 107-110 (刘和, 吴坚阳, 陈英旭, 2004, 丛毛睾丸酮单胞菌ZD4-1和铜绿假单胞菌ZD4-3降解芳香烃化合物的机理, 微生物学报, (1): 107-110)
http://dx.doi.org/10.1016/j.wear.2003.12.012
Li X.J., Yao R.S., Wang H., and Cheng S.S., 2010, The study on biodegradation of 4-chlorophemol by Pseudomonas aeruginosa TBPY, Huanjing Huaxue (Environmental Chemistry), 29(5): 914-918 (李晓菊, 姚日生, 王淮, 程莎莎, 2010, 铜绿假单胞菌(TBPY)降解对氯苯酚的特性, 环境化学, 29(5): 914-918)
Li Z.G., 2011, Mutation breeding of Bacillus Studies on the degradation of phenanthrene and naphthalene by Pseudomonas aeruginosa PAO1, Thesis for M.S., North- west University, Supervisor: Shen L.X., pp.42-46 (李兆格, 2011, 芽胞杆菌诱变育种铜绿假单胞菌PAO1菲萘降解相关研究, 硕士学位论文, 西北大学, 导师: 沈立新, pp.42-46)
Nachiyar C.V., and Rajakumar G.S., 2003, Degradation of a tannery and textile dye, Navitan Fast Blue S5R by Pseudomonas aeruginosa, World J. Microbiol. Biotechnol., 19(6): 609-614 http://dx.doi.org/10.1023/A:1025159617260
Nachiyar C.V., and Rajakumar G.S., 2004, Mechanism of navitan fast blue S5R degradation by Pseudomonas aeruginosa, Chemosphere, 57(3): 165-169 http://dx.doi.org/10.1016/j.chemosphere.2004.05.030 PMid:15312732
Reis R.S., Pereira A.G., Neves B.C., and Freire D.M.G., 2011, Gene regulation of rhamnolipid production in Pseudomonas aeruginosa—a review, Bioresource Technol., 102(11): 6377-6384 http://dx.doi.org/10.1016/j.biortech.2011.03.074 PMid:21498076
Seo J.S., Keum Y.S., and Li Q.X., 2009, Bacterial degradation of aromatic compounds, Int. J. Environ. Res. Public Health, 6(1): 278-309 http://dx.doi.org/10.3390/ijerph6010278 PMid:19440284 PMCid:2672333
van der Meer J.R., de vos W.M., Harayama S., and Zehnder A.J., 1992, Molecular mechanisms of genetic adaptation to xenobiotic compounds, Microbiol. Mol. Biol. Rev., 56(4): 677-694
Wang Y.W., Ma S.W., Chen D.F., Lv D., Jiang G.C., Zhang X.M., Zong M.K., Zhou Y.L., and Jiao R.S., 1985, The transformation of naphthalene plasmid in Pseudomonas aeruginosa AS1.860, Yichuan Xuebao (Acta Genetica Sinica), 12(4): 257-261 (王岳五, 马生武, 陈德风, 吕丁, 蒋观成, 张秀明, 宗茂坤, 周与良, 焦瑞身, 1985, 铜绿假单胞菌AS1.860萘降解质粒的转化, 遗传学报, 12(4): 257-261)
Yang G.J., 2004, Studies on hydrocarbon uptake and biodegradation by two Pseudomonas aeruginosa strains, Thesis for M.S., Jiangnan University, Supervisors: Li Z.H., and Hua Z.Z., pp.33-39 (杨国君, 2004, 两株假单胞菌摄取与降解烷烃研究, 硕士学位论文, 江南大学, 导师: 李华钟, 华兆哲, pp.33-39)
Yeldho D., Rebello S., and Jisha M.S., 2011, Plasmid-mediated biodegradation of the anionic surfactant sodium dodecyl sulphate by Pseudomonas aeruginosa S7, Bull. Environ. Contam. Toxicol., 86(1): 110-113 http://dx.doi.org/10.1007/s00128-010-0162-2 PMid:21152890
Yen K.M., and Serdar C.M., 1988, Genetics of naphthalene catabolism in pseudomonads, Crit. Rev. Microbiol., 15(3): 247-268 http://dx.doi.org/10.3109/10408418809104459 PMid:3288442
Yong Y.C., and Zhong J.J., 2010, N-acylated homoserine lactone production and involvement in the biodegradation of aromatics by an environmental isolate of Pseudomonas aeruginosa, Process Biochem., 45(12): 1944-1948 http://dx.doi.org/10.1016/j.procbio.2010.05.006
Zhang C.Y., 2006, Genetics advances in upper catabolic pathways of polycyclic aromatic hydrocarbons by bacteria, Weishengwuxue Tongbao (Microbiology), 33(3): 161-166 (张春阳, 2006, 细菌降解多环芳烃上游途径的遗传学研究进展, 微生物学通报, 33(3): 161-166)
Zhang D., 2010, Isolation characteristics and mechanism of bacteria with high phenallthrene and naphthalene degradation ability, Thesis for M.S., Northwest University, Supervisor: Shen L.X., pp.50-52 (张丹, 2010, 多环芳烃—菲、萘降解菌株的分离、降解特性及降解机制研究, 硕士学位论文, 西北大学, 导师: 沈立新, pp.50-52)
Zhang G.L., Wu Y.T., Qian X.P., and Meng Q., 2005, Biodegradation of crude oil by Pseudomonas aeruginosa in the presence of rhamnolipids, J. Zhejiang Univ. Sci., 6(8): 725-730 http://dx.doi.org/10.1631/jzus.2005.B0725 PMid:16052704 PMCid:1389852
Zhang Z.Z., Hou Z.W., Yang C.Y., Ma C.Q., Tao F., and Xu P., 2011, Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by a newly isolated Pseudomonas aeruginosa DQ8, Bioresource Technol., 102(5): 4111-4116 http://dx.doi.org/10.1016/j.biortech.2010.12.064 PMid:21227683
Zheng Y.L., Liu D.L., Chen S.L., Zhao L., and Xiao W.J., 2006, Study on isolation and characteristic identification of a novel high efficiency degrading strain of methyl parathion, Huanjing Kexue Yanjiu (Research of Environmental Sciences), 19(4): 100-104 (郑永良, 刘德立, 陈舒丽, 赵莉, 肖文精, 2006, 一株甲基对硫磷高效降解菌的鉴定及特性研究, 环境科学研究, 19(4): 100-104)
Zheng Y.Y., Liu D.L., Xu H., Zhong Y.L., Yuan Y.Z., Xiong L., and Li W.X., 2009, Biodegradation of p-nitrophenol by Pseudomonas aeruginosa HS-D38 and analysis of metabolites with HPLC-ESI/MS, Int. Biodeter. Biodegr., 63(8): 1125-1129 http://dx.doi.org/10.1016/j.ibiod.2009.09.010
Zhong H., Zeng G.M., Huang G.H., Fu H.Y., and Wang W., 2006, Effects of rhamnolipid on degradation of granule organics by a Pseudomonas aeruginosa strain, Zhongguo Huanjing Kexue (China Environmental Science), 26(2): 201-205 (钟华, 曾光明, 黄国和, 傅海燕, 王伟, 2006, 鼠李糖脂对铜绿假单胞菌降解颗粒有机质的影响, 中国环境科学, 26(2): 201-205)
.png)