2遵义医学院院士工作站糖化学与糖生物学实验室, 遵义, 563099
 作者
作者  通讯作者
通讯作者
植物药与药理学杂志, 2016 年, 第 5 卷, 第 4 篇 doi: 10.5376/jpmp.cn.2016.05.0004
收稿日期: 2016年06月03日 接受日期: 2016年06月15日 发表日期: 2016年06月25日
引用格式(中文):
刘章泉等, 2016, 一种水溶性党参多糖的分离纯化及结构分析, 植物药与药理学杂志(online) Vol.5 No.4 pp.1-4 (doi: 10.13417/j.gab.035.001294)
引用格式(英文):
Liu et al., 2016, Purification and structural analysis of polysaccharide from a kind of water-soluble Codonopsis pilosula, Elongation and Acclimatization of Chrysanthemum morifolium Ramat, Zhiwuyao Yu Yaolixue Zazhi (online) Vol.5 No.4 pp.1-4 (doi: 10.13417/j.gab.035.001294)
采用水提醇沉法得到党参粗多糖(COP),采用Sevag法除去蛋白成份,接着通过Sephacryl S-200 HR及Sephadex G-25凝胶柱色谱分离得到均一多糖COP-1。凝胶渗透色谱法(HPGPC)测定其纯度和平均分子量。高效液相色谱法(HPLC)确定其单糖的组成。红外光谱及核磁推测COP-1结构。结果表明COP-1平均分子量约为2.1 × 103 Da,且均由β-D-(2→1)呋喃果糖组成。
党参Codonopsis pilosul (Franch.) Nannf属植物全世界约有40种,中国约有39种(冯佩佩等, 2012)。中药党参为桔梗科多年生草本植物党参、素花党参、川党参及其同属多种植物的根。党参为中国常用的传统补益药,具有补中益气、润肺生津的功效,用于气血两虚、气短心悸、食少心悸、食少便溏、嘘喘咳嗽和内热消渴等(朱恩圆等, 2001)。传统使用中以山西上党地区出产的党参为上品,具有补中益气,健脾益肺之功效。现代研究表明党参含有多糖、皂苷、生物碱、黄酮、挥发油等多种天然药理活性(汪建红等, 2001)。现代药理学研究证实党参具有抗肿瘤,抗放射,增强免疫功能及抗氧化等多种生物活性,其主要活性成分为党参多糖(Wang et al., 1996; Huheihel et al., 2002; Sun and Liu, 2008, 杨丰榕等, 2011; 杨维群等, 2015)。近几年,国内外在党参多糖生物活性方面进行了深入的研究,但是有关党参多糖的结构研究报道的较少。
在党参粗多糖抗疱疹病毒的筛选期间, 我们发现分子量在3 000~10 000 kD硫酸化的粗多糖是有效果的(王欢等, 2015)。为了更好的探讨它抗病毒的作用机制,我们必须明确它的结构。本研究通过直接水解党参多糖COP-1,然后直接进高效液相分析,与标准单糖对照,从而解析单糖的组份及摩尔比;同时,结合IR数据,借助于一维和二维的核磁技术确定COP-1的结构。
1结果和分析
1.1分离与纯化
通过水提醇沉得方法得到浅黄色的粗多糖,然后用Sevag法除去蛋白质,接着流动自来水透析48 h,然后浓缩透析液并冷冻干燥。为了得到纯度较高的多糖,粗多糖(COP)先过Sephacryl S-200HR柱色谱。洗脱曲线表明COP呈现了一个大峰(COP-1) (图1A),COP-1的进一步纯化在Sephadex G-25柱色谱,从洗脱曲线看,也只有一个峰(图1B)。
|
图 1 A: 粗多糖组分(COP) Sephacryl S-200HR洗脱; B: 粗多糖组分(COP-1) Sephadex G-25洗脱 |
1.2多糖均一性和分子量的测定
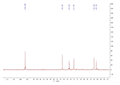
在HPGPC凝胶色谱中COP-1呈现出一个对称的单峰,表明它是一个均一的多糖。根据分子量的标准曲线:logM=2.544+0.6998X-0.0473X2,然后计算得出均一多糖(COP-1)重均分子量为:2.1×103 Da。
|
图 2 HPGPC凝胶色谱中显示COP-1 (COP-1保留时间: 13.580 min) |
1.3单糖组分分析
COP-1单糖组成是通过直接水解多糖样品,然后进高效液相色分析的。单糖和多糖水解的高效液相色谱图(图3; 图4)。多糖水解液的出峰时间对比单糖,可以得知COP-1主要由果糖组成。
|
图 3 4种单糖的液相 注: 四中单糖的保留时间: 木糖=7.099 min; 果糖=7.710 min; 甘露糖=8.620 min;葡萄糖=10.549 min |
|
图 4 COP-1单糖组分的高效液(果糖=7.912 min) |
1.4 COP-1红外分析
COP-1多糖的红外光谱反映了它们的官能团和化学键(图5)。吸收峰3 200 cm-1~3 500 cm-1的响应是被-OH的拉伸振动引起的。在2 939 cm-1的吸收是由于-CH的拉伸振动,同时1 637 cm-1的信号是由二氧化碳引起的。吸收在附近934 cm-1,872 cm-1和818 cm-1的信号表示存在呋喃环的构型,也表明COP-1是呋喃型糖苷键(肖雄等, 2015);此外,对于1 620 cm-1~1 550 cm-1没有吸收峰证明缺乏氨基。同时在1 077 cm-1和1 099 cm-1的峰均属性与OH的角振动的变化。我们从吸收在872cm-1,818 cm-1处推断出该多糖构型是β-D-呋喃果糖(许峰等, 2014)。在1 740 cm-1没有吸收,提示我们COP-1结构中没有糖醛酸。
|
图 5 COP-1红外吸收 |
1.5 COP-1核磁分析
COP-1的氢谱(图6A, D2O作溶剂)显示有7个低场质子信号:δH 4.23 (d, J = 8.3 Hz, 1H)、4.07 (t, J = 8.3 Hz, 1H)、3.90 (d, J = 10.1 Hz, 1H)、3.83 (m, 2H)、3.72 (m, 2H);COP-1的氢谱(图6B, DMSO-d6做溶剂)出现三个羟基的信号:δH 5.18 (d, J = 4.5 Hz, 1H)、4.75 (d, J = 5.6 Hz, 1H)、4.62 (s, 1H)。在COP-1碳谱(图6C)和HSQC (图6D)中出现了6个碳原子,包括一个季碳信号(δC 103.1),三个叔碳的信号(δC 80.9, 76.8, 74.1),两个仲碳信号(δC 62.0, 60.7),通过对比文献(叶冠等, 2005)糖单元的结构被推断为呋喃型的果糖。呋喃果糖的异头碳信号(δC 103.1)表明糖环的构型是β构型。在HMBC图谱中(图6E, DMSO-d6做溶剂)体现了-OH和-C的相关性(图7):OH-3和C-2、C-3、C-4有相关;OH-4和C-3、C-4、C-5有相关;OH-6和C-5、C-6有相关,表明OH-1和OH-2的羟基参与糖苷键的形成。最终我们确定多糖COP-1的结构如下:
[→1)- β-D-fru-(2→1) -]n
|
图 6A COP-1氢谱谱图(D2O做溶剂) |
|
图 6B COP-1氢谱谱图(DMSO做溶剂) |
|
图 6C COP-1碳谱谱图(D2O做溶剂) |
|
图 6D COP-1 HSQC谱图(DMSO做溶剂) |
|
图 6E COP-1是HMBC谱图(DMSO做溶剂) |
|
图 6F COP-1是1H-1H COSY谱图(DMSO做溶剂) |
|
图 7 果糖单元主要的HMBC相关 |
2讨论
从党参中分离出的水溶性果聚糖经IR、1H-NMR、13C-NMR、HMBC和HMQC等核磁图谱,推断COP-1的结构是:→1)- β-D-fru-(2→1)。另外,我们分析该多糖的单糖组分时没有采取衍生化的方法,而是将水解样品进高效分析。采用非衍生化的方法,可以避免不同单糖之间的相互转化,同时,减少操作步骤以降低人为误差(这是一种精确的方式分析单糖组成,原因是不经过衍生化就不会有样品的损失)。此外,果糖在碱性条件下会发生结构的转变,转变成葡萄糖和甘露糖(Fu and O’Neill, 1995),假设某种多糖的单糖组成中含有果糖,葡萄糖、甘露糖(或者是其中的一种),这样子的话会不利于单糖的组成分析。IR和核磁(包含2DNMR)技术相互结合推测出COP-1结构。
3材料与方法
3.1实验材料
洛龙党参购于遵义市道真县,经遵义医学院杨建文教授鉴定为:Codonopsis pilosul (Franch.) Nannf。甲醇、乙醇、三氟乙酸、葡萄糖、正丁醇等购自于成都市科伦化工试剂厂;硝酸钠购于上海化学试剂总厂;氯化钠,D-甘露糖,D-(+)-木糖,D-(-)果糖购自国药集团化学试剂有限公司(均为分析纯);二甲亚砜、D2O (色谱纯)、KBr (光谱纯)、普鲁兰多糖(分子量: 1 000 Da, 5 000 Da, 12 000 Da, 25 000 Da, 50 000 Da)等购自于SIGMA-ALDRICH公司。
3.2粗多糖的分离纯化
100 g粗多糖溶于100 mL去离子水,1 580 (×g)离心10 min除去不溶物。加入无水乙醇使多糖溶液中乙醇终浓度为35%,然后将其存储在4℃下两周。两周后在烧杯的底部,出现了白色沉淀,冷冻干燥得到白色粉末。称取1 g白色粉末溶解在30 mL去离子水,然后用10 mL Sevag试剂(正丁醇:氯仿=1:4)溶液中重复加入三次去除蛋白质组分。取制得白色粉末粗多糖0.5 g溶解在10 mL去离子水中,上Sephacryl S-200HR (2.6×140 cm, Whatman)柱,0.2 mol/L NaCl等度洗脱,恒流泵流速:0.6 ml/min,然后用硫酸苯酚法跟踪检测,收集主峰溶液,透析,浓缩。进一步的纯化通过Sephadex G-25 (2.6×50 cm, Whatman)柱,用去离子水洗脱以0.3 mL/min的流速洗脱。收集主峰,透析,并冻干,命名为COP-1。
3.3多糖COP-1均一性和分子量确定
1 mg纯化的COP-1溶解在1 mL去离子水中,8 827 (×g)离心5 min,收集上清液,待上HPLC分析。HPGPC的具体测试条件如下:Agilent高效液相系统(1 260 HPLC Pump, In line Degasser, 1 260 Infinity Refractive Index Detector, Waters Ultrahydrogel 250 (7.8×300 mm)色谱柱,流动相:0.2 mol/L硝酸钠,流速:0.6 mL/min,进样体积:20 μL,柱温:30℃(姚晓东等, 2015)。
3.4多糖COP-1组分分析-HPLC法
取约1 mg COP-1置于安瓿瓶中,加入1.5 mL的2 mol/L的三氟乙酸,然后封管在100℃的条件下水解3 h (Hu et al., 2015)。接着用旋转蒸发仪旋干水解液,加入1 mL的甲醇接着旋蒸除去多余的三氟乙酸。然后用1 mL去离子水复溶,8 827 (×g)离心5 min,并收集上清液。色谱分析条件如下:Agilent高效液相系统(1 260 HPLC Pump, In line Degasser, Evaporative Light-scattering Detector, Xbridge BEH Amide (4.6×250 mm)色谱柱,流动相:A- 80%乙腈水溶液含0.2%三乙胺;B-30%乙腈水溶液含0.2%三乙胺,ELSD检测器漂移管的温度:30℃,雾化温度:30℃,梯度洗脱程序:A 100%~40%~100%,0~21.00~33.00 min,进样体积:20 μL,柱温:35℃。
3.5红外分析
将适量的多糖COP-1和KBr置于105°C条件下干燥6 h,为了除去这两种物质中的水分,以便更好地分析多糖的结果。在研钵中加入2 mg的多糖样品和400 mg已经烘干的KBr充分研磨。然后进行压片扫描分析,扫描波长范围在500~4 000 cm-1。
3.6核磁分析
核磁是一种很有效的工具用来分析多糖的复杂结构,可以提供精确的信息,包括单糖组成、连接方式、糖环的构型等。室温下取100 mg COP-1分别用了99.9% DMSO和99.96% D2O溶解,如不能完全溶解,则需要加热使其全部溶解。运用Agilent Technologies 400/54 Annual Refill扫描分析。
作者贡献
刘章泉负责试验操作及文章撰写;姚晓东负责文章校对,实验辅助;肖世基负责文献实验技术指导和核磁图谱的解析;陈晓兰、吴倩男负责文献查阅;余兰负责实验路线设计和文章修改。
致谢
本研究由遵义医学院博士启动资金协助项目(ZMKD2013-006)和贵州省自然科学基金(QKH-LH[2014]7563)共同资助。
Feng P.P., Li Z.X., and Yuan Z., 2012, Review on the phytochemical and pharmacological study of Codonopsis pilosula, Shenyang Yaoke Daxue Xuebao (Journal of Shenyang Pharmaceutical University), 29(4): 307-310 (冯佩佩, 李忠祥, 原忠, 2012, 党参属药用植物化学成分和药理研究进展, 沈阳药科大学学报, 29(4): 307-310)
Fu D.T., and O’neill R.A., 1995, Monosaccharide composition analysis of oligosaccharides and glycoproteins by high-performance liquid chromatography, Anal. Biochem., 227(2): 377-384
Huheihel M., Ishanu V., Tal J., and Arad S., 2002, Activity of Porphyridium sp. polysaccharide against herpes simplex viruses in vitro and in vivo, J. Biochem. Biophys. Methods, 50(2-3): 189-200
Sun Y.X., and Liu J.C., 2008, Structural characterization of a water-soluble polysaccharide from the roots of Codonopsis pilosula and its immunity activity, Int. J. Biol. Macrol., 43(3): 279-282
Wang H., Zhang N.Y., Li H.Y., and Yu L., 2015, Effect of sulated modification on Codonopsis pilosula polysaccharide against HSV-1, Zhongguo Keji Lunwen (China Science Paper), 10(6): 705-709 (王欢, 张能英, 李海英, 余兰, 2015, 硫酸化修饰对党参多糖体外抗Ⅰ型单纯疱疹病毒的影响, 中国科技论文, 10(6): 705-709)
Wang J.H., Yuan H, and Li X.H., 2012, Antioxidant and antifatigue activities of flavonoid from Codonopsis clematidea (Schrenk), Tianran Chanwu Yanjiu Yu Kaifa (Natural Product Research and Development), 24(8): 1035-1039 (汪建红, 原慧, 李雪红, 2001, 新疆野生党参总黄酮体内抗氧化及抗疲劳作用研究, 天然产物研究与开发, 24(8): 1035-1039)
Wang Z.T., Ng T.B., Yeung H.W., and Xu G.B., 1996, Immunity effect of a polysaccharide-enriched preparation of Codonopsis pilosula roots, Gen. Pharmacol., 27(8): 1347-1350
Xiao X., Peng M., Tang J.B., and Yang J., 2015, Optimization on sulfated technology of Campanumoea javanica polysaccharide by orthogonal design, Huaxi Yaoxue Zazhi (West China Journal of Pharmaceutical Sciences), 30(5): 556-558 (肖雄, 彭梅, 唐健波, 杨娟, 2015, 正交实验优选土党参多糖的硫酸化工艺, 华西药学杂志, 30(5): 556-558)
Xu F., Wu L.F., Lin S., Wang H.Y., Teng Y., Liu Z.Q., and Zheng Y.G.., 2014, The content determination and structural characterization of polysaccharides from the mycelium of Ophiocordyceps sinensis, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 33(6): 1294-1302 (许峰, 吴林芳, 林善, 王红燕, 腾毅, 柳志强, 郑裕国, 2014,发酵冬虫夏草菌丝体中草多糖含量的检测及结构鉴定, 基因组学与应用生物学, 33(6): 1294-1302)
Yang F.R., Li Z.M., and Gao J.P., 2011, Separation and structural characterization and anti-tumor effect in vitro of polysaccharides from Radix codonopsi, Shizhen Guoyi Guoyao (Lishizhen Medicine and Materia Medica Research), 22(12): 2876-2878 (杨丰榕, 李卓敏, 高建平, 2011, 党参多糖分离鉴定及体外抗肿瘤活性的研究, 时珍国医国药, 22(12): 2876-2878)
Yang W.Q., Wen Y.M., Lin W.D., Xie Y.H., and Chen C.M., 2015, Effect of polysaccharides from Coelomactra antiquata on human carcinoma of esophagus cells transplanted in nude mice, Tianran Chanwu Yanjiu Yu Kaifa (Natural Product Research and Development), 27(8): 1402-1406 (杨维群, 温扬敏, 林文东, 谢永华, 陈长明, 2015, 西施舌多糖对人食管鳞癌裸鼠移植瘤作用的研究, 天然产物研究与开发, 27(8): 1402-1406)
Yao X.D., Liu Z.Q., Wang W., and Zhou X.M., 2015, Molecular weight distribution and monosaccharide composition analysis for water-soluble polysaccharide from Dendrobium nobile Lindl, Zunyi Yixueyuan Xuebao (Acta Academiae Medicinae ZunYi), 38(3): 239-243 (姚晓东, 刘章泉, 汪巍, 周旭美, 金钗石斛水溶性多糖分子量分布及单糖组份分析, 遵义医学院学报, 38(3): 239-243)
Ye G., Li C., Huang C.G., Li Z.X., Wang X.L., and Chen Y.Z., 2005, Chemical structure of fructosan from Codonpsis pilosula, Zhongguo Zhongyao Zazhi (China Journal of Chinese Materia Medica), 30(17): 1338-1339 (叶冠, 李晨, 黄成钢, 李志孝, 王新亮, 陈耀祖, 党参果聚糖的化学结构, 中国中药杂志, 30(17): 1338-1339)
Zhu E.Y., He Q, Wang Z.T., Xu L.S., and Xu G.J., 2001, Chemical study on the root of Codonopsis pilosula, Zhongguo Yaoke Daxue Xuebao (Journal of China Pharmaceutical University), 32(2): 94-95 (朱恩圆, 贺庆, 王峥涛, 徐珞珊, 徐国钧, 2001, 党参化学成分研究, 中国药科大学学报, 32(2): 94-95)
.png)
.png)
.png)
.png)
.png)





.png)