作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 47 篇 doi: 10.5376/mpb.cn.2012.10.0047
收稿日期: 2011年12月12日 接受日期: 2012年08月21日 发表日期: 2012年11月05日
引用格式(中文):
史卫东等, 2012, 利用MSAP分析18个芥蓝齐口期的表观遗传多样性, 分子植物育种(online) Vol.10 No.47 pp.1346-1353 (doi: 10.5376/mpb.cn.2012.10.0047)
引用格式(英文):
Shi et al., 2012, The Epigenetic Genetic Diversity of 18 Chinese Kales Analyzed by MSAP when Initiated Flowering, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.47 pp.1346-1353 (doi: 10.5376/mpb.cn.2012.10.0047)
本研究利用MSAP检测18个芥蓝齐口期DNA甲基化水平,分析了表观遗传多样性,探讨DNA甲基化模式对齐口期的影响。结果表明,18个芥蓝齐口期平均为50 d,叶片数平均为10片,齐口期和叶片数不相关(相关系数为0.296);变异系数分别为21%和18%;遗传距离分布在0~40,平均值为12.227 6,在10.62处分为3类。MSAP分析表明,5对引物组合扩增得到432条多态性条带,201条片段表现出多态性,多态性比率为47%;Nei遗传距离分布在0.004~0.467,平均值为0.095 8,表明遗传多样性水平较低;在0.04处分为3类。Mantel测验表明两种分析的遗传距离相关系数为-0.136 6 ,显示齐口期、叶片数与DNA甲基化多态性没有相关性。DNA甲基化模式分析表明,非甲基化片段为110条,甲基化多态性片段为322条,分为3种带型,类型一为非甲基化带型(110条),类型二为甲基化带型(110条),类型三为半甲基化带型(152条),非甲基化片段和半甲基化片段在不同品种之间呈现多态性,甲基化片段在不同品种之间呈现多态性与单态性相差不大,显示MSAP多态性主要来源于非甲基化和半甲基化片段,芥蓝甲基化模式以半甲基化为主。本文推测芥蓝DNA甲基化水平降低与在齐口期调控有关,MSAP分析用于结构基因组研究,还可以用于功能基因组研究。
芥蓝(Brassica oleracea L. Var. alboglabra Bailey) 是我国南方特产蔬菜,以秋冬生产为主,收获期是齐口期,即抽薹开花始期,此时植株正经历营养生长向生殖生长的转换,受温光环境因素影响很大,如低温利于春化作用诱导齐口期,而高温则阻滞生长、降低菜薹产量和品质等 (关佩聪和梁承愈, 1989年; 杨暹和杨运英, 2002; 刘厚诚等, 2003),因此,齐口期不但是生产上常用的品种分类标准,也是育种和种质资源鉴定的重要指标。
通过模式植物拟南芥的研究发现,春化诱导开花与微量的短暂的DNA甲基化水平降低相关(Burn et al., 1993; Finnegan et al., 1996; 1998; Sheldon et al., 2000),DNA甲基化水平降低也能够诱导白菜、菜心、萝卜和青花菜等的抽薹开花(李梅兰等, 2002; 2003; 汪炳良等, 2005; 王薇等, 2008; 于锡宏等, 2008)。有研究认为DNA甲基化作为表观遗传的重要形式,参与春化途径调控并可能起着整合因子作用(Sheldon et al., 2000),也有研究认为DNA甲基化水平降低和春化作用是通过不同的调控途径诱导开花时间关键基因FLOWERING LOCUS C (FLC)下调表达的(Finnegan et al., 2005)。
检测甲基化的诸多方法中,MSAP (methylation sensitive amplified polymorphism)与AFLP原理相同,如两者均无需了解全基因组序列信息,采用长寡核苷酸随机引物进行PCR反应,利用聚丙烯酰胺凝胶进行产物分离,既保留RFLP的可靠性又保留PCR的精确性和高效性,成为多态性检测效率非常高的分子标记技术。不同之处是MSAP选用HpalI和MspI酶切DNA,这对同裂酶能够检测基因组DNA上CCGG位点的胞嘧啶甲基化状态(McClelland et al., 1994),结果MSAP既能象AFLP一样检测基因组DNA的序列差异,又能检测由非序列变化引起的表观遗传差异,演变成一种结构与功能相结合的分子标记,在十字花科植物研究上得到广泛应用,如拟南芥、白菜、油菜、萝卜的发育调控、种质资源鉴定、抗逆性或多倍化后代的甲基化分析(Cervera et al., 2002; 陆光远等, 2005, 科学通报, 50(24): 2750-2756;李象松等, 2010; Salmon et al., 2008),但在芥蓝种质资源鉴定上还没见报道。由于芥蓝种质资源狭窄,齐口期易受环境因素影响,常规的分子标记技术仅能检测出基因组结构变异,为此本研究利用MSAP检测18个芥蓝DNA甲基化水平,分析齐口期表观遗传多样性,探讨DNA甲基化对齐口期的影响,旨在为芥蓝育种和栽培生产提供理论依据。
1结果与分析
1.1芥蓝齐口期分析
18份芥蓝齐口期和叶片数的调查结果如下(表1),齐口期最少为35 d (澄海芥蓝菜和大丰芥蓝),最多的75 d (正源澄海粗条芥蓝),多数品种为40~60 d,平均为50 d。齐口期叶片数最少的为8片(正源四季甜芥蓝, 白花尖叶粗苔甜芥蓝, 甜脆黄花尖叶芥蓝),最多的为15片(泰国芥蓝),平均叶片数为10片。齐口期和叶片数相关系数为0.296,两者不相关,即叶片数不随齐口期变化。变异系数表示性状离散性特征,高值代表性状离散程度大,本研究中的齐口期为21%,叶片数为18%,表明齐口期变异程度大于叶片数。
根据18个芥蓝的齐口期和叶片数,利用DPS数据处理系统计算遗传距离,变化范围是 0~40,平均值为12.227 6。正源澄海粗条芥蓝和澄海芥蓝菜的遗传距离最大(40),香港白花甜芥蓝和正源大笋黄花芥蓝、正源四季甜芥蓝和绿宝芥蓝,白花尖叶粗苔甜芥蓝和甜脆黄花尖叶芥蓝的遗传距离最小,表明几个品种亲缘关系最近。
利用欧式距离和类平均法进行聚类分析(图1),在遗传距离10.62处分为3类,第一类是齐口期为35~50 d之间的品种,包括白花甜芥蓝、甜脆白花尖叶芥蓝、泰国中迟花粗茎尖叶芥兰、香港白花甜芥蓝、正源大笋黄花芥蓝、中花芥蓝、顺宝芥蓝、白花尖叶粗苔甜芥蓝、甜脆黄花尖叶芥蓝、大丰芥蓝和澄海芥蓝菜。第二类是齐口期为55~60 d的品种,包括正源大笋香菇芥蓝、大芯四季香菇芥蓝104、正源大笋迟花芥蓝、泰国芥蓝、正源四季甜芥蓝和绿宝芥蓝。第三类为齐口期75 d的正源澄海粗条芥蓝。
1.2芥蓝MSAP分析
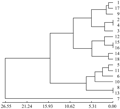
利用5对MSAP引物组合扩增18个芥蓝品种,一共得到432条带,平均每条引物86条,其中 201条片段表现出多态性,推测芥蓝甲基化多态性比率为47% (201/432),可见MSAP检测芥篮种质资源遗传多样性的效率很高,芥篮遗传多样性也较丰富(图2)。
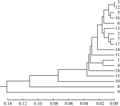 图2 芥蓝MSAP聚类分析 Figure 2 The cluster of Chinese kales with MSAP |
选用EcoR I和Msp II组合获得的多态性条带,利用GenAlEx 6.4软件计算18份品种的Nei遗传距离,分布范围是 0.004~0.467,平均值为0.095 8,表明遗传多样性水平较低。中花芥蓝和顺宝芥蓝的遗传距离最小(0.004),泰国中迟花粗茎尖叶芥篮与澄海芥蓝菜最大(0.467)。
按照UPGMA方法,利用Nei遗传距离进行聚类分析,在遗传距离0.04处,可以将18份品种分为3类,第一类中花芥蓝、顺宝芥蓝、正源大笋香菇芥蓝、甜脆黄花尖叶芥蓝、正源大笋迟花芥蓝、绿宝芥蓝、香港白花甜芥蓝、正源澄海粗条芥蓝、甜脆白花尖叶芥蓝、大丰芥蓝、大芯四季香菇芥蓝104、白花甜芥蓝、正源大笋黄花芥蓝、澄海芥蓝菜、白花尖叶粗苔甜芥蓝。第二类为泰国芥蓝。第三类为正源四季甜芥蓝。第四类为泰国中迟花粗茎尖叶芥篮(图3)。
1.3芥蓝齐口期和MSAP相关性检验
18份芥篮的MSAP与齐口期聚类分析结果不一致,为验证两种分析的相关程度,利用mantel test检验齐口期遗传距离和MSAP遗传距离相关性,相关系数为-0.136 6,表明齐口期、叶片数和基因组DNA甲基化相关不显著。
1.4芥篮DNA甲基化模式分析
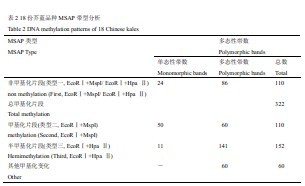
DNA甲基化多态性片段归纳为3种带型(表2),类型一为两种内切酶均能酶切的带型(EcoRⅠ+MspI/EcoRⅠ+Hpa Ⅱ),代表非甲基化;类型二为EcoRⅠ+MspI酶切带型,表示双链内胞嘧啶甲基化(M)。
类型三为EcoRⅠ+HpaⅡ酶切带型,表示单链外部胞嘧啶的半甲基化(H)。本研究非甲基化片段为110条,甲基化多态性片段为322条,可分3种类型,类型一的变化范围为110条(澄海芥蓝菜)~160条(泰国中迟花粗茎尖叶芥篮),类型二为63条(澄海芥蓝菜)~172条(泰国中迟花粗茎尖叶芥篮),类型三为52条(白花甜芥蓝)~116条(香港白花甜芥蓝)。类型二平均数量为110条,少于类型三的152条,类型三为半甲基化类型。在不同品种之间,78% (86/110)的非甲基化片段和92% (141/152)的半甲基化片段呈现多态性,而甲基化片段中,多态性与单态性相差不大,表明芥蓝较高的MSAP多态性主要来源于前两者,甲基化模式以半甲基化为主。
2讨论
作为南方地区的重要叶菜,芥蓝形态性状丰富,其中齐口期作为重要的商品和产量性状,受环境(特别是低温)、生长发育规律、品种、播种期及矿质营养等的影响较大(关佩聪和梁承愈, 1989; 杨暹和杨运英, 2002; 张静和张鲁刚, 2008)。本研究18份芥蓝齐口期变异系数达21%,正是诸多影响因素的综合反映。聚类分析中除香港白花甜芥蓝、正源大笋黄花芥蓝、白花尖叶粗苔甜芥蓝和甜脆黄花尖叶芥蓝外,其余14份芥蓝基本按照齐口期分类,证明齐口期可以作为种质资源鉴定的可靠指标,但香港白花甜芥蓝和正源大笋黄花芥蓝、白花尖叶粗苔甜芥蓝和甜脆黄花尖叶芥蓝具有非常小的遗传距离,显示其亲缘关系紧密,而黄花和白花芥蓝属于不同的栽培品种(刘海涛和关佩聪, 1997),这又说明齐口期分类仍具有局限性,不能反映出其它表型特征,所以在利用表型研究遗传多样性时,性状一定要丰富和典型,才可能反映种质资源的真实特性。
高等植物DNA的甲基化比例变化很大(Finnegan et al., 1996),与拟南芥、甘蓝、油菜和萝卜等的MSAP分析相比,本研究中MSAP检测的芥篮甲基化比例为47%,低于芥蓝与萝卜四倍体的30.61%~33.10% (F4~F10) (李象松等, 2010)和甘蓝的53.3~60.7% (Salmon et al., 2008),高于拟南芥的24%~34% (Cervera et al., 2002)、油菜的15% (陆光远等, 2005, 科学通报, 50(24): 2750-2756)和5%~13.4% (柳李旺等, 2006, 江苏农业科学, 6: 203-206),暗示同为十字花科植物,尽管亲缘关系紧密,但基因组甲基化水平在不同物种之间还是有差别的。MSAP聚类分析发现品种间遗传距离也较小,分布范围在 0.004~0.467之间,与RAPD和SRAP检测结果基本一致(陈文文等, 2011;李桂花等, 2011),即芥蓝遗传多样性水平较低,而多数品种来源于中国并分在一组,两个泰国品种各具一类,可能反映了种质的地理差异。本文发现MSAP分析与已有分子标记研究相同,既揭示种质亲缘关系信息,又揭示地理信息,不失为芥蓝种质资源研究的较好方法。
表观遗传变异可占拟南芥株高和开花时间表型变异30% (Johannes et al., 2009),但不同生态型的甲基化调控机制各异,导致基因型之间的甲基化多态性不相关,使得亲缘关系紧密的拟南芥也并不归为一类(Cervera et al., 2002),并且DNA甲基化水平降低诱导的表型在基因型之间变化很大,仅弱相关于亲缘关系(Bossdorf et al., 2010),而在水稻上与表型相关的表观标记更可能出现在亲缘关系紧密的品系中(Takata et al., 2005)。本文的芥蓝齐口期、叶片数和DNA甲基化多态性不相关,齐口期与MSAP聚类分析结果不一致,意味着仅根据一种鉴定来推测遗传多样性不十分理想。究其原因可能在于芥蓝起源于且主要种植在南方地区,遗传多样性受地域限制而较低(陈文文等, 2011; 李桂花等, 2011),再次由于MSAP只检测CCGG位点甲基化水平,不能检测出其它类型甲基化变异和基因组序列变化,检测的甲基化水平也偏低(Xiong et al.,1999),造成两种分类结果不一致,这也说明将表型和分子标记鉴定结合是评价十字花科植物遗传多样性比较有效的方法(郭晶心等, 2002; 杨华等, 2006)。
抽薹开花是一个受多基因和多途径调控的过程,DNA甲基化参与春化作用调控(Michaels and Amasino, 1999; Sheldon et al., 2000)。本研究芥蓝DNA甲基化多态性主要来源于非甲基化片段和半甲基化片段,甲基化模式以半甲基化为主,说明在自然条件下DNA甲基化水平在齐口期降低,这与利用去甲基化试剂(5-aza)处理降低DNA甲基化水平取得的效果相同(Burn et al., 1993; Finnegan et al., 1998; 李梅兰等, 2002; 2003; 汪炳良等, 2005; 王薇等, 2008; 于锡宏等, 2008),认为DNA甲基化水平降低参与芥篮齐口期调控,但是否如油菜上去甲基化归因于春化作用的结论(Filek et al., 2006),还有待后续实验证实,本研究也表明MSAP分子标记除了用于芥蓝基因组结构研究,还可以用于基因组水平上性状的功能研究。
3材料与方法
3.1参试品种及播期
试验于2008年秋季在广西农业科学院蔬菜中心蔬菜基地进行,品种编号见表1。直播。从每个品种选择10株记录齐口期和叶片数,采集叶片用液氮冷冻于-70℃冰箱。
3.2 DNA提取
采用CTAB的方法:取2~3 g叶片,用液氮研碎,加入DNA提取液(含1.5%的CTAB, 1%巯基乙醇),65℃水浴90 min,加入氯仿:异戊醇(24:1),抽提2次后,加RNA酶37℃温浴过夜,苯酚:氯仿:异戊醇(25:24:1)纯化,样品DNA用ddH2O溶解和保存。
3.3 MSAP分析
参照Xiong等(1999)和陆光远等(2005, 科学通报, 50(24): 2750-2756)的方法。酶切连接一步法反应体系和步骤:25 μL反应体系:Mse I adaptor (50 pmol/μL) 1 μL,EcoR I adaptor (5 pmol/μL) 1μL,T4 buffer 2.5 μL,T4 ligase 1.5 U,100×BSA 0.25 μL,Mse I 3 U,EcoR I 3 U,DNA 2 μL,双蒸水补足至 25 μL。将上面反应体系的PCR管在37℃水浴锅中处理10 h,然后转到70℃处理15 min,稀释10倍,作为预扩增模板。预扩增体系:10×buffer 2 μL,Mg2Cl (25 mmol/L) 1.6 μL,dNTP (10 mmol/L) 0.4 μL,Taq酶 (2 U/μL) 0.5 μL,Mse I (50 ng/μL) 1 μL,EcoR I (50 ng/μL) 1 μL,DNA 3 μL,H2O 12.1 μL。反应条件:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸1 min,一共25份循环;72℃延伸7 min;4℃保存。预扩增引物序列参考Salmon等(2008)。选扩增体系:10×buffer 2 μL,Mg2Cl (25 mmol/l) 1.6 μL,dNTP (10 mmol/L) 0.4 μL,Taq酶(2U/μL) 0.5 μL,Mse I ( 50 ng/μL) 1 μL,EcoR I ( 50 ng/μL) 1 μL,DNA 3 μL,H2O 12.1 μL。反应条件:94℃预变性3 min;94℃变性30 s,65℃退火30 s,每循环下降0.7℃,72℃延伸1 min,一共23份循环;72℃延伸7 min;4℃保存。6%聚丙烯酰胺胶电泳检测扩增产物,银染法染色显影。
3.4数据分析
采用DPS数据处理系统对开花期和叶片数进行系统聚类分析。MSAP分析参考Salmon等(2008),记载选择性扩增反应的条带数,清晰可见的条带设为1,肉眼不可见或模糊不清的条带设为0,将统计的条带记为数字矩阵,利用Excel计算甲基化多态性比率和甲基化类型。利用GenAlEx 6.4软件计算Nei分子遗传距离和聚类分析,利用mantel检验;两种分析的遗传距离相关性。
作者贡献
史卫东是本项目的实验设计、实验研究和数据分析的执行人,完成论文写作与修改。李秋雯参与MSAP实验;黄如葵、赵坤提供部分试验材料;王益奎参与数据分析。全体作者都阅读并同意最终的文本。
致谢
本研究获得广西农业科学院基本科研业务专项(2012JZ06和桂农科2012YT05)、广西作物遗传改良生物技术重点实验室开放课题子课题(桂科能0815011-6-1)资助。感谢评审人的评审意见和修改建议。
参考文献
Bossdorf O., Arcuri D., Richards C.L., and Pigliucci M., 2010, Experimental alteration of DNA methylation affects the phenotypic plasticity of ecologically relevant traits in Arabidopsis thaliana, Evolutionary Ecology, 24(3): 541-553
http://dx.doi.org/10.1007/s10682-010-9372-7
Burn J.E., Babnall D.J., Metzger J.D., and Dennis E.S., 1993, DNA methylation, vernalization, and the promotion of flowering. Proceedings of the National Academy of Sciences of the USA, 90: 287-291
http://dx.doi.org/10.1073/pnas.90.1.287
PMid:11607346 PMCid:45645
Cervera M.T., Ruiz-Garcia L., and Martinez-Zapater J.M., 2002, Analysis of DNA methylation in Arabidopsis thaliana based on methylation-sensitive AFLP markers, Mol. Genet. Genomics, 268(4): 543-552
http://dx.doi.org/10.1007/s00438-002-0772-4
PMid:12471452
Chen W.W., Liu H.C., Chen R.Y., Song S.W., and Sun G.W., 2011, Genetic diversity analysis of Chinese Kale germplasm resources by RAPD markers, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 27(8): 150-155 (陈文文, 刘厚诚, 陈日远, 宋世威, 孙光闻, 2011, 基于RAPD标记的芥蓝种质资源遗传多样性分析, 中国农学通报, 27(8): 150-155)
Filek M., Janiak A., Szarejko I., Grabczyńska J., Machácková I., and Krekule J., 2006, Does DNA methylation pattern mark generative development in winter rape? Z. Naturforsch. C., 61(5-6): 387-396
PMid:16869498
Finnegan E.J., Genger R.K., Kovac K., Peacock W.J., and Dennis E.S., 1998, DNA methylation and the promotion of flowering by vernalization, Proc. Natl. Acad. Sci. USA, 95(10): 5824-5829
http://dx.doi.org/10.1073/pnas.95.10.5824
PMid:9576969 PMCid:20464
Finnegan E.J., Kovac K.A., Jaligot E., Sheldon C.C., Peacock W.J., and Dennis E.S., 2005, the down regulation of FLOWERING LOCUS C (FLC) expression in plants with low levels of DNA methylation and by vernalization occurs by distinct mechanisms, The Plant Journal, 44(3): 420-432
http://dx.doi.org/10.1111/j.1365-313X.2005.02541.x
PMid:16236152
Finnegan E.J., Peacock W.J., and Dennis E.S., 1996, Reduced DNA methylaiton in Arobidopsis thaliana results in abnormal plant development, Proc. Natl. Acad. Sci. USA, 93(16): 8449-8454
http://dx.doi.org/10.1073/pnas.93.16.8449
PMid:8710891 PMCid:38691
Guan P.C., and Liang C.Y., 1989, Flower bud differentiation of Chinese kale (Brassica alboglabra bailey) and its relation to cultivar, sowing time and vernalization, Huanan Nongye Daxue Xuebao (Journal of South China Agricultural University), 10(2): 60-66 (关佩聪, 梁承愈, 1989, 芥兰花芽分化与品种播种期和春化条件关系, 华南农业大学学报, 10(2): 60-66)
Guo J.X., Zhou N.Y., Ma R.C., and Cao Q., 2002, Genetic diversity in Brassica rapa revealed by AFLP molecular markers, Nongye Shengwu Jishu Xuebao (Journal of, Agricultural Biotechnology), 10(2): 138-143 (郭晶心, 周乃元, 马荣才, 曹鸣庆, 2002, 白菜类蔬菜遗传多样性的AFLP分子标记研究, 农业生物技术学报, 10(2): 138-143)
Johannes F., Porcher E., Teixeira F.K., Saliba-Colombani V., Simon M., Agier N., Bulski A., Albuisson J., Heredia F., Audigier P., Bouchez D., Dillmann C., Guerche P., Hospital F., and Colot V., 2009 Assessing the impact of transgenerational epigenetic variation on complex traits, PLoS Genet., 5(6): e1000530
http://dx.doi.org/10.1371/journal.pgen.1000530
PMid:19557164 PMCid:2696037
Li G.H., Chen H.C., Zhang Y., Guo F.Y., Li X.Y., Liu Z.X., and Zhang G.Q., 2011, SRAP analysis on genetic diversity of Chinese kale germplasm, Redai Zuowu Xuebao (Chinese Journal of Tropical Crops), 32(12): 2214-2220 (李桂花, 陈汉才, 张艳, 郭凤仪, 李向阳, 刘振翔, 张桂权, 2011, 芥蓝种质资源遗传多样性的SRAP分析, 热带作物学报, 32(12): 2214-2220)
Li M.L., Wang Q.M., Zhu Z.J., and Zeng G.W., 2002, Studies on the changes of DNA methylation level, GA content and protein innon-heading Chinese cabbage during vernalization, Yuanyi Xuebao (Acta Horticulturae Sinica), (4): 353-357 (李梅兰, 汪俏梅, 朱祝军, 曾广文, 2002, 春化对白菜DNA甲基化、GA含量及蛋白质的影响, 园艺学报, (4): 353-357)
Li M.L., Zeng G.W., and Zhu Z.J., 2003, Analysis of effects of 5-azacytindine on promoting flowering in non-heading Chinese cabbage, Zhejiang Daxue Xuebao (Nongye Yu Shengmingkexue Ban) (Journal of Zhejiang University: Agriculture & Life Science), 29(3): 287-290 (李梅兰, 曾广文, 朱祝军, 2003, 5-氮杂胞苷促进白菜开花的效应分析, 浙江大学学报(农业与生命科学版), 29(3): 287-290)
Li X.S., Wei L.H., Li X.L., Wang Y.J., Wang B., Wu J.S., and Long H., 2010, Methylation variation of different generations of artificial Raphanus Sativus×Brassica Alboglabra allopolyploids analyzed with MSAP, Huazhong Nongye Daxue Xuebao (Journal of Huazhong Agricultural University), (10): 96-100 (李象松, 魏丽华, 李炫丽, 汪艳杰, 王冰, 吴江生, 龙鸿, 2010, 萝卜×芥蓝异源四倍体F4和F10世代DNA甲基化变异的MSAP分析, 华中农业大学学报, (1): 96-100)
Liu H.C., Huang Q., Chen R.Y., and Liu Q., 2003, Color-formation of Chinese kale stalk under high temperature, Zhongguo Shucai (China Vegetables), (6): 17-19 (刘厚诚, 黄琴, 陈日远, 刘晴, 2003, 高温条件下芥蓝菜薹色泽的形成, 中国蔬菜, (6): 17-19)
Liu H.T., and Guan P.C., 1997, Taxonomic relation between yellow-flower Chinese kale and white-flower Chinese kale, Huanan Nongye Daxue Xuebao (Journal of South China Agricultural University), (2): 16-19 (刘海涛, 关佩聪, 1997, 黄花芥蓝与白花芥蓝的分类学关系, 华南农业大学学报, (2): 16-19)
McClelland M., Nelson M., and Raschke E., 1994, Effect of site-specific modification on restriction endonucleases and DNA modification methyltransferases, Nucleic Acids Res., 22(17):3 640-3659
Michaels S.D., and Amasino R.M., 1999, FLOWERING LOCUS C encodes a novel MADS domain protein that acts as a repressor of flowering, The Plant Cell, 11(5): 949-956
Salmon A., Clotault J., Jenczewski E., Chable V., and Manzanares-Dauleux M.J., 2008, Brassica oleracea displays a high level of DNA methylation polymorphism, Plant Science, 174(1): 61-70
http://dx.doi.org/10.1016/j.plantsci.2007.09.012
Sheldon C.C., Finnegan E.J., Rouse D.J., Tadege M., Bagnall D.J., Helliwell C.A., Peacock W.J., and Dennis E.S., 2000, The control of flowering by vernalization, Curr. Opin. Plant Biol., 3(5): 418-422
http://dx.doi.org/10.1016/S1369-5266(00)00106-0
Takata M., Kishima Y., and Sano Y., 2005, DNA methylation polymorphisms in rice and wild rice strains: Detection of epigenetic markers, Breeding Science, 55(1): 57-63
http://dx.doi.org/10.1270/jsbbs.55.57
Wang B.L., Li S.F., Zeng G.W., and Deng J.Y., 2005, Effect of 5-azacytosine on flowering and DNA methylation level of stem apices in radish (Raphanus sativus L.), He Nongxuebao (Acta Agriculturae Nucleatae Sinica), 19(4): 265-268 (汪炳良, 李水凤, 曾广文, 邓剑英, 2005, 5-azaC对萝卜茎尖DNA甲基化和开花的影响, 核农学报, 19(4): 265-268)
Wang W., Xia G.Q., and Yao F.J., 2008, Inductive effects of vernalization and GA3 on flowering of Chinese cabbage, Jilin Nongye Daxue Xuebao (Journal of Jilin Agricultural University), 30(1): 24-27 (王薇, 夏广清, 姚方杰, 2008, 春化和赤霉素处理对大白菜开花的诱导效应, 吉林农业大学学报, 30(1): 24-27)
Xiong L.Z., Xu C.G., Saghai-Maroof M.A., and Zhang Q., 1999, Patterns of cytosine methylation in an elite rice hybrid and its parental lines detected by methylation sensitive amplification polymorphism technique, Mol. Gen. Genet., 261(3): 439-446
Yang H., Liu Z.C., Chen H.R., Chen L., and Luo L.J., 2006, Genetic diversity analyses based on SSR markers of Brassica vegetable germplasm distributed in Shanghai, Zhiwu Yichuan Ziyuan Xuebao (Journal of Plant Genetic Resources), 7(3): 264-269 (杨华, 刘灶长, 陈海荣, 陈亮, 罗利军, 2006, 上海地区芸薹属蔬菜遗传多样性研究, 植物遗传资源学报, 7(3): 264-269)
http://dx.doi.org/10.1007/s004380050986
PMid:10323223
Yang X., and Yang Y.Y., 2002, The effects of temperature on flower bud differentiation, yield and quality formation in Chinese kale (Brassica alboglabra Bailey), Huanan Nongye Daxue Xuebao (Zirankexue Ban) (Journal of South China Agricultural University (Natural Science Edition)), (2): 5-7 (杨暹, 杨运英, 2002, 苗期温度对芥蓝花芽分化、产量与品质形成的影响, 华南农业大学学报(自然科学版), (2): 5-7)
Yu X.H., Li D., and Jiang X.M., 2008, The effect of DNA demethylation on vernalization in Broccoli (Brassica oleracea L. var. italica Plenck), Zhongguo Shucai (China Vegetables), (10): 16-18 (于锡宏, 李丹, 蒋欣梅, 2008, DNA去甲基化试剂处理对青花菜春化作用的影响, 中国蔬菜, (10): 16-18)
Zhang J., and Zhang L.G., 2008, Diversity and cluster analysis of Chinese kale germplasm resources, Xibei Nongye Xuebao (Acta Agriculturae Boreali-occidentalis Sinica), 17(4): 285-289 (张静, 张鲁刚, 芥蓝种质资源的多样性和聚类分析, 西北农业学报, 17(4): 285-289)
.jpg)
.gif)