2.四川省农业科学院作物研究所, 成都, 610066
3.电子科技大学生命科学学院, 成都, 610054
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 70 篇 doi: 10.5376/mpb.cn.2012.10.0070
收稿日期: 2012年06月29日 接受日期: 2012年07月20日 发表日期: 2012年12月20日
张聪等, 2012, 甘薯块根储藏蛋白(Sporamin)启动子克隆及功能验证, 分子植物育种(online) Vol.10 No.70 pp.1511-1517 (doi: 10.5376/mpb.cn.2012.10.0070)
引用格式(英文):
Zhang et al., 2012, Cloning and Sequence Analysis of the Promoter of Sporamin Gene from Sweetpotato (Ipomoea batatas) , Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.70 pp.1511-1517 (doi: 10.5376/mpb.cn.2012.10.0070)
提取甘薯“川薯34”总DNA,设计引物,通过高保真PCR扩增获得了长为1 144 bp的甘薯储藏蛋白(Sporamin)基因启动子SpoA-p。PLACE在线分析表明:Sporamin启动子具有基本的启动子元件CAAT- box,并包含大量与储藏蛋白表达相关、抗逆相关及蔗糖表达相关的功能组件。构建植物表达载体pBISpoA-p::GUS、农杆菌工程菌株EHA105:pBI-SpoA-p::GUS后导入烟草及甘薯,分别得到15株烟草和10株甘薯的阳性转基因植株,GUS染色分析表明烟草各部位中只在根中有基因表达,甘薯根、茎和叶各部位未检测到活性。5%蔗糖诱导处理24 h后,在烟草根、茎及叶均观察到GUS活性;在甘薯中只有根有GUS活性。因此,可以看出此启动子为甘薯根部特异的表达启动子,并受蔗糖诱导而表达。
甘薯储藏蛋白(Sporamin)是一类块根特殊蛋白质,于1985年由Maeshima发现,存在于甘薯块根中而其他器官中则无(Maeshima et al., 1985),占块根可溶性蛋白的60%~80%,在植物块根中以单体的形式出现,与马铃薯中的Patatin蛋白以及薯蓣中的Discorin蛋白同属变态根茎器官中的特异贮藏蛋白(Racuseu and Foote, 1980; Harvey and Boulter, 1983)。储藏蛋白分为A、B两个亚族:Sporamin A和Sporamin B (Hattori et al., 1989; Murakami et al., 1986),每个亚基因家族都包含6个以上的成员(Wettstein and Chua, 1987),两类亚基因家族内的同源性为94%~ 98%,而家族间的同源性为82%~84% (Wettstein and Chua, 1987)。
Sporamin的表达具有块根特异性,与块根形态器官的发生有着密切的关系(Hattori and Nakamura, 1988; Hattori et al., 1991; Ohto et al., 1992; Takeda et al., 1995),同时受到植株发育阶段和光合产物的调控。Sporamin是甘薯块根特异贮藏蛋白,其启动子也应具有块根特异性,克隆到该启动子,就可以构建外源基因在甘薯块根中表达的载体,从而实现甘薯块根特异表达外源基因的目的。为此,本研究根据已知Sporamin A基因序列设计引物,通过PCR扩增获得了启动子片段,用克隆的启动子表达GUS基因并分析了该启动子在烟草和甘薯植株的表达特异性。
1结果与分析
1.1片段克隆及生物信息学分析
采用川薯34总DNA为模板进行PCR扩增,得到长为1 100 bp左右亮度较高的唯一条带,回收该DNA与载体PMD19-T连接,转化大肠杆菌JM109,经行蓝白斑筛选,挑取白斑培养并测序分析,得到了1 144 bp的SpoA-p片段(图1)。
图1 SpoA-p 的克隆 Figure 1 Clonging of SpoA-p |
PLACE数据库(A database of plant cis-acting regulatory DNA elements)在线分析表明:此启动子具有核心启动子元件CAATBOX1,豌豆豆球蛋白基因中此共有序列能控制组织特异性启动子的活性;元件SREATMSD跟蔗糖表达相关;959(-)CANBNNAPA含序列CNAACAC,是油菜储藏蛋白启动子核心组件,胚及胚乳中napin蛋白转录必须的调控因子,具有特异性;300(-)ELEMENT在大麦醇溶蛋白及小麦麦谷蛋白基因启动子的上游元件中也存在;959(-)2SSEEDPR OTBANAPA在很多储藏蛋白启动子中存在,与储藏蛋白基因Nap4启动子的高活性有重要的关联;ACGTATERD1和ABRELATERD1是干旱条件下黄化感应表达所必须的元件,转录调控因子ARR1AT曾在水稻非共生的血红蛋白启动子中发现;CACTFTPPCA1是C4植物叶片基因特异表达的顺式调控元件;359(-)WBOXNTERF3在转录抑制ERF3基因的启动子区发现存在,跟受创伤时激活此基因有关;265(-)CIACADIAN LELHC是西红柿生理节奏表达基因DE启动子的必须区域;950(-)DOFCOREZM是玉米Dof蛋白所需的核心位点,此蛋白质只含有1个锌指结构,是植物所特有的一类转录因子,其N末端保守的单锌指Dof结构域是既与DNA又和蛋白相互作用的双重功能域;同时还包含其他的功能组件(表1)。
.png)
表1 SpoA-p 启动子序列分析 Table 1 Prediction of the promoter of SpoA-p |
1.2载体构建
表达载体PBI121含启动子为CAMV35s的GUS基因,载体经HindⅢ及BamHⅠ双酶切CAMV35s后与SpoA-p相连,转化宿主细胞大肠杆菌JM109。提取阳性质粒DNA,再用HindⅢ及XbaⅠ双酶切检测,得到1 144 bp的SpoA-p片段,证明构建成功(图2)。
.png) 图2 双酶切鉴定pBI121-SpoA-p:gus Figure 2 Identification of pBI121-SpoA-p:gus by double digestion |
1.3烟草及甘薯转基因植株的获得
将含SpoA-p的农杆菌工程菌株导入烟草,经3 d共培养转入筛选培养基后叶片变成愈伤,愈伤经分化逐渐长出小苗,待其长至5 cm时切下转入生根培养基中,最终获得了20株抗性再生植株,筛选获得的抗卡那霉素的植株的再生过程见图3。
图3 转基因烟草的获得 Figure 3 Acquisition of transgenic tobacco plants |
将甘薯的叶片及茎段进行预培养后,与农杆菌工程菌株EHA105:pBI-SpoA-p::GUS进行浸染,30 min去除菌液并在滤纸上吸干,共培养3 d进入筛选培养阶段。14 d后叶片的边缘渐有突起,茎段两端开始膨大,形成愈伤组织,转入分化培养基上后愈伤分化出芽。随后幼苗叶片出现,将幼苗进行生根培养,最终得到了15株再生植株(图4)。
图4 转基因甘薯的阳性植株 Figure 4 Positive transgenic sweetpotato plants |
1.4转基因烟草及甘薯植株的分子检测
将阴性、阳性对照及样品DNA进行PCR扩增后,电泳检测有15株烟草跟阳性对照扩出同为1 000 bp的条带,阴性对照及另5株抗性植株未见条带,由此确定15株烟草被成功导入了SpoA-p;同样有10株甘薯被确定为阳性植株(图5)。
.png) 图5 再生植株PCR鉴定 Figure 5 Identification of regenerated plants by PCR analysis |
1.5转基因烟草及甘薯植株的GUS检测
将GUS染液内37℃浸泡过夜的阴性对照、甘薯及烟草的根、茎、叶分用95%乙醇脱色至阴性对照完全为白色,观察并照相。染色结果表明分子检测为阳性的烟草根染出了蓝色,茎、叶及对照的根、茎、叶均未发现蓝色出现(图6);而甘薯转基因植株及对照的各个部位都未染出蓝色。推测此启动子可能在甘薯块根储藏蛋白合成时期才能启动基因表达,具有时间表达特异性,GUS染色所检测的是再生试管苗,此阶段SpoA1不具活性。在储藏蛋白被合成时期,叶片中大量合成的糖份,是储藏蛋白合成的上游碳源(Hattori et al., 1991),故用5%蔗糖溶液对转基因植株进行了诱导。
图6 烟草转基因植株的GUS染色 Figure 6 GUS staining of transgenic tobacco plants |
1.6蔗糖诱导
将得到的转基因烟草植株放置于含5%蔗糖的培养基上诱导培养24 h后,取各部位的外植体染色,37℃过夜后发现GUS活性表达较高,整个染色液变成了蓝色,其茎、叶片及叶柄均全部被染色,根据阴性对照(a)及未脱背景色的阳性植株诱导前(b)后(c)的对比情况,可见对照(未转基因植株)毫无GUS表达(图7A)。将A中b、c用酒精脱去背景色后即为 B、C两图(图7),转入启动子后植株根变成了蓝色,茎、叶无变化,而经过5%蔗糖诱导后根(D)、茎(E)和叶(F)全部变蓝(图7)。将诱导前后的染色根在显微镜下观察,诱导后根GUS表达更高,蓝色较深(图7G; 图7H)。
 图7 烟草对照与转基因植株蔗糖诱导前后GUS染色情况 Figure 7 GUS staining of negative tobacco control, transgenic plants and sucrose-inducible transgenic plants |
对甘薯阳性植株进行GUS染色,根、茎和叶未染出任何颜色,经5%蔗糖诱导后根出现了蓝色,叶、茎未见蓝色出现(图8)。烟草及甘薯的蔗糖处理实验证明此启动子受蔗糖的诱导,为诱导型根特异表达启动子。
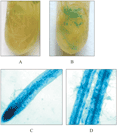 图8 甘薯转基因诱导前后GUS染色 Figure 8 GUS staining of transgenic sweet potato and sucrose- inducible transgenic sweet potato |
2讨论
本研究克隆了甘薯块根储藏蛋白特异启动子SpoA-p,分析表明SpoA-p含有启动子基本元件CAAT-box,储藏蛋白表达元件、蔗糖相关的顺式元件等。与GUS基因连接后转入烟草,转基因苗各器官染色时仅根部变为蓝色,可见启动子只在烟草根中有活性,具有根部特异性。将构建好的上述表达载体转入甘薯后,对阳性再生植株苗期进行GUS染色,未出现蓝色,推测这一启动子在甘薯中可能具有时间表达特异性,受储藏蛋白合成时期的相关物质的调控。
本研究利用5%蔗糖诱导转基因植株,GUS基因在烟草各个部位均强烈表达,甘薯中则只在根中出现蓝色,说明蔗糖诱导了此启动子表达。烟草与甘薯中的不同表象证实了SpoA-p属于蔗糖诱导性的根特异启动子。
SpoA-p是一个可诱导性的块根特异启动子,该启动子可以为植物块根特异表达系统研究提供帮助。有研究表明Sporamin含量与甘薯块根中淀粉含量呈正相关(Nakamura et al, 1991),本研究小组在淀粉合成相关基因的克隆及遗传转化有一定的研究基础,已成功的将AGPa1和AGPa2基因导入了甘薯中并得到了转基因植株,分析表明AGPase在甘薯中提高了活性,得到了超量的表达(张聪等, 2010; 郑雪莲等, 2011; 阎文昭等, 2010, 四川科学技术出版社, pp.99-127)。因此通过此启动子的研究能使淀粉合成相关基因在块根中得到特异表达,提高淀粉含量,探索块根淀粉、储藏蛋白的合成机理中的相互关系,为选育获得高淀粉新品种奠定基础。
3材料与方法
3.1块根储藏蛋白启动子的克隆
川薯34为实验材料提取总DNA,经电泳检测及紫外分光光度计分析。设计引物SpoA-p F:AAGCTTTGCCAAACAGAGCCTAAATCCATC,R:GGATCCTCATGGTGG CAGATGAGATGACAA,下划线的序列分别为引入的限制性内切酶HindⅢ、BamHⅠ的识别位点。PCR扩增片段,扩增条件为:94℃ 5 min,94℃ 1 min,56℃ 1 min 20 s,72℃ 1 min,30个循环。电泳检测PCR产物,回收片段与克隆载体PMD19-T连接,亚克隆测序。
3.2载体构建
用SpoA-p替代表达载体PBI121中的CaMV35s,启动GUS基因表达。用HindⅢ及BamHⅠ同时双酶切含有SpoA-p的PMD19-T及植物表达载体PBI121的质粒DNA,回收SpoA-p与PBI121大片段,T4酶连接,转入感受态细胞JM109中。挑取阳性克隆,提取质粒DNA,利用HindⅢ及BamHⅠ双酶切验证pBI-SpoA-p::GUS连接成功与否。采用根癌农杆菌EHA105构建工程菌株EHA105:pBI-SpoA-p::GUS。
3.3遗传转化
A烟草:取健壮烟草无菌苗的幼嫩叶片,去主脉,将叶片剪成0.5 cm2的小块。用农杆菌(EHA105:pBISpoA-p::GUS)感染后共培养3 d;移至含选择压卡那霉素(Kana, 购自北京天根生化科技有限公司)的分化培养基上分化出芽;在MS培养基上生根再生出完整植株。
B甘薯:将甘薯叶片在含20 μm/L的MS培养基上28℃预培养过夜,农杆菌工程菌株培养至OD值为0.3~0.5,侵染甘薯叶片30 min;无菌滤纸吸干多余菌液,接种至含有20 g/L Glucose、0.5 g/L MES及200 μm Acetosyingone共培养基上28℃暗培养3 d;后转入含有0.2 mg/L 2,4-D、0.2 mg/L Zeatin和 50 mg/L kana的筛选培养基上培养60~90 d;再移至Gibberellic acid 0.05 mg/L的分化培养基上进行再生植株的培养,获得kana抗性的甘薯植株。待幼苗长至5 cm左右移栽入土。
3.4转基因植株的分子检测
提取植株总DNA为模板,使用上海生工有限公司合成扩增长度为1 000 bp的GUS基因特异引物,F: 5'-TCTGGTATCAGCGCGAAGTCT-3', R: 5'-TGTCACGCGCTATCA GCTCT-3'。PCR方法扩增检测GUS基因,以质粒DNA为阳性对照,未转化的同一基因型植株总DNA为阴性对照。PCR采用25 μL反应体系:约50 ng DNA模板,2.5 μL 10×PCR Buffer,2 μL 2.5 mmol/L dNTPs,1.5 μL 25 mmol/L MgCl2, 5 μmol/L的上下游引物各1 μL,1 U Taq DNA聚合酶。PCR特异扩增程序为:94℃ 5 min,94℃ 1 min,56℃ 2 min,72℃ 1 min,30个循环。
3.5转基因植株的GUS染色
X-Gluc (5-bromo-4chloro-3-indolyl-b-D-glucuronic acid)购自北京天根生化科技有限公司,配制方法参考《现代植物生理学实验指南》。100 mg Gluc,先溶于1 mL的DMF,取80 mL 50 mmol/L的磷酸钠缓冲液(pH 7.0),加入1 mL 50 mmol/L铁氰化钾、1 mL 50 mmol/L亚铁氰化钾和2 mL 0.5mol/L EDTA (PH 8.0),再加入已溶解的Gluc,后加20 mL的甲醇,混匀后分装保存。分别取分子检测为阳性的烟草及甘薯转基因植株的根、茎、叶放入GUS染液内;同时以未转烟草及甘薯植株作为阴性对照同样放入GUS染液中,37℃过夜,用无水乙醇和酒精脱色观察染色结果。
作者贡献
张聪、郑雪莲、张婷是本研究的实验设计和实验研究的执行人;蒲志刚完成项目的构思、试验结果分析与论文修改;吴洁,谭文芳,王大一参与项目的构思及实验设计;阎文昭是项目负责人,指导实验设计、论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家现代农业甘薯产业技术体系建设专项资金(CARS-11-B-04),四川省农作物育种攻关项目甘薯育种子课题(2011-2015),四川省基因工程育种项目(2011-2015)和国家自然科学基金资助项目(31000735)资助。感谢四川省农业科学院生物技术核技术研究所陈克贵博士在本实验及论文修改中的帮助。感谢评审人对本论文的评审建议和修改建议。
参考文献
Harvey P.J., and Boulter D., 1983, Isolation and characterization of the storage protein of Yam tubers (Dioscorea rotundata), Phytochemistry, 22(8): 1687-1693
http://dx.doi.org/10.1016/S0031-9422(00)80252-6
Hattori T., and Nakamura K., 1988, Genes coding for the major tuberous root protein of sweet potato: identification of putative regulatory sequence in the 5' upstream region, Plant Molecular Biology, 11(4): 417-426
http://dx.doi.org/10.1007/BF00039022
Hattori T., Fukumoto H., Nakagawa S., and Nakamura K., 1991, Sucrose induced expression of genes coding for the tuberous root storage protein sporamin of sweet potato in leaves and petioles, Plant Cell Physiol., 32(1): 79-86
Hattori T., Yoshida N., and Nakamura K., 1989, Structural relationship among the members of a multia gene family coding for the sweet potato tuberous root storage protein, Plant Mol. Biol., 13: 563-572
http://dx.doi.org/10.1007/BF00027316 PMid:2491673
Maeshima M., Sasaki T., and Asahi T., 1985, Characterization of major proteins in sweet potato tuberous root, Phytochemistry, 24(9): 1899-1902
http://dx.doi.org/10.1016/S0031-9422(00)83088-5
Murakami S., Hattori T., and Nakamura K., 1986, Structural differences in full-length cDNAs for two classes of sporamin, the major soluble protein of sweet potato tuberous roots, Plant Molecular Biology, 7(5): 343-355
http://dx.doi.org/10.1007/BF00032564
Nakamura K., Ohto M., Yoshida N., and Nakamura K., 1991, Sucrose-inducible accumulation of β-amylase occurs concomitant with the accumulation of starch and sporamin in leaf petiole cutting so sweet potato, Plant Physiol., 96: 902-909
http://dx.doi.org/10.1104/pp.96.3.902 PMid:16668273 PMCid:1080863
Ohto M., Nakamura-Kito K., and Nakamura K., 1992, Induction of expression of genes coding for sporamin and β-amylase by polygalacturonic acid in leaf petiole cuttings of sweet potato, Plant Physiol., 99(2): 422-427
http://dx.doi.org/10.1104/pp.99.2.422 PMid:16668901 PMCid:1080478
Racuseu D., and Foote M., 1980, A major soluble glycoprotein of potato tubers, J. Food. Biochem., 4(1): 43-52
http://dx.doi.org/10.1111/j.1745-4514.1980.tb00876.x
Takeda S., Kowyama Y., Takeuchi Y., Matsuoka K., and Nishi- mura M., 1995, Spatial patterns of sucrose-inducible and polygalacturonic acid-inducible expression of genes that encode sporamin and rβ-amylase in sweet potato, Plant Cell Physiol., 36(2): 321-333
Wettstein D.V., and Chua N.H., 1987, Plant molecular biology: proceedings of a NATO advanced study institute on plant molecular biology, Plenum Press, NewYork, pp.66
Zhang C., Zheng X.L., Pu Z.G., Wang D.Y., and Yan W.Z., 2010, Cloning of Two α-subunit genes of ADP-glucose pyrophosphorylase from sweet potato and plant expression cassettes construction, Xi'nan Nongye Xuebao (Southwest China Journal of Agricultural Sciences), 23(3): 619-624 (张聪, 郑雪莲, 蒲志刚, 王大一, 阎文昭, 2010, 甘薯ADP-葡萄糖焦磷酸化酶两个α亚基基因的克隆分析和植物表达载体的构建, 西南农业学报, 23(3): 619-624)
Zheng X.L., Zhang C., Wu J., Pu Z.G., Wang D.Y., and Yan W.Z., 2011, Over expression of two α-subunit genes of ADP-glucose pyrophosphorylase in sweet potato, Xi'nan Nongye Xuebao (Southwest China Journal of Agricultural Sciences), 24(1): 29-33 (郑雪莲, 张聪, 吴洁, 蒲志刚, 王大一, 阎文昭, 2011, 两个ADP-葡萄糖焦磷酸化酶α亚基基因在甘薯中的超量表达, 西南农业学报, 24(1): 29-33)