青海省农林科学院, 西宁, 810016
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2010 年, 第 8 卷, 第 2 篇 doi: 10.5376/mpb.cn.2010.01.0002
收稿日期: 2010年05月14日 接受日期: 2010年06月12日 发表日期: 2010年09月26日
Liu et al., 2010, Development of Bt rice by molecular marker-assisted selection and assays for insect-resistance, Molecular Plant Breeding (online) Vol.1 No.2 (doi: 10.5376/mpb.2010.01.0002)
水稻种质9311和辐恢838分别是中国两系杂交水稻和三系杂交水稻的优良的亲本材料。水稻螟虫等鳞翅目虫害使中国水稻(含杂交水稻)严重减产。本研究利用分子标记辅助选择,并结合田间涂抹除草剂等抗虫鉴定,将三种Bt基因(cry1Ac, cry1C*和cry2A*)分别导入9311和辐恢838中,培育出9311和辐恢838遗传背景相似且带有不同抗螟虫基因的水稻新品系。同时,对新材料进行田间抗虫鉴定与农艺性状考察。结果表明,与对照相比,培育的新材料对稻纵卷叶螟具有良好的抗性,并且农艺性状表现良好。
水稻种质9311和辐恢838分别是非常优良的两系和三系杂交稻的亲本材料,配合力优势明显。但是其配合出的优良杂交稻容易被日益加重的虫害所影响,特别是鳞翅目螟虫类等,一直影响水稻的产量和品质。近几年,虫害威胁程度逐年升高。转基因抗虫技术是近些年兴起的一种新的害虫防治技术。这种转基因作物可以表达一种细菌苏云金芽胞杆菌(Bacillus thuringiensis简称Bt)来源的杀虫蛋白。该杀虫蛋白经过害虫胃肠道的特殊酶水解后,专一的与鳞翅目等害虫胃肠道的受体位点进行识别与结合(Hofmann et al., 1988a; Hofmann et al. 1988b; van Rie et al., 1989; van Rie et al., 1990)。毒性蛋白与受体结合以后,毒性蛋白的部分结构在受体的帮助下插入细胞膜中,并在细胞膜上形成孔道,有研究已经提出一些形成孔道的模型。(Knowles, 1994; Schwartz et al., 1997; Gazit et al., 1998; Schnepf et al., 1998)。最终导致害虫胃肠道穿孔,杀死害虫。
晶体蛋白基因家族(crystal protein gene, 简写Cry)属Bt毒性蛋白的一类,应用非常广泛。本试验利用的三种Bt 基因(cry1Ac, cry1C*和cry2A*)的抗虫性及安全性评价前人已做过相关报道,对鳞翅目害虫具有极佳的毒杀性。经研究表明,以上所有的三种转基因Bt水稻的茎杆均可以在5天内完全杀死接种的一龄三化螟(Tang等, 2006; Chen等, 2005)。Cry1Ac作为第一代Bt杀虫基因,其抗虫性已广泛接受认可。转Cry1Ac家系的叶片Cry1Ac蛋白含量为11.09±0.35 µg/g鲜叶重(陈浩, 2005) Cry1Ac蛋白占叶片总可溶蛋白的0.02%。Cry2A*和Cry1C*为第二代Bt杀虫基因,Cry2A*毒性蛋白的含量为84.94±2.34 µg/g~138.75±4.32 µg/g鲜叶重,Cry2A*家系叶片中Cry2A*蛋白占叶片总可溶蛋白的0.22%~0.32% (Chen等, 2005)。Cry1C*蛋白的含量虽较少为(Tang等, 2006) 1.46 μg/g鲜叶重,但由于其靶向性强,因此同样对鳞翅目害虫有极强的杀伤能力。作为第二代Bt杀虫基因,这两种Bt杀虫基因表达毒蛋白量具有更好的靶向性,能够更加特异的结合靶位点,在不给植株带来过高的负担的同时,又能高效的杀死鳞翅目害虫,达到了非常理想的效果。Bt毒蛋白表达的专一性极高,只在水稻叶片和茎秆中有高量表达,而在种子中几乎不表达,用Real-time等方法均检测不到毒性蛋白的表达,因此,以上三种Bt基因可以安全应用。
利用Bt毒蛋白可以有效地杀死危害水稻的鳞翅目等害虫,减轻其对水稻的危害。目前,Bt毒蛋白作为一种生物杀虫剂在农业上已经使用了60多年,同时,Bt作物在农业上的使用可以大幅度的减少杀虫剂的使用量,这不仅直接降低了种植者的种植成本,而且对保护人类的健康和生态环境都有积极的意义。
在上世纪50年代,Bt杀虫剂逐渐开始在美国兴起(Martin和Travers, 1989)。至1995年,有182种Bt制剂在美国环保署(US Environmental Protection Agency, EPA)注册。1987年,公开报道获得了第一批Bt转基因植物(Barton et al., 1987; Fischhoff et al., 1987; Vaeck et al., 1987)。1995年,转Bt作物首次在美国和加拿大实现了商品化。2004年,全球Bt作物的种植面积达到了2240万公顷(James, 2004)。华中农业大学于2009年11月份获得转cry1Ab/c基因华恢1号和Bt汕优63的安全证书。
本试验利用分子标记辅助选择将三种Bt基因(cry1Ac, cry1C*, cry1C*)导入到9311和辐恢838中,为即将到来的转Bt基因抗虫品种商品化应用提供材料资源和理论依据。
1结果与分析
1.1分子标记辅助选择筛选阳性纯合家系
由于设计的Bt基因引物为显性标记,因此筛选纯合家系则要通过田间涂抹除草剂观察与分子标记辅助选择结合来验证。纯合家系既要满足家系内24株在田间除草剂表现为抗性,又要保证家系内24株PCR产物经琼脂糖电泳后均有阳性条带。每个Bt基因(cry1Ac, cry1C*和cry2A*)均筛选到超过2个家系的纯合家系。部分筛选阳性纯合家系图片如图1。

图1 PCR检测cry1C*, cry2A和cry 1Ac*基因纯合家系的结果
注:1~24:家系内的24个单株,中间为阴性对照
Figure 1 PCR detection results of cry1C*, cry2A and cry 1Ac* homozygous lines
Note:1~24:24 homozygous individuals and the control was in the middle
1.2田间抗虫性结果
研究结果显示,在2009年田间发虫不重的情况下,稻纵卷叶螟对对照9311和辐恢838的危害较轻,卷叶率均为10% (表1),而三种Bt基因(cry1Ac, cry1C*和cry2A*)分别在9311和辐恢838背景下对稻纵卷叶螟均表现出较高的抗性,除了9311 (cry2A*)家系出现个别叶片被取食情况,其余所有Bt基因家系均无受损叶片出现,特别是辐恢838的各个转基因家系如辐恢838(LX111),辐恢838(LX83),辐恢838(LX124)均表现出对稻纵卷叶螟完全抗性,无被取食的情况。结果与Tang等(2006)和Chen等(2005)的研究结果表现基本一致。
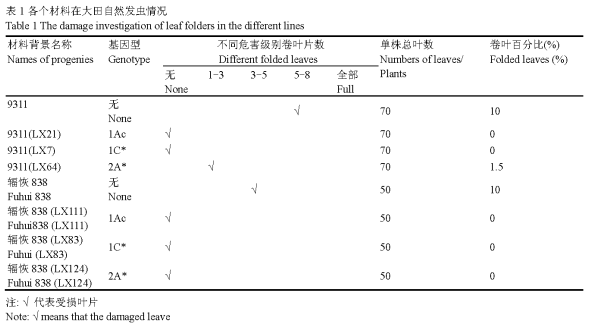 表1 各个材料在大田自然发虫情况 Table 1 The damage investigation of leaf folders in the different lines 注: √代表受损叶片 Note: √ means that the damaged leaves |
1.3农艺性状考察结果
由表2可以看出,含有Bt基因(cry1Ac, cry1C*和cry2A*)的各个品系农艺性状均表现良好,很多家系在单株实粒数、单株产量等农艺性状上较对照有明显提升,如LX83 (辐恢838/1C*)家系在单株实粒数、单株产量和每穗实粒数均较对照有显著提升。
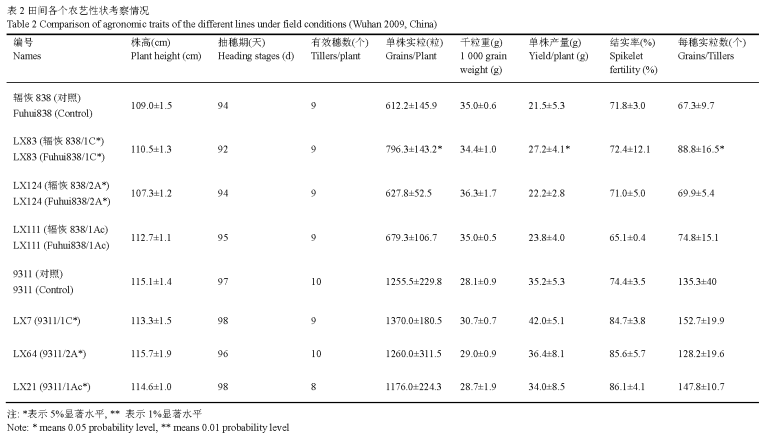 表2 田间各个农艺性状考察情况 Table 2 Comparison of agronomic traits of the different lines under field conditions (Wuhan 2009, China) 注: *表示5%显著水平, ** 表示1%显著水平 Note: * means 0.05 probability level, ** means 0.01 probability level |
2讨论
本试验通过分子标记辅助选择及田间抗虫鉴定,将Bt基因(cry1Ac, cry1C*和cry2A*)导入到以上两个品种中,转育出具有抗虫性的抗虫新品系。
从田间抗虫鉴定的情况看,转育后得到的各基因型品系对螟虫具有极高的抗性,可以看到,cry1Ac、cry1C*基因表现出对螟虫特别是稻纵卷叶螟完全的抗性,其中,cry2A*基因对螟虫特别是稻纵卷叶螟表现出较强的抗性,有个别叶片遭到损害,这个结果与前人(Chen等, 2005)发表的结果相一致。
从农艺性状考察的结果看,转Bt基因(cry1Ac, cry1C*和cry2A*)的各个家系各个农艺性状与原始9311和辐恢838基本没有差异,同时在大田自然发虫的情况下,大部分转Bt基因(cry1Ac, cry1C*和cry2A*)家系比对照在各个农艺性状上都有优势,但是,有个别性状和个别转Bt基因家系比对照没有体现出明显的优势。一方面,由于武汉2009年螟虫和稻纵卷叶螟等害虫发虫并不是很严重;另一方面,由于螟虫和稻纵卷叶螟等害虫发虫主要出现在抽穗期以后,因此它们对水稻的危害适当的减轻。以上两个因素可能是个别转Bt基因家系比对照没有体现出明显优势的原因。
本研究的目的在于对本重点实验室设计合成的三个Bt基因(cry1Ac, cry1C*和cry2A*)进行转育并评价其表现;分子标记辅选择进行辅助育种,可大大提高育种的效率,同时华中农业大学于2009-11获得转Bt基因华恢1号和Bt汕优63安全证书,此安全证书批准的Bt为第一代Bt基因(cry1Ab/c),本研究也是建立在此基础上,同时利用本实验室合成的第二代Bt基因(cry1C*和cry2A*)进行转育,为即将到来的Bt基因商品化应用提供后备资源;绿色超级稻是张启发在2009年提出的水稻战略设想(Zhang, 2009),归纳起来为在不断提高产量和品质的基础之上,实现基本不打农药,大量少施化肥和抗旱节水的目标。本研究的目的是绿色超级稻实施策略的第一步,即通过转基因的技术,借助分子标记辅助选择,利用外缘基因实现水稻获得对危害其生长发育及产量的害虫抗性。
3材料与方法
3.1供试材料
本试验研究的水稻材料为(1)供体亲本为本重点实验室已构建好的Bt材料明恢63 (cry1Ac)、明恢63 (cry1C*)和明恢63 (cry2A*) (Tang等, 2006; Chen等, 2005)。(2)受体亲本为我国杂交水稻两系和三系优良亲本材料9311和辐恢838,分别引自江苏里下河地区农业科学研究和四川省原子核应用技术研究所。
3.2分子标记辅助回交的技术路线
利用本实验室已有的转Bt材料明恢63 (cry1Ac)、明恢63 (cry1C*)和明恢63 (cry2A*)作为供体亲本,以9311和辐恢838分别作为受体亲本,通过杂交并以受体亲本作为轮回亲本进行三代的回交,获得背景与轮回亲本一致的转Bt基因家系,最后通过自交一代来获得纯合转Bt基因家系。
3.3田间种植
将回交三代,自交一代的转Bt (cry1Ac, cry1C*和cry2A*)基因的家系随机种植,每个家系种植24株,对照亲本同样随机种植于转Bt基因家系中,共计80个转Bt基因家系。单株之间间隔为16.5 cm×19.8 cm,家系之间间隔为39.6 cm。
3.4分子标记
检测用到的不同Bt基因引物序列与Tang等(2006)和Chen等(2005)文献中利用的引物序列一致,退火温度统一为57℃,Bt基因引物序列设计为显性标记,只能鉴定阳性植株。
3.5 PCR分子标记检测及琼脂糖凝胶电泳检测
水稻叶片总DNA的提取方法采用CTAB法(Murray and Thompson, 1980)。
PCR反应程序:第1步94℃ 4 min 变性,第2步94℃ 50 s 变性,第3步57℃ 50 s 退火,第4步72℃ 55 s延伸,第5步72℃ 7 min延伸,第6步25℃ 1 min 终止冷却,第2步到第5步共32个循环。利用3%的琼脂糖凝胶电泳检测(250V, 30 min)。
3.6田间抗虫鉴定及农艺性状考察
抗虫鉴定:抽穗期,对所有转基因家系及亲本对照进行自然发虫的虫害(稻纵卷叶螟)考察,每个家系观察所有的24株,对虫害情况进行记录。
农艺性状考察:随机选取各个转Bt (cry1Ac, cry1C*和cry2A*)基因家系,每个基因型选取两个纯合家系,每个纯合家系随机选取5株进行考种。
作者贡献
刘鑫是本研究的实验设计、执行以及稿件编写的主要执行人。杨宙参与构建供体亲本材料:Bt材料明恢63 (cry1Ac)、明恢63 (cry1C*)和明恢63 (cry2A*)。高冠军执行田间管理工作。林拥军是cry1C*和cry2A基因的专利所有人。朱雪萍和余建友参与标记选择工作。何予卿是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金,科技部863计划和植物转基因专项共同资助。
参考文献
Chen H., Tang W., Xu C.G, Li X.H., Lin Y.J., Zhang Q., 2005, Transgenic indica rice plants harboring a synthetic cry2A* gene of Bacillus thuringiensis exhibit enhanced resistance against rice lepidopteran pests, Theor. Appl. Genet., 111: 1330-1337 doi:10.1007/s00122-005-0062-8
Fischhoff D.A., Bowdish K.S., Perlak F.J., Marrone P.G., McCoormick S.M., Niedermeyer J.G., Dean D.A., Kusano K.K., Mayer E.J., Rochester D.E., Rogers S.G., Fraley R.T., 1987, Insect tolerant transgenic tomato plants, BioTechnology, 5: 807-813 doi:10.1038/nbt0887-807
Gazit E., la Rocca P., Sansom M.S.P, Shai Y., 1998, The structure and organization within the membrane of the helices composing the pore-forming domain of Bacillus thuringiensis δ-endotoxin are consistent with an “unbrella-like” structure of the pore, Proc. Natl. Acad. Sci. USA, 95:12289-12294 doi:10.1073/pnas.95.21.12289
Hofmann C., Luthy P., Hutter R., Pliska V., 1988b, Bingding of the delta-edotoxin from Bacillus thuringiensis to brush-border membrane vesicles of the cabbage butterfly (Pieris brassicae), Eur. J. Biochem., 173:85-91 doi:10.1111/j.1432-1033.1988.tb13970.x
Hofmann C., Vanderbruggen H., Hofte H., Van Rie J., Jansens S., Van Mellaert H., 1988a, Sepcificity of Bacillus thuringensis δ-endotoxins is correlated with the presence of high-affinity binding sites in brush-border membrane of target insect midgets, Proc. Natl. Acad. Sci., USA, 85: 7844-7848 doi:10.1073/pnas.85.21.7844
James C., 2005, Global status of commercialized biotech/GM Crops: ISAAA Knowles B.H., 1994, Mechanism of action of Bacillus thuringiensis insecticidal proteins, Adv Insect Physiol, 24: 275-308
Martin P.A.W., Travers T.S., 1989, Worldwide abundance and distribution of BT isolates, Appl. Environ. Microbiol., 55: 2437-2442
Murray M.G., Thompson W.F., 1980, Rapid isolation of high molecular weight plant DNA, Nucleic. Acids. Res., 8:4321-4325 doi:10.1093/nar/8.19.4321
Schwartz J.L., Juteau M., Grochulski P., Cygler M., Prefontaine G., Brousseau R., Masson L., 1997, Restriction of intramolecular movements within the Cry1Aa toxin molecules of Bacillus thuringensis through disulfide bod engineering, FEBS Lett., 410: 397-402 doi:10.1016/S0014-5793(97)00626-1
Schnepf E., Crickmore N., Van Rie J., Lereclus D., baum J., Feitelson J., Zeigler D.R., Dean D.H., 1998, Bacillus thuringiensis and its pesticidal crystal protein, Microbial Mol. Biol. Rev., 62: 775-806
PMid:9729609 PMCid:98934
Vaeck M., Reynaerts A., Höfte H., Jansens S., Beukeleer M.D., Dean C., Zabeau M., Montagu M.V., Leemans J., 1987, Transgenic plants protected from insect attack, Nature, 328:33-37 doi:10.1038/328033a0
Van Rie J., Jansens S., Hofte H., Degheele D., Van Mellaert H., 1989, Specificity of Bacillus thuringiensis delta-endotoxins. Importance of specific receptors on the brush border membrane of the mid-gut of target insects, Eur. J. Biochem., 186: 239-247 doi:10.1111/j.1432-1033.1989.tb15201.x
Van Rie J., McGaughey W.H., Johnson D.E., Barnett B.D., Van Mellaert H., 1990, Mechanism of insect resistance to the microbial insecticide Bacillus thuringiensis, Science, 247: 72-74 doi:10.1126/science.2294593
Tang W., Chen H., Xu C.G., Li X.H., Lin Y.J., Zhang Q.F., 2006, Development of insect-resistant transgenic indica rice witha synthetic cry1C* gene, Mol. Breeding, 13: 301-312
Zhang Q.F., 2007, Strategies for developing Green Super Rice, Proc. Natl. Acad. Sci., USA, 104: 16402-16409 doi:10.1073/pnas.0708013104