2.浙江农林大学林业与生物技术学院, 浙江, 311300br> 3.云南红河群鑫石斛种植有限公司, 云南, 661200br>
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 83 篇 doi: 10.5376/mpb.cn.2011.09.0083
收稿日期: 2011年05月20日 接受日期: 2011年06月20日 发表日期: 2011年06月27日
孟衡玲等, 2011, 三种提取铁皮石斛叶片总RNA方法的比较, 分子植物育种 Vol.9 No.83 (doi: 10.5376/mpb.cn.2011.09.0083)
在提取富含多糖类植物组织RNA时,如何有效去除多糖类物质污染是一个首要问题,本文采用普通TRIZOL法、试剂盒法和"去多糖辅助剂+TRIZOL"三种方法提取铁皮石斛幼嫩叶片总RNA,试验结果表明:采用"去除多糖辅助剂+TRIZOL"能够提出的RNA浓度较高、DNA含量很低,有明显的三条带,经纯化后RNA的OD值为1.8~2.0之间,RNA质量及浓度较好,经济实惠。
铁皮石斛Dendrobium officinale Kimura et Migo属兰科orchidaceae石斛属Dendrobium植物,为石斛中的极品,是传统名贵的中药材,多糖是其主要活性成分,是防老抗衰、养颜驻容、养肝明目的上等保健药品。由于铁皮石斛植物组织中多糖含量高于17.76%~29.19% (刘宏源等, 2010),严重影响了RNA的提取,纯度高、质量好的RNA是进行相关分子生物学研究的前提和关键(李宏和王新力, 1999)。现已有很多文献报道了关于去除RNA中多糖的一些方法,主要有:①在提取的RNA中加入高浓度盐,改变多糖的溶解特性,通过苯酚、氯仿等有机溶剂抽提去除(Fang et al., 1992);②通过LiC1选择沉淀RNA,使部分多糖留在上清液中(Su and Gibor, 1988; 葛晓萍和石琰璟, 2007; 岑鹏等, 2009);③用低浓度乙醇选择沉淀多糖(10%~30%),而RNA仍保留于溶液中(Tesniere and Vayda, 1991; Lewinsohn et a1., 1994; 顾红雅等, 1995; Hu et al., 2002);④无水乙醇和5mol/L醋酸钾溶液配合以去除多糖杂质(朱昀等, 2007);⑤采用有机溶剂乙二醇丁醚(周波等, 2004)、2-丁氧乙醇(何振艳等, 2005)、乙醚(袁明珠等, 2005)等去除多糖,虽然这些方法在很多植物上都有成功的报道,但由于不同植物及相同植物的不同组织间在物质组成上千差万别,因此一种方法仅适用于某种或某类材料,对于特殊的植物材料,理想的RNA提取方法是在探索中逐渐完善的。
本研究以多糖含量高的铁皮石斛叶片为材料,采用3种不同的方法提取总RNA,高质量的RNA是进行后续分子生物学研究的基础,并为其他富含多糖类植物RNA的提取提供借鉴。
1结果与分析
1.1总RNA的电泳检测
由于在提取铁皮石斛RNA时,RNA被大量的多糖包裹而损失,导致提取的RNA浓度较低,不能满足RNA需求量大的实验,因此,本研究以普通的TRIZOL法提取的RNA浓度及纯度为对照,比较三种方法提取的RNA质量。
普通的TRIZOL法提取总RNA:在加入氯仿抽提离心后,上清液粘稠,离心后不能很好的和中间层有机相分离,因此,在离心过程中无法去除多糖,最后一步加DEPC处理水溶解时底部出现大量不溶黏性物质,经电泳检测,没有RNA(图1A)。
百泰克公司通用植物总RNA提取试剂盒提取的总RNA有两条完整的带,但带较弱,略有降解,DNA含量高(图1B),经纯化后,RNA的浓度很低,满足不了RNA需求量大的实验。
TIANGEN RNAprep pure Plant Kit提取的RNA中有两条较完整的带,但DNA含量较高(图1C),在后续的DNA消化中往往消化不完全,且RNA的含量都很低,只有100 ng/µL~200 ng/µL,经纯化后RNA含量很低,几乎检测不到,给RNA的定量及一些实验带来了很大的困难。
去多糖辅助剂+TRIZOL法提取的RNA浓度较高,有三条完整的带,且RNA的浓度较高,是试剂盒法的2~3倍,DNA污染小在琼脂糖凝胶电泳中几乎看不到(图1D),纯化后OD值在1.8~2.0之间,三种方法提取的RNA浓度及纯度见表1。
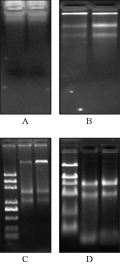 图1 A: 普通TRIZOL法; B: 百泰克试剂盒; C: TIANGEN试剂盒; D: “去多糖辅助剂+TRIZOL”法 Figure 1 A: Common TRIZOL method; B: BIOTEKE kit; C: TIANGEN kit; D: Removing polysaccharides assistant plus TRIZOL |
|
表1 3种方法提取的铁皮石斛总RNA的平均浓度和纯度 Table 1 Total RNA purity and quantity of Dendrobium officinale by three methods |
1.2 PCR扩增
对三种方法提取的RNA反转录成cDNA,用F1和R1特异引物进行PCR扩增,扩增结果(图2),第三种方法提取的RNA质量最好,PCR扩增出的条带最清晰,其次是试剂盒法,而普通TRIZOL法没有扩增出条带。
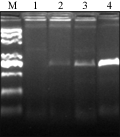 图2 铁皮石斛部分序列PCR扩增结果 注: M: Marker; 1: 普通TRIZOL法; 2: BIOTEKE试剂盒法; 3: TIANGEN试剂盒法; 4: “去多糖辅助剂+TRIZOL”法 Figure 2 The part of sequence of PCR amplification Note: M: Marker; 1: Common TRIZOL method; 2: BIOTEKE kit method; 3: TIANGEN kit method; 4: “Removing polysaccharides assistant+TRIZOL” method |
2讨论
有关植物组织中RNA提取方法的报道已很多,最常用的有胍法、苯酚法和CTAB (十六烷基三乙基溴化铵)法等,这些方法已广泛用于许多植物组织中RNA的提取。但有某些植物组织所含物质种类极为复杂,尤其是在富含多糖、多酚及一些尚未能确定的次生代谢产物等情况下,RNA提取的产量和纯度常受到影响。由于多糖与RNA 间的理化性质很相似,常以复合体形式存在,不易分开(Logemanny et al., 1987)。在去除多糖的同时,大量的RNA也被裹走了,造成RNA的产量减少和降解,而沉淀的RNA中也有凝胶状沉淀,难溶于水,或溶解后溶液粘稠(Lewinsohn et al, 1994),由于多糖的污染,使RNA溶解困难,定量不准,甚至抑制下游酶的反应活性(Fang et al., 1992),因此,如何从富含多糖的植物组织中提取高质量RNA很关键。
在本实验中,采用常规方法提不出RNA,主要原因在于初提时上清液粘稠,不能很好的和有机相分离,与铁皮石斛材料多糖含量较高有关。本研究采用的第三种(除多糖辅助剂+TRIZOL法)对于提取多糖含量高的植物组织较为有效,由于RNAiso-mate for Plant Tissue试剂中含有高分子聚合物,能够有效地与组织样品中的多糖结合,并可以在之后的离心步骤中除去,因此在初提时大量的RNA被释放出来,提取的RNA浓度是试剂盒的三倍左右,而且较试剂盒提取法经济实惠。因此,此方法可以从富含多糖的植物材料中提取高质量、高浓度的总RNA。
3材料与方法
3.1材料
采自云南省屏边县屏边群鑫石斛种植有限公司铁皮石斛种植园的一年生幼嫩叶片,从正在生长的植株上剪下后立即用液氮冷冻,-80℃冰箱保存。
3.2方法
3.2.1铁皮石斛RNA方法的提取
样品处理:取出上述保存的100 mg植物材料于DEPC处理过的研钵中,加入适量的PVPP于研钵中,迅速加入液氮研磨,直至磨成状,在其间保持研钵中都有液氮,将粉末装入干净的离心管中。
a TRIZOL法:采用TaKaRa 公司RNAiso Plus (D9108A),操作步骤按照说明书进行操作,取3 µL进行琼脂糖凝胶电泳。
b试剂盒法:分别采用TIANGEN RNAprep pure Plant Kit (DP432)和百泰克公司通用植物总RNA提取试剂盒 (RP3301),按照说明书进行操作,取3µL进行琼脂糖凝胶电泳。
c去多糖辅助剂+TRIZOL法:采用TaKaRa公司RNAiso-mate for Plant Tissue (D325S)及RNAiso Plus (D9108A)提取铁皮石斛总RNA,按照说明书进行操作。
3.2.2总RNA的反转录及纯化
提取总RNA中DNA的去除采用fermentas公司RNase free 的DNaseⅠ,建立100 µL的酶解体系(10 µg RNA, 10 µL DNaseⅠ, 10 µL 10×buffer, 用RNase free water补齐),混匀,37℃水浴30 min,加10 µL 25 mmol/L EDTA, 65℃水浴10 min。 加RNase free water 至420 µL,加水饱和酚:氯仿:异戊醇( 25:24:1) 400 µL抽提,取上清液至另一个干净的离心管中,加氯仿:异戊醇(24: 1) 400 µL抽提,移上清至离心管加1/10体积3 mol/L Na AC (pH 5.2)和1 mL无水乙醇,-20℃放置过夜;4℃,12000 r/min离心30 min,弃上清液,用75﹪乙醇和无水乙醇各清洗沉淀1次,室温下干燥;沉淀溶于30 µL DEPC水中,-80 ℃冻存。
3.2.3 RNA凝胶电泳检测
0.5 x TBE作为电泳缓冲液,电压120V,琼脂糖凝胶浓度为1%,取3 µL RNA进行电泳检测。
3.2.4 RT-PCR检测
采用铁皮石斛特异引物F1:CGAGTCTCATACTGCCTTCACA;R1:ACCAGCCAAGGTCATCAATCTC,铁皮石斛的cDNA为模板进行PCR反应,其反应条件如下:94℃ 5 min,35个循环(94℃ 30 S,53℃ 30 S,72℃ 1 min),72℃ 10 min,反应体系25 µL (cDNA 1µL, 引物F1/R1 2 µL, 2×EasyTaq PCR SuperMix 12.5 µL, ddH2O 7.5 µL)。
致谢
本研究由云南省产业重大关键技术开发专项项目(云发改高技[2007]1718号),国家支撑计划项目(2011BAI13B02-5)资助。
作者贡献
孟衡玲是本研究试验设计、实验研究及论文初稿写作的执行人;杨生超,文国松,段承俐指导实验设计,数据分析,论文写作与修改,査应洪是项目合作者,为本研究提供大量的材料。
参考文献
Cen P., Pan L.J., Zhang M.B., Fan G.Q., and Cheng P., 2009, Preliminary study on extracting total RNA from polysaccharides-rich Dendrobium buds polysaccharides-rich Dendrobium buds, Guangdong Nongye Kexue (Guangdong agricultural science), 6: 162-164 (岑鹏, 潘丽晶, 张妙彬, 范干群, 程萍, 2009, 从富含多糖的石斛兰花蕾中提取总RNA初探, 广东农业科学, 6: 162-164)
Fang G., Hammars G., and Grumet R., 1992, A quick and inexpensive method for removing polysaccharides from plant genomic DNA, Bio Techniques, 13(1): 52-54, 56
PMid:1503775
Ge X.P., and Shi Y.J, 2007, A useful method for extracting RNA from plant tissues rich in polysaccharides and polyphenol, Qingdao Keji Daxue Xuebao (Journal of Qingdao University of Science and Technology (Natural Science Edition)), 28(1): 6-8 (葛晓萍, 石琰璟, 2007, 一种适合富含多糖, 多酚植物的RNA提取方法, 青岛科技大学学报(自然科学版), 28(1): 6-8)
Gu H.Y., Zhai L.J., and Ming X.T., eds, 1995, Plant gene molecular and operation, BeiJing university press, BeiJing, China, p.77-78 (顾红雅, 瞿礼嘉, 明小天, 编著, 1995, 植物基因与分子操作, 北京大学出版社, 中国, 北京, pp.77-78)
He Z.Y., Xu W.Z., Yang X. X., and Ma M., 2005, An effective method of total RNA isolation from a fern Plant-Pteris vittata L., Zhiwuxue Tongbao (Chinese Bulletin of Botany), 22(2): 198-202 (何振艳, 徐文忠, 杨学习, 麻密, 2005, 提取蕨类植物蜈蚣草总RNA的一种有效方法, 植物学通报, 22(2): 198-202)
Hu C.G., Honda C., Kita M., Zhang Z., Tsuda T. and Moriguchi T, 2002, A simple protocol for RNA isolation from fruit trees containing high levels of polysaccharides and polyphenol compounds, Plant Mol. Bio. Report, 20(1): 69-76 http://dx.doi.org/10.1007/BF02801935
Lewinsohn E, Steelecl C.L., and Croteau R., 1994, Simple isolation of functional RNA from woody stems of gymnosperms, Plant Mol. Bio Reptr., 12(1): 20-25 http://dx.doi.org/10.1007/BF02668660
Li H., and Wang X. L., 1999, The difficulties in the isolation of RNA from plant tissues and their resolving strategies, Shengwu Jishu Tongbao (Biotechnology information), 1: 36-39 (李宏, 王新力, 1999, 植物组织RNA提取的难点及对策, 生物技术通报, 1: 36-39)
Liu H.Y., Yang J.Y., Huang S., Huang B., and Lai X.P., 2010, Determination of polysacharide in dendrobium officinale by 3,5-dinitrosalicylic acid colorimetry, Asia-Pacific Traditional Medicine, 6 (8): 14-16 (刘宏源, 杨金燕, 黄松, 黄斌, 赖小平, 2010, 3,5-二硝基水杨酸法测定铁皮石斛中多糖的含量, 亚太传统医药, 6(8): 14-16)
Logemanny Y.J, Schell J., and Willmitzer L., 1987, Improved method for isolation of RNA from plant tissues, Anal. Brachem., 163(1): 16-20 http://dx.doi.org/10.1016/0003-2697(87)90086-8
Su X., and Gibor A., 1988, A method for RNA isolation from marine macroalgae, Anal Biochem, 174(2): 650-657
http://dx.doi.org/10.1016/0003-2697(88)90068-1
Tesniere C., and Vayda M.E., 1991, Method for the isolation of high quality RNA from grape berry tissues without contaminating tannins or carbohydrates, Plant Mol. Bio. Reptr., 9(3): 242-251 http://dx.doi.org/10.1007/BF02672074
Yuan M.Z., Wen R. Liu J.S., Jie Y.S., Li J.H., Yin H.P., Zeng Q.L., Long G., Yang D.H., Liu H., Huang S.Q., and Xu J., 2005, Isolation of total RNA from different plant species, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 3(2): 285-292(袁明珠, 温柔, 刘吉升, 揭英省, 黎金花, 尹汗萍, 曾秋莲, 龙刚, 杨德华, 刘海, 黄胜琴, 徐杰, 2005, 几种植物材料中总RNA的提取, 分子植物育种, 3(2): 285-292)
Zhou B., Zhang Y., and Li Y.H, 2004, Improvement of extraction method of total RNA from strawberry fruit with abundant polymeric carbohydrates, Shengwu Jishu Tongxun (Letters in biotechnology), 15(1): 48-50(周波, 张旸, 李玉花, 2004, 富含多糖草莓果实总RNA提取方法的改进, 生物技术通讯, 15(1): 48-50)
Zhu Y., Wang M., Jia Z.W., Lian Y., Jin Y., and Wang G.Y., 2007, An effective method for extracting total RNA from young ears of maize, Zhiwuxue Tongbao (Chinese Bulletin of Botany), 24(5): 624-628(朱昀, 王猛, 贾志伟, 练云, 金颖, 王国英, 2007, 一种从富含多糖的玉米幼穗中提取RNA的方法, 植物学通报, 24(5): 624-628)