 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 112 篇 doi: 10.5376/mpb.cn.2011.09.0112
收稿日期: 2011年09月21日 接受日期: 2011年09月23日 发表日期: 2011年10月25日
引用格式(中文):
张和臣等, 2011, 植物花朵呈色的分子机制, 分子植物育种(online) Vol.9 No.112 pp.1818-1823 (doi: 10.5376/mpb. cn.2011.09.0112)
引用格式(英文):
Zhang et al., 2011, The molecular mechanism of pigmentation in plant flower, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.9 No.112 pp.1818-1823 (doi: 10.5376/mpb.cn.2011.09.0112)
花色是观赏植物的重要属性。花色素是影响花朵呈色最主要的因子,其中天竺葵色素、矢车菊色素及花翠素等三类花色素是自然界中植物花朵呈色的最基本的三类花色素,它们决定了植物花朵分别呈现黄色、红色、蓝色的基础。一些植物花朵由于缺乏某种基本色素,从而缺少了某种基本花色。花色素的合成是由一系列酶参与的反应,受结构基因和调节基因协同调控。本文主要介绍了花色素的合成途径,并就近年来花色素合成途径中一些关键基因的功能研究进行了综述。
花色是观赏植物重要的观赏属性,花色的优劣直接关系到观赏植物的观赏价值和商业价值。自然界植物花的颜色繁多,有白色、黄色、红色、蓝色及其它复合色。但是一些重要商业花卉的色系却有限,如月季(Rosa chinensis)、香石竹(Dianthus caryophyllus)、郁金香(Tulipa gesneriana)、菊花(Chrysanthemum)等缺乏蓝色和紫色,天竺葵(Pelargonium hortorum)、仙客来(Cyclamen persicum)、非洲紫罗兰(Saintpaulia ionantha)、翠菊(Callistephus chinensis)等缺乏黄色,球根鸢尾(Dutch Iris)、紫罗兰(Matthiola incana)等缺乏猩红色或砖红色,因此花色改良一直是育种工作者追逐的重要目标之一(赵云鹏等, 2003; 孟丽和戴思兰, 2005)。研究表明,植物花色在形成机制上极为复杂,既有环境因素,也有自身遗传因素,是多种因子相互作用的结果,但是起决定作用的是自身遗传因素。如果我们想定向对某种观赏植物的花色进行遗传改良,传统育种技术就显得力不从心。我们可以通过分子生物学的手段对决定植物某种花色的的基因进行整合或修饰,以期在较短时期内培育出具有稳定遗传的新花色品种(韩科厅等, 2008; Tanaka et al., 2010)。因此研究植物花朵呈色的分子机制具有重要意义。对花色形成的分子机理已经进行了深入研究,许多与花色相关的基因已经被克隆和鉴定。本文主要综述近年来花朵呈色机制的一些研究进展。
1花色形成的分子基础
花色作为一些观赏植物的重要观赏性状之一,是园林植物科研工作者重点研究的一个方向。随着现代生物科学及信息科学技术的发展,近年来在植物花色形成的生理及分子机制上已经取得了重要突破。研究发现,植物花色是多种因子协同作用的结果,但在根本上是由特定色素在花瓣细胞中的存在比例决定的(Winkel-Shirley, 2001; Springob et al., 2003)。植物花朵中主要含有三大类色素,即类黄酮、类胡萝卜素及生物碱类,其中类黄酮是呈现花色的主要色素。参与花色形成的类黄酮主要有两大类:一类是花色素,这是一类水溶性色素,产生的颜色范围是从红色到紫色;另一类是黄色2-苯甲川基苯呋喃酮。在被子植物中,大约88%科的植物花色是由花色素来决定的(Weiss, 1995)。因此,植物花色素所占的比例在很大程度上能决定花的最终颜色(Harborne and Williams, 2000;姜卫兵等, 2009),某些植物花朵中因为缺乏某种基础色素从而缺乏一类花色(Tanaka et al., 2010)。自然界广泛分布的花色素以天竺葵色素(Pelargonidin)、矢车菊色素(Cyanidin)及花翠素(Delphinidin) 为主,由此再衍生出其它多种花色素,如芍药花色素(Peonidin)是由矢车菊素甲基化形成的;矮牵牛花色素(Petunidin)及锦葵色素(Mavlvidin)则由花翠素不同程度的甲基化而来的(Hondo et al., 1992)。天竺葵色素呈现砖红色;矢车菊素及芍药花色素表现为紫红色;而花翠素、矮牵牛色素及锦葵色素则表现为蓝紫色 (Grotewold, 2006)。
2花色素的生物合成及转录调节
花色素(Anthocyanidin)是决定植物花朵呈色的重要因素之一。研究发现植物花色素是一类水溶性的色素。花色素在细胞中以糖苷的形式存在,形成花色素苷。花色素苷是由各种糖(葡萄糖、半乳糖、木糖、鼠李糖和阿拉伯糖等)以单糖或寡糖的形式与花色素的第3位或第5位的羟基中的一个或者两个结合而形成的色素苷,主要决定花朵的橙色、红色至蓝色属性(Cunningham and Gantt, 1998; Koes et al., 2005; Tanaka et al., 2008)。在植物中花色素苷存在很多种类,不同植物花瓣中所含的花色素苷的种类不同。已知天然存在的花色素苷具有250多种;它们的生物合成是由一系列酶类参与的生物化学反应(Tanaka et al., 2008)。植物的花色素合成途径在一定程度上决定了植物花朵的呈色过程。决定花色素合成途径中的基因主要分为两类,分别为结构基因和调节基因。结构基因在功能上主要决定花色素合成的种类,而调节基因在功能上主要编码转录因子,它们可以决定结构基因表达的强弱。
2.1花色素苷的生物合成途径
花色素苷的合成主要是6类结构基因决定的,它们分别是: 查耳酮合酶基因(Chalcone synthase, CHS),查耳酮异构酶基因(Chalcone isomerase, CHI),黄烷酮-3-羟化酶基因(Flavanone-3-hydroxy-lase, F3H),二氢黄酮醇还原酶基因(Dihydroflavonol reductase, DFR), 花色素合成酶基因(Anthocyanidin synthase, ANS)和尿苷二磷酸-葡萄糖-类黄酮-3-葡糖基转移酶基因(UDP glucose flavonoid 3-glucosyltr-ansferase, UF3GT) (Grotewold, 2006)。前3个基因为上游基因,后3个基因为下游基因。各种花色素苷合成的前体都是丙二酰CoA和香显酰CoA。首先,它们在查尔酮合酶(Chalcone Synthase: CHS)的催化作用下合成四羟基查尔酮。四羟基查尔酮在查尔酮异构酶(Chalcone-flavanone isomerase: CHI)的催化作用下进一步形成三羟基黄烷酮,即柚皮素。柚皮素之后由黄烷酮3-羟化酶(Flavanone 3-Hydroxylas: F3H)或由类黄烷酮3-羟化酶催化形成多种酮醇类物质,主要包括杨梅素(Dihydromyricetin: DHQ)、山萘酚(Dihydrokaempferol: DHK)及二氢槲皮素(Dihydroquercetin: DHM)等。这些酮醇类物质是进一步合成花色素苷的必要前体物质。不同的植物类别及植物花瓣在合成这些酮醇类物质上量上有所差异,各种酮醇类物质在占有比例上也不相同,从而为形成不同的花瓣颜色打下了基础。杨梅素、山萘酚及二氢槲皮素等通过二氢黄酮醇4-还原酶 (Dihydroflavonol 4-Reductase: DFR)及花色素合成酶(Anthocyanidin Synthase: ANS)的作用还原为各种花色素,包括花翠素、天竺葵色素及矢车菊素等。花色素在植物细胞内是极不稳定的一类物质,它们进一步在类黄酮葡萄糖苷转移酶(GT)的作用下合成花色素苷。花色素苷的合成途径(见图1) (Katsumoto et al., 2007)。
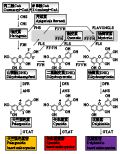 图1花色素苷合成途径(Katsumoto et al., 2007) Figure 1 The synthesis pathway of the anthocyanin (Katsumoto et al., 2007) |
2.2花色素苷生物合成的结构基因
编码花色素苷生物合成途径中关键酶的基因在很多植物中得到了克隆。其中查尔酮合成酶基因CHS是进入花色素合成途径中的第一个关键酶基因,同时也是第一个被克隆得到的类黄酮次生代谢的关键酶基因 (Reimold et al., 1983)。目前己从欧芹、金鱼草、拟南芥,矮牵牛、豌豆等植物种类中获得了该基因成员。其中在拟南芥、金鱼草等植物中只发现了一个该基因家族成员;而在矮牵牛中发现了至少有10个基因家族成员,并且发现不同CHS家族成员在组织表达上具有特异性 (Koch et al., 2000)。并且该基因在转基因工程上也得到了成功应用( Napoli et al., 1990;Koch et al., 2000; Reimold et al., 1983)。
查尔酮经过CHS酶的催化作用在植物细胞内迅速合成,但是在大多数的植物中并不积累,合成后会迅速由下游查尔酮异构酶CHI催化形成柚皮素。编码查尔酮异构酶的基因在不同植物中所含的基因成员数目不同(Van et al., 1988)。在矮牵牛中发现了两个CHI基因成员,而在拟南芥中目前只发现了一个编码该蛋白的基因(Kuittinen and Aguadéa, 2000)。
F3H是催化柚皮素生成山萘酚过程中的关键酶,也是各种花色素合成前体杨梅素及二氢槲皮素等过程中的核心酶,因此也是花色素苷合成途径过程中的中枢(Britsch et al., 1992)。F3H基因在玉米、矮牵牛、拟南芥中都是单拷贝基因,含有一个基因成员,而在甘蓝型油菜中含有多个基因拷贝(Tanaka et al., 2008)。我们推测不同的基因拷贝在执行花色素苷的合成过程中可能起着不同作用。
F3'H基因和F3'5'H基因是两个同属于细胞色素P450家族的基因,它们控制类黄酮B环上羟基化的位置,从而决定其花色素合成的前体物质(Schoenbohm1 et al., 2000)。F3'H基因决定以天竺葵素为基础的砖红色到红色;而F3'5'H基因决定以花翠素为基础的紫色或蓝色(孟丽和戴思兰, 2004; Mori et al., 2004; Tanaka et al., 2008)。
花色素前体物质合成后,进一步通过DFR和ANS两类酶形成花色素(Tanaka et al., 2008)。这两个基因目前在矮牵牛、拟南芥、非洲菊、月季等植物中都得到了克隆(Martens et al., 2002)。不同植物种类中所含的这两个基因家族的成员数目不同,在矮牵牛中目前发现了三个DFR基因拷贝,而在豆科植物百脉根中发现有5个DFR成员。ANS基因在紫苏中有2-3个拷贝,在金钟连翘中有2个拷贝。并且研究发现这两个基因家族内不同成员之间在时间及空间上的表达特性有所不同(Springob et al., 2003)。花色素是形成花色素苷的基本成分,所以这两个基因家族的不同成员编码的蛋白可能具有底物特异性,从而为产生不同颜色的花色素苷奠定基础。
花色素在细胞中是极不稳定的物质,它们进一步在糖基转移酶GT/AT的作用下加上1个或2个糖基,生成稳定的花色素苷(Federoff et al., 1984)。花色素分子的糖基化不但在改变植物花色,保持分子结构稳定方面有作用,同时是花色素分子运输到液泡必不可少的因素(Marrs et al., 1995)。
前人研究认为花色素苷是由上述各个酶类形成的多酶复合体催化形成的,多酶复合体通过细胞色素单加氧酶P450,即通过F3'H和F3'5'H酶固定在内质网上(Winkel-Shirley, 2001)。它们以一定的方式排列并催化花色素苷生物合成途径中的顺序反应。花色素苷经多酶复合体合成后被迅速转运至液泡,从而参与植物花朵或叶片颜色的形成。
2.3花色素苷生物合成的调节基因
除了结构基因对花色素的生物合成起作用外,还有几类调控基因在调节花色素的生物合成中扮演着重要作用。它们一般通过直接调控结构基因的转录来起作用,是一些转录因子类。主要包括MYB基因家族(Quattrocchio et al., 1998)、基本的螺旋-环- 螺旋(bHLH)类型转录因子(Ludwig and Wessler, 1990; Spelt et al., 2000)和WD40重复蛋白基因(Springob et al., 2003)。其中,MYB类和bHLH类调控因子是两类很大的基因家族,它们的调控目标很广泛,除了调控类黄酮合成途径参与花色素的合成之外(Hartmann et al., 2005),还调控其它途径,包括植物的逆境响应及生长发育等(Spelt et al., 2002)。研究花菜、月季等一个编码R2R3类的MYB转录因子表明该蛋白与花色素苷合成途径密切相关,该基因的突变体会使它们的部分器官显示紫色(Chiu et al., 2010;Lin et al., 2010)。WD40重复蛋白基因在蛋白质与蛋白质的相互作用中担当重要角色。
3外部因子对花色素苷合成的调节
研究指出花色素的生物合成是由内因和外因共同作用的结果。由基因编码的各类酶类决定了花色素的合成种类及积累含量,它们构成了花色素合成的内因;而环境因子是促使各类酶类行使作用的主要外界因素。影响花色素生物合成的外界因子主要有温度、光照、糖类等;它们既可以调节一些结构基因的转录,也可以影响一些调节基因的转录。另外,环境因子对花色素的稳定性也会产生作用,低温条件下会加速花色素的降解,从而影响花色素在细胞中的积累,进而影响花朵的呈色(Weiss, 2000)。
光照是影响花色素苷合成最重要的环境因子之一。在很多花色素苷合成途径的结构基因或调节基因的启动子中常含有与光信号有关的响应元件,在拟南芥、玉米、欧芹等植物的CHS、F3H和FLS基因启动子中发现了与光信号相关的元件(Hartmann et al., 1998; 2005; Petroni et al., 2000)。另外,研究发现玉米的一类与花色素苷合成相关的MYB基因在强光诱导后其表达丰度也有所增加,说明该类转录因子在调节花色素苷合成中与光诱导密切相关(Feldbrügge et al., 1997)。
温度是影响植物组织中花色素苷积累的另一个主要的环境因子。低温会诱导花色素的生物合成,而高温会诱导花色素的降解。温度对花色素的调控发生在其合成途径的多步反应中。在拟南芥中,高温会抑制与花色素合成相关的一些转录因子TT8、TTG1及EGL3基因的表达,从而就降低了花色素合成途径中一些结构基因的表达,进而影响花色素的积累(Rowan et al., 2009)。另一方面,花色素合成中的结构基因CHS、CHI、DFR、ANS等对温度都很敏感;它们在低温条件下表达量会被诱导上升,而在高温条件下表达量会急剧下降(Stiles et al., 2007;Huh et al., 2008)。
由于花朵是异养器官,它们必须借助叶片的同化产物来满足自身生长的需要。因此糖物质的传送、积累、调控等对花朵生长及呈色至关重要。糖可以诱导花色素合成途径中CHS、CHI、F3H、F3’H、DFR、MYB等一些基因的表达,影响花色素的含量,进而影响植物花朵的呈色 (Teng et al., 2005; Solfanelli et al., 2006)。
4展望
花色是观赏植物的研究热点,与花色形成相关的生理基础、分子机制都已经阐述的比较清楚。许多参与花色形成的关键基因在很多植物中已经被鉴定和分离,包括花色素合成途径中的结构基因及调节基因。这么复杂而且精密的调控必然涉及到多个转录因子或者调控转录因子。花色素苷结构基因启动子区存在多个bHLH和MYB结合位点, 表明每一次转录事件可能需要多个转录因子的协同作用以实现更为精确的调控,但是多个因子对于花色素苷结构基因的转录进行调控的机制目前尚没有报道,这个过程仍有大量的细节需要研究和理解。
作者贡献
张和臣、王利民、孟月娥等负责本综述的设计、撰写等;李艳敏,王慧娟,董晓宇,赵秀山等负责收集与本综述相关的文献材料。全体作者都阅读并同意最终的文本。
致谢
本研究由河南省重点科技攻关项目(092102110127)资助。
参考文献
Britsch L., Ruhnau-Brich B., and Forkmann G., 1992, Molecular cloning, sequence analysis, and in vitro expression of flavanone 3 beta-hydroxylase from Petunia hybrida, J. Biol. Chem., 267(8): 5380-5387
PMid:1544919
Chiu L., Zhou X., Burke S., Wu X., Prior R.L., and Li L., 2010, The purple cauliflower arises from activation of a MYB transcription factor, Plant Physiol., 154(3): 1470-1480
http://dx.doi.org/10.1104/pp.110.164160
PMid:20855520 PMCid:2971621
Cunningham F.X., and Gantt E., 1998, Genes and enzymes of carotenoid biosynthesis in plants, Annu. Rev. Plant Physiol. Plant Mol. Biol., 49: 557-583
http://dx.doi.org/10.1146/annurev.arplant.49.1.557
PMid:15012246
Federoff N.V., Furtek D.B., and Nelson O.E., 1984, Cloning of the Bronze locus in maize by a simple and generalizable procedure using the transposable controlling element activator (Ac), Proc. Natl. Acad. Sci. USA, 81(12): 3825-3829
http://dx.doi.org/10.1073/pnas.81.12.3825
Feldbrügge M., Sprenger M., Hahlbrock K., and Weisshaar B., 1997, PcMYB1, a novel plant protein containing a DNA-binding domain with one MYB repeat, interacts in vivo with a light-regulatory promoter unit, Plant J., 11(5):1079-1093
http://dx.doi.org/10.1046/j.1365-313X.1997.11051079.x
PMid:9193077
Grotewold E., 2006, The genetics and biochemistry of floral pigments, Annu. Rev. Plant Biol., 57: 761-780
http://dx.doi.org/10.1146/annurev.arplant.57.032905.105248
PMid:16669781
Han K.T., Hu K., and Dai S.L., 2008, Flower color breeding by molecular design in ornamentals, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 6(1): 16-24 (韩科厅, 胡可, 戴思兰, 2008, 观赏植物花色的分子设计, 分子植物育种, 6(1): 16-24)
Harborne J.B., and Williams C.A., 2000, Advances in flavonoid research since 1992, Phytochemistry, 55(6): 481-504
http://dx.doi.org/10.1016/S0031-9422(00)00235-1
Hartmann U., Sagasser M., Mehrtens F., Stracke R., and Weisshaar B., 2005, Differential combinatorial interactions of cis-acting elements recognized by R2R3-MYB, BZIP, and BHLH factors control light-responsive and tissue-specific activation of phenylpropanoid biosynthesis genes, Plant Mol. Biol., 57(2): 155-171
http://dx.doi.org/10.1007/s11103-004-6910-0
PMid:15821875
Hartmann U., Valentine W.J., Christie J.M., Hays J., Jenkins G.I., and Weisshaar B., 1998, Identification of UV/blue light-response elements in the Arabidopsis thaliana chalcone synthase promoter using a homologous protoplast transient expression system, Plant Mol. Biol., 36(5): 741-754
http://dx.doi.org/10.1023/A:1005921914384
PMid:9526507
Hondo T., Yoshida K., Nakagawa A., Kawai T., Tamura H., and Toshio Goto T., 1992, Structural basis of blue-color development in flower petals from Commelina communis, Nature, 358: 515-518
http://dx.doi.org/10.1038/358515a0
Huh E.J., Shin H.K., Choi S.Y., Kwon O.G., and Lee Y.R., 2008, Thermosusceptible developmental stage in anthocyanin accumulation and color response to high temperature in red chrysanthemum cultivars, Korean J. Hortic. Sci. Technol., 26(4): 357-361
Jiang W.B., Xu L.L., Weng M.L., and Han J., 2009, Effects of environmental factors and exogenous chemicals on anthocyanins in plants: A review, Shengtai Huanjing Xuebao (Ecology and Environment), 18(4): 1546-1552 (姜卫兵, 徐莉莉, 翁忙玲, 韩健, 2009, 环境因子及外源化学物质对植物花色素苷的影响, 生态环境学报, 18(4): 1546-1552)
Katsumoto Y., Fukuchi-Mizutani M., Fukui Y., Brugliera F., Holton T.A., Karan M., Nakamura N., Yonekura-Sakakibara K., Togami J., Pigeaire A., Tao G.Q., Nehra N.S., Lu C.Y., Dyson B.K., Tsuda S., Ashikari T., Kusumi T., Mason J.G., and Tanaka Y., 2007, Engineering of the rose flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin, Plant Cell Physiol., 48(11): 1589-1600
http://dx.doi.org/10.1093/pcp/pcm131
PMid:17925311
Koch M.A., Haubold B., and Mitchell-Olds T., 2000, Comparative Evolutionary Analysis of Chalcone Synthase and Alcohol Dehydrogenase Loci in Arabidopsis, Arabis, and Related Genera (Brassicaceae), Mol. Biol. Evol., 17(10): 1483-1498
PMid:11018155
Koes R., Verweij W., and Quattrocchio F., 2005, Flavonoids: a colorful model for the regulation and evolution of biochemical pathways, Trends Plant Sci., 10(5): 236-242
http://dx.doi.org/10.1016/j.tplants.2005.03.002
PMid:15882656
Kuittinen H., and Aguadéa M., 2000, Nucleotide variation at the CHALCONE ISOMERASE locus in Arabidopsis thaliana, Genetics, 155(2): 863-872
PMid:10835405 PMCid:1461127
Lin W.K., Bolitho K., Grafton K., Kortstee A., Karunairetnam S., McGhie T.K., Espley R.V., Hellens R.P., and Allan A.C., 2010, An R2R3 MYB transcription factor associated with regulation of the anthocyanin biosynthetic pathway in Rosaceae, BMC Plant Biol., 10: 50
http://dx.doi.org/10.1186/1471-2229-10-50
PMid:20302676 PMCid:2923524
Ludwig S.R., and Wessler S.R., 1990, Maize R gene family: Tissue-specific helix-loop-helix proteins, Cell, 62(5): 849-851.
http://dx.doi.org/10.1016/0092-8674(90)90259-H
Marrs K.A., Alfenito M.R., Lloyd A.M., Walbot V., 1995, A glutathione S-transferase involved in vacuolar transfer encoded by the maize gene Bronze22, Nature, 375(6530): 397-400
http://dx.doi.org/10.1038/375397a0
PMid:7760932
Martens S., Teeri T., and Forkmann G., 2002, Heterologous expression of dihydroflavonol 4-reductases from various plants, FEBS Lett., 531(3): 453-458
http://dx.doi.org/10.1016/S0014-5793(02)03583-4
Meng L., and Dai S.L., 2004, F3'5'H genes regulation and blue flowers formation, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 2(3): 413-420 (孟丽, 戴思兰, 2004, F3'5'H基因与蓝色花的形成, 分子植物育种, 2(3): 413-420)
Meng L., and Dai S.L., 2005, Novel gene rresource of flower color: blue flowers formation gene (PCFH) from Pericallis cruenta, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 3(4):595-596 (孟丽, 戴思兰, 2005, 花色研究基因新资源: 瓜叶菊蓝色花形成相关基因PCFH, 分子植物育种, 3(4): 595-596)
Mori S., Kobayashi H., Hoshi Y., Kondo M., and Nakano M., 2004, Heterologous expression of the flavonoid-3’, 5’-hydroxlyase gene of Vinca major alters flower color in transgenic Petunia hybrida, Plant Cell Rep., 22(6): 415-421
http://dx.doi.org/10.1007/s00299-003-0709-3
PMid:14504908
Napoli C., Lemieux C., and Jorgensen R., 1990, Introduction of a chimeric Chalcone synthase Gene into Petunia results in reversible co-suppression of homologous genes in trans, Plant Cell, 2(4): 279-289
http://dx.doi.org/10.1105/tpc.2.4.279
PMid:12354959
http://dx.doi.org/10.2307/3869076
PMid:12354959 PMCid:159885
Petroni K., Cominelli E., Consonni G., Gusmaroli G., Gavazzi G., and Tonelli C., 2000, The developmental expression of the maize regulatory gene Hopi determines germination- dependent anthocyanin accumulation, Genetics, 155(1): 323-336
PMid:10790406 PMCid:1461070
Quattrocchio F., Wing J.F., van der Woude K., Mol J.N., and Koes R., 1998, Analysis of bHLH and MYB domain proteins: Species specific regulatory differences are caused by divergent evolution of target anthocyanin genes, Plant J., 13(4): 475-488
http://dx.doi.org/10.1046/j.1365-313X.1998.00046.x
PMid:9680994
Reimold U., Kröger M., Kreuzaler F., and Hahlbrock K., 1983, Coding and 3' non-coding nucleotide sequence of chalcone synthase mRNA and assignment of amino acid sequence of the enzyme, EMBO J., 2(10): 1801-1805
PMid:16453477 PMCid:555362
Rowan D.D., Cao M.S., Lin-Wang K., Cooney J.M., Jensen D.J., Austin P.T., Hunt M.B., Norling C., Hellens R.P., Schaffer R.J., and Allan A.C., 2009, Environmental regulation of leaf color in red 35S:PAP1 Arabidopsis thaliana, New Physiol., 182(1): 102-115
http://dx.doi.org/10.1111/j.1469-8137.2008.02737.x
PMid:19192188
Schoenbohm1 C., Martens S., Eder C., Forkmann G., and Weisshaar B., 2000, Identification of the Arabidopsis thaliana flavonoid 3’-Hydroxylase gene and functional expression of the encoded P450 Enzyme, Biol. Chem., 381(8): 749-753
Solfanelli C., Poggi A., Loreti E., Alpi A., and Perata P., 2006, Sucrose-specific induction of the anthocyanin biosynthetic pathway in Arabidopsis, Plant Physiol., 140(2): 637-646
http://dx.doi.org/10.1104/pp.105.072579
PMid:16384906 PMCid:1361330
Spelt C., Quattrocchio F., Mol J.N., and Koes R., 2000, Anthocyanin1 of petunia encodes a basic2helix loop helix p rotein that directly activates structural anthocyanin genes, Plant Cell, 12(9): 1619-1632
http://dx.doi.org/10.2307/3871178
PMid:11006336 PMCid:149074
http://dx.doi.org/10.1105/tpc.12.9.1619
Springob K., Nakajima J., Yamazaki M., and Saito K., 2003, Recent advances in the biosynthesis and accumulation of anthocyanins, Nat. Prod. Rep., 20(3): 288-303
http://dx.doi.org/10.1039/b109542k
PMid:12828368
Stiles E.A., Cech N.B., Dee S.M., and Lacey E.P., 2007, Temperature- sensitive anthocyanin production in flowers of Plantago lanceolata, Plant Physiol., 129(4): 756-765
http://dx.doi.org/10.1111/j.1399-3054.2007.00855.x
Tanaka Y., Brugliera F., Kalc G., Senior M., Dyson B., Nakamura,N., Katsumoyo Y., and Chandler S., 2010, Flower color modification by engineering of the flavonoid biosynthetic pathway: practical perspectives bioscience, Biosci. Biotechnol. Biochem., 74(9): 1760-1769
http://dx.doi.org/10.1271/bbb.100358
PMid:20834175
Tanaka Y., Sasaki N., and Ohmiya A., 2008, Biosynthesis of plant pigments: anthocyanins, betalains and carotenoids, Plant J., 54(4): 733-749
http://dx.doi.org/10.1111/j.1365-313X.2008.03447.x
PMid:18476875
Teng S., Keurentjes J., Bentsink L., Koornneef M., and Smeekens S., 2005, Sucrose-specific induction of anthocyanin biosynthesis in Arabidopsis requires the MYB75/PAP1 gene, Plant Physiol., 139(4): 1840-1852
http://dx.doi.org/10.1104/pp.105.066688
PMid:16299184 PMCid:1310563
Van Tunen A.J., Koes R.E., Spelt C.E., van der Krol A.R., Stuitje A.R., Mol J.N., 1988, Cloning of the two chalcone flavanone isomerase genes from Petunia hybrida: coordinate, light-regulated and differential expression of flavonoid genes, EMBO J., 7(5): 1257-1263
PMid:3409864 PMCid:458371
Weiss D., 2000, Regulation of flower pigmentation and growth: multiple signaling pathways control anthocyanin synthesis in expanding petals, Physiologia plantarum, 110(2): 152-157Zhao Y.P., Chen F.D., and Guo W.M., 2003, Advances in genetic engineering of flower color of ornamental plants, Zhiwuxue Tongbao(Chinese Bulletin of Botany), 20(1): 51-58 (赵云鹏, 陈发棣, 郭维明, 2003, 观赏植物花色基因工程研究进展, 植物学通报,20(1):51-58)
Weiss M.R., 1995, Floral color change: A widespread functional convergence, Am. J. Bot., 82(2), 167-185
http://dx.doi.org/10.2307/2445525
Winkel-Shirley B., 2001, Flavonoid biosynthesis. A colorful model for genetics biochemistry cell biology and biotechnology, Plant Physiol., 126(2): 485-493
http://dx.doi.org/10.1104/pp.126.2.485
PMid:11402179 PMCid:1540115