 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 115 篇 doi: 10.5376/mpb.cn.2011.09.0115
收稿日期: 2011年09月19日 接受日期: 2011年09月30日 发表日期: 2011年11月07日
引用格式(中文):
张双玲等, 2011, 酶解法制备植物叶绿体DNA(cpDNA), 分子植物育种(online) Vol.9 No.115 pp.1843-1846 (doi: 10.5376/mpb. cn.2011.09.0115)
引用格式(英文):
Zhang et al., 2011, The enzyme-lysed method for preparation of plant cpDNA (chloroplast DNA), Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.9 No.115 pp.1843-1846 (doi: 10.5376/mpb.cn.2011.09.0115)
植物叶绿体DNA制备相对较为困难,与核基因组DNA相比,其产量很低。为提高植物cpDNA制备效率,本法采用酶解液预处理植物叶片。研磨前以含有1%的纤维素酶和0.5%的果胶酶的去壁酶液处理植物叶片2 h,有效提高完整叶绿体和cpDNA的产量,以此方法制备1 g新鲜的烟草叶片的cpDNA的量要高于传统方法制备4 g材料的。用SamⅠ酶切制备的烟草的cpDNA,结果表明所制备的cpDNA质量好,能满足实验需要。以小麦和大豆叶片实验材料,采用该方法也能制备出高质量的cpDNA,表明该方法适于多数植物cpDNA的制备,对进一步研究植物cpDNA基因组结构、叶绿体遗传转化等方面有积极意义。
植物叶绿体是植物进行光合作用的主要细胞器,具有半自主遗传特性。1962年Ris和Plaut在电镜下观察衣藻、玉米等植物叶绿体超薄切片时,发现并用实验证实了叶绿体DNA的存在(Ris and Plaut, 1962)。叶绿体不仅具有自己的DNA,而且还具有独立的DNA复制、转录、翻译系统。目前已有不少基因定位于叶绿体DNA上,如rRNA基因、tRNA基因、RuBPCo酶大亚基基因、ATP合成酶亚基基因等(赵卫国等, 2001)。由于其基因组相对保守性,cpDNA已被广泛用来研究植物的系统发育及分类等(Kato et al., 2000;彭隽敏等, 1995; Cesare et al., 2010 )。叶绿体DNA形态上与细菌的基因组DNA相似,其蛋白质翻译系统也与原核生物的高度相似,被认为是一个安全的表达系统,能用于大量、低成本的生产重组药物蛋白(Obembe et al., 2010)。制备高质量的cpDNA对cpDNA的各项研究无疑有重要意义。
与核基因组DNA制备相比,cpDNA制备的技术难度相对较大,一方面cpDNA总量少,需要材料多,这给一些有关cpDNA研究如叶绿体转化体的鉴定带来不便。另一方面,cpDNA制备过程中易受细胞核DNA的污染,一旦污染,cpDNA失去应有的价值。解决这一问题的办法是首先制备出无核基因组DNA污染的完整叶绿体,再行裂解叶绿体制备cpDNA (Frankel et al., 1979)。目前虽有许多改进的植物cpDNA制备方法报道(朱小龙等, 2003),但cpDNA产量低的问题仍未解决。本文首次报道酶解法制备cpDNA的方法,只需少量的植物材料就可制备出满足实验需求的高质量的cpDNA。
1结果与分析
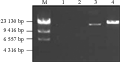
1.1酶解法制备的烟草叶绿体DNA
在制备叶绿体DNA过程中,首先是破碎植物细胞,制备出大量纯净的叶绿体。传统制备方法破碎细胞主要采用研磨,研磨虽能破碎组织,但对植物细胞壁的破坏不充分,细胞质难以释放出来,叶绿体制备效率低。考虑到植物细胞壁主要由纤维素、半纤维素及果胶等组成,参考植物原生质体的制备方法,在研磨之前,采用1%纤维素酶和0.5%果胶酶处理叶片2 h,在同等质量的情况下,制备出的叶绿体明显多于传统方法制备的,制备出的cpDNA的量也明显大于传统方法(见图1)。用传统方法制备cpDNA时,4 g叶片材料提取的cpDNA溶于30 µL TE缓冲液,取5 µL进行电泳,经EB染色后,泳道上很难看见DNA;采用酶法制备,1 g同样的材料,就能清晰地看见DNA样品。由此可见,酶法制备出的cpDNA的效率远远高于传统方法的。由于制备出的叶绿体处于超螺旋状态,电泳图中还不能准确判断其分子量的大小,但清晰的一个条带说明样品纯度较好。
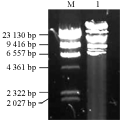
1.2限制性内切酶酶切分析酶法制备的烟草叶绿体DNA的质量
从酶法制备的cpDNA琼脂糖凝胶电泳检测结果可以看出,制备出的cpDNA只有一个条带,说明制备出的cpDNA样品较纯净,但这还不能反映cpDNA样品的质量,只有经过内切酶酶切,从酶切图谱的情况才能真实说明cpDNA样品的质量。用限制性内切酶SamⅠ酶切酶法制备的烟草cpDNA样品14 h,酶切结果见图2,从酶切的结果看,除12 kb和9.9 kb的条带没有出现外,呈现的其他带型与报道的基本一致(Fluhr and Edelman, 1981),说明该方法制备的烟草cpDNA质量可靠。
1.3酶解法制备的小麦和大豆的叶绿体DNA
去壁酶液能有效地破坏烟草细胞壁,提高叶绿体的产量,进而提高了cpDNA产量,但对其他植物细胞作用的情况还不清楚。我们选择通常被认为细胞壁较难破坏的单子叶植物小麦和双子叶植物大豆作为实验材料,用酶法制备其叶片的cpDNA,结果见图3,从图中可以看出,采用酶法制备,4 g小麦和大豆新鲜叶片也能制备出满足实验要求的cpDNA样品。
2讨论
植物叶绿体DNA基因小,结构相对保守,同时含有许多重要功能基因,在植物分子生物学研究中有重要价值。植物叶片是所有组织中cpDNA含量最高的,但仍需要大量的材料才能制备出满足实验需求的cpDNA量,这给cpDNA研究带来很大的不便。在植物cpDNA制备过程中,获得无细胞核DNA污染的完整叶绿体是最关键的步骤(朱小龙等, 2003)。由于不能采用液N冻干研磨,因为会造成叶绿体的破坏,使细胞核DNA和cpDNA分离更加困难。传统的制备方法中只能采用加石英砂研磨,这样对植物细胞壁的破坏是非常有限的。纤维素酶和果胶酶是植物原生质体制备过程中常用的酶,能够酶解多数植物的细胞壁,但对植物的质膜和细胞器没有破坏作用,采用纤维素酶和果胶酶处理植物叶片,部分破坏细胞壁,再用石英砂研磨,可以有效促进叶绿体的释放,进而有效提高cpDNA产量。采用传统制备方法需要4~10 g 左右的材料才能制备出少量的可以通过凝胶分析cpDNA,这使叶绿体转化体的早期鉴定无法进行。通过裂解酶液预处理叶片,1 g 材料就能制备出大量的cpDNA,这可以使像叶绿体转化体的早期鉴定这类实验顺利进行。
加纤维素酶和果胶酶处理样品潜在的风险是使样品中蛋白质含量提高,这不利于DNA的制备,有可能降低cpDNA纯度,cpDNA纯度对后续实验有着重要的影响,解决的办法是通过对叶绿体多次洗涤。用限制性内切酶酶解DNA,从水解谱带能看出其真实性和纯度,其电泳谱带与理论谱带基本一致一方面表明其真实性,另一方面表明这样的DNA样品纯度上可以满足绝大多实验的需要,如果DNA样品中有一定的蛋白质污染,它是不能被酶切的。从我们实验结果来看,用酶解法制备的cpDNA纯度完全可以满足实验需要。
小麦和大豆是重要农作物,对它们cpDNA的研究和认识有重要的应用价值。小麦的细胞壁通常也被认为是很难酶解,为了验证酶解法是否适用这样的植物材料,选择这两种材料制备cpDNA。从实验结果看,用4 g 材料也能制备出大量的cpDNA,这表明该制备方法能适用于大多数植物。
3材料和方法
3.1植物材料
实验材料是烟草、小麦和大豆的叶片,烟草为本实验室保存的烟草品种SRI (Nicotiana tabacuumcv. SRI)。小麦为普通栽培品种鲁麦21,由山东农业大学王洪刚教授提供。大豆为栽培夏大豆品种临豆8号,从种子市场购买。
3.2试剂组成
缓冲液A:400 mmol/L蔗糖,50 mmol/L Tris-HCl,20 mmol/L EDTA—Na2,0.2% BSA, 0.2%巯基乙醇,pH值为7.8,其中0.2% BSA和0.2%巯基乙醇现用现加。缓冲液B:400 mmol/L蔗糖,5 0 mmol/L Tris-HCl 0.1% BSA (现用现加),pH 7.8。缓冲液C:100 mmol/L Tris-HCl,50 mmol/L EDTA-Na2,100 mmol/L NaCl, 0.2%巯基乙醇(现用现加),pH 7.2。去壁酶液:1% 纤维素酶(Cellulase R-10),0.5% 果胶酶(Macerozyme R-10),溶解于缓冲液A中,贮于试剂瓶中,封口,于-20℃保存。
3.3叶绿体DNA制备方法步骤
3.3.1叶绿体的分离
取新鲜的黑暗中处理48 h叶片洗净,擦干,去除中间叶脉,称1-4 g叶片剪成1 cm左右的小段分别放入预冷(0℃)的碾钵中,加去壁酶液2 mL, 以不加酶液处理的传统制备方法作对照,37℃分解2 h,各加入5 mL缓冲液A进行研磨匀浆(操作在冰上进行)。用50 μm尼纶纱或4~6层纱布过滤浆液,过虑物再研磨一次,再过滤,合并滤液,倒入离心管中。于0℃, 1 000 rpm (200 g)离心20 min 。取上清,分别转入新离心管中,在4 000 rpm (3 700 g)离心20 min,弃上清。在沉淀中再加入5 mL缓冲液A,用毛刷重新悬浮叶绿体颗粒,在4 000 rpm (3 700 g)离心20 min,弃上清,此沉淀为初步分离的叶绿体(视淀粉情况可再重复洗涤,白色物质为淀粉沉淀)。
3.3.2 DNase处理,除去核DNA
向离心管的沉淀中分别加入400 μL左右的缓冲液B,再重新悬浮叶绿体沉淀,并加入适量的DNase I,使DNaseI终浓度为250 mg/L,在37℃下水浴20 min,轻轻摇匀,加入1 mol/L EDTA-Na2 (终浓度为0.2 mol/L),终止酶解反应,在4 000 rpm (3 700 g)离心20 min,收集沉淀。
3.3.3裂解
向离心管的沉淀中加入预冷的缓冲液C 500 μL,重悬叶绿体颗粒,然后再各加入30 μL 20%的SDS (终浓度为1%),60℃水浴,不时摇匀,直到被完全裂解。12 000 rpm,离心10 min,取上层液。加等体积氯仿:异戊醇—24:1,摇匀5 min,12 000 rpm离心10 min,取上层液,加1/10体积5 mol/L NaCl和等倍体积的异丙醇,-20℃放2~3个小时或过夜。4℃条件下12 000 rpm离心15 min,弃上清液,用70%乙醇洗涤,在温室下晾干,加30 µL TE缓冲液溶解DNA,放入-20℃保存备用。
3.3.4电泳检测
取5 µL提取的叶绿体DNA在0.8 % 琼脂糖凝胶上用75 V电泳1 h后,置于凝胶成像系统观察结果并成像。
3.3.5限制性内切酶酶切及电泳检测
所获得的cpDNA经限制性内切酶SamⅠ (TaKaRa公司)酶切。反应体系总体积50 μL,其中cpDNA样品10 μL, 10×Buffer 5 μL,内切酶20 U,补充无菌水至50 μL, 37℃保温过夜。1.0 % 琼脂糖凝胶上进行电泳检测。
作者贡献
张双玲是本研究项目的主要执行人,参与了实验设计,完成论文初稿的写作。何道一是项目的设计者和负责人,指导实验的实施,论文的写作和修改。全体作者都阅读并同意最终的文本。
致谢
本研究由安徽省教育厅自然科学研究重点项目(KJ2011A249)资助。感谢本实验室硕士研究生陈丽萍协助了部分实验工作。
参考文献
Cesare M.D., Hodkinson T.R., and Barth S., 2010, Chloroplast DNA maker (cpSSRs,SNPs) for Miscanthus Saccharum and related grasses (Panicoideae, Poaceae), Mol. Breeding, 26(3): 539-544
http://dx.doi.org/10.1007/s11032-010-9451-z
Frankel R., Scowcroft W.R., and Whitfeld P.R., 1979, Chloroplast DNA variation in isonuclear male-sterile lines of Nicotiana, Mol. Gen. Genet., 169(2): 129-135
http://dx.doi.org/10.1007/BF00271663
Kato S., Yamagach H., Shimaoto Y., Shimamoto Y., and Mikami T., 2000, The chloroplast genomes of azuki bean and its close relatives: a deletion mutation found in weed azuki bean, Hereditas, 132(1): 43-48
http://dx.doi.org/10.1111/j.1601-5223.2000.00043.x
Obembe O.O., Popoola J.O., Leelavathi S., and Reddy V.S., 2010, Recent advances in plastid transformation, Indian Journal of Science and Technology, 3(12): 1229-1235
Peng J.M., Kong Q., and Xu N.Y., 1995, Study on the restriction fragment patterns of chloroplast DNAs of Yunnan wheat,Tibet semiwild wheat and common wheat, Yichuan (Hereditas), 17(6): 4-6 (彭隽敏, 孔清, 徐乃瑜, 1995, 云南小麦、西藏半野生小麦及普通小麦叶绿体DNA限制性内切酶图谱的研究, 遗传, 17(6): 4-6)
Ris H., and Plaut W., 1962, Ultrastructure of DNA-containing areas in the chloroplast of Chlamydomonas, J. Cell Biol., 13: 383-391
http://dx.doi.org/10.1083/jcb.13.3.383
PMid:14492436 PMCid:2106071
Fluhr R., and Edelman M., 1981, Physical mapping of Nicotiana tabacum chloroplast DNA, Mol. Gen Genetic., 181(4): 484-490
http://dx.doi.org/10.1007/BF00428740
Zhao W.G., Zhao Q.L., Zhang Z.F., Xiao Q.L., Pan Y.L., and He J.L., 2011, A Rapid cpDNA isolation of Mulberry Moris L. and analysis of part sequence, Canye Kexue (Canye Kexue), 27(4): 303-305 (赵卫国, 赵巧玲, 张志芳, 肖庆利, 潘一乐, 何家禄, 2001, 桑树叶绿体基因组DNA的提取及部分序列分析, 蚕业科学, 27(4): 303-305)
Zhu X.L., Zhang Y.H., Zou J., and Lian Y.W., 2003, A Method for isolation of chloroplast DNA from Castanopsis kawakamii, Xiamen daxue Xuebao (Journal of Xiamen University (Natural Science)), 42(2): 257-260) (朱小龙, 张宜辉, 邹娟, 连玉武, 2003, 赤枝栲(Castanopsis kawakamii)叶绿体DNA的提纯方法研究, 厦门大学学报(自然科学版), 42(2): 257-260)
.png)