 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 13 篇 doi: 10.5376/mpb.cn.2012.10.0013
收稿日期: 2012年03月05日 接受日期: 2012年03月29日 发表日期: 2012年04月27日
引用格式(中文):
刘毅等, 2012, 植物黄酮葡糖苷酸衍生物生物合成与调控分子机理, 分子植物育种(online) Vol.10 No.13 pp.1097-1103 (doi: 10.5376/mpb. cn.2012.10.0013)
引用格式(英文):
Liu et al., 2012, Molecular Mechanism of Biosynthesis and Regulation of Flavone Glucuronide Derivatives in Plants, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.13 pp.1097-1103 (doi: 10.5376/mpb.cn.2012.10.0013)
植物黄酮葡糖苷酸衍生物黄芩苷和野黄芩苷(灯盏乙素)等是药用植物黄芩(Scutellaria baicalensis)、灯盏花(Erigeron breviscapus)等的主要功能成分,专一地存在于马鞭草科、唇形科、玄参科和车前草科(同属于唇形目)以及菊科等植物体内,具有重要的药用价值。近年来,相关研究研究主要集中于唇形目植物黄酮葡糖苷酸衍生物生物合成途径中关键酶基因的克隆、功能与表达分析。类黄酮7-O-葡萄糖醛酸转移酶(flavonoid 7-O-glucuronosyltransferase, F7GAT)催化黄酮与UDPGA (UDP-葡萄糖醛酸, UDP-glucuronic acid)合成黄酮葡糖苷酸衍生物。最新研究发现,唇形目植物F7GAT糖供体特异性的形成是由于单个氨基酸残基的改变所引起的。菊科植物,如灯盏花含有与唇形目植物完全不同的黄酮葡糖苷酸衍生物,说明二者存在不同生物合成与调控机制。同时,黄芩和灯盏花等的主要成分均为6-羟基黄酮葡糖苷酸衍生物,目前对于黄酮6位羟化的分子机理尚缺乏了解。本文论述了不同植物黄酮葡糖苷酸衍生物的种类、分布、可能的生物合成途径与调控机理,以期为利用生物技术途径调控黄酮葡糖苷酸衍生物的生物合成以及相关植物分子育种提供理论依据。
植物次生代谢物巨大的结构多样性被认为是植物化学适应特殊小生境的结果,因为植物利用次生代谢物对抗病原物并用于固氮、吸引传粉者等作用中(Gershenzon and Dudareva, 2007; Macías et al., 2007)。特定的植物世系通过获得生物合成酶的新功能产生特殊的次生代谢物,从而增加对环境的适应性。类黄酮是一大类来自苯丙烷代谢途径的植物次生代谢物,通常由糖基转移酶(UDP-sugar: glycosyltransferase, UGT)催化与一个或多个糖基形成糖苷。糖基转移酶是一个超基因家族,根据其所转移的UDP-糖供体,糖基化反应可以分为葡糖基化(UDP-葡萄糖)、鼠李糖基化(UDP-鼠李糖)和葡糖苷酸化(UDP-葡糖醛酸, UDP-glucuronic acid, UDPGA) (Ross et al., 2001; Lim et al., 2004)。通常葡萄糖是自然存在的类黄酮糖苷的最常见糖基。但是,一些特殊的植物世系具有其特征性的类黄酮,并与独特的糖基结合,形成其特殊的代谢产物。
黄酮7-O-葡糖苷酸是一类特殊的类黄酮7-O-葡糖苷酸,通常与类黄酮7-O-葡萄糖苷一起存在于唇形目,包括马鞭草科(Verbenaceae)、唇形科(Lamiaceae)、玄参科(Scrophulariaceae)、车前草科(Plantaginaceae)和以及少数菊科(Compositae)植物如灯盏花(Erigeron breviscapus)等体内。黄酮7-O-葡糖苷酸的存在有明显的种特异性,即不同种类植物体内黄酮7-O-葡糖苷酸种类不同,其优势种类也不同。如黄芩及其近缘种的优势的种类是黄芩苷,而灯盏花等的优势种类是野黄芩苷(灯盏乙素),其它多数植物仅含有少量黄酮7-O-葡糖苷酸。
黄酮7-O-葡糖苷酸是一些药用植物的主要功能成分。如黄芩苷和灯盏乙素分别是药用植物黄芩(Scutellaria baicalensis)和灯盏花的主要功能成分,具有重要的药用价值。黄芩素有强烈的抗诱变和清除自由基的功能(Wozniak et al., 2004),能够抗多种肿瘤,而且抗血管生成(Liu et al., 2003)。灯盏花素(灯盏乙素与少量灯盏甲素的混合物)能够有效地扩张血管,增加血流,改善微循环,降低血粘度,预防血小板凝聚(Yang et al., 2003; Li et al., 2006)。
植物黄酮的生物合成途径已经非常清楚(Martens and Mithöfer, 2005),但目前对黄酮7-O-葡糖苷酸的生物合成尚缺乏了解,如黄酮的羟化、甲基化和葡糖苷酸化等。类黄酮7-O-葡萄糖醛酸转移酶(flavonoid 7-O-glucurono-syltransferase, F7GAT)催化黄酮与UDPGA (UDP-葡萄糖醛酸, UDP-glucuronic acid)合成黄酮葡糖苷酸。唇形目植物F7GAT糖供体特异性(即其糖供体是UDPGA, 而不是UDP-葡萄糖)是由于单个氨基酸残基的改变所引起的(Noguchi et al., 2009)。但其它植物如灯盏花等的F7GAT的糖供体特异性的形成是否也是如此尚不清楚。值得注意的是,黄芩和灯盏花等的主要成分均为6-羟基黄酮葡糖苷酸衍生物,目前对于黄酮6位羟化的分子机理尚未见报道。本文综述了植物黄酮7-O-葡糖苷酸衍生物的种类、存在、分布,提出了完整的生物途径及其可能的调控机理,以期为黄芩、灯盏花等药用植物育种提供理论借鉴。
1植物其葡糖苷酸衍生物的种类与分布
高等植物体内存在三条途径黄酮生物合成途径,分别合成白杨素、芹菜素和木犀草素3种基本黄酮,然后通过羟化、甲基化和葡糖苷酸化形成3种类型黄酮葡糖苷酸衍生物,即Ⅰ型,来自白杨素,白杨素7-O-葡糖苷酸、黄芩苷、汉黄芩苷、去甲汉黄芩素7-O-葡糖苷酸和千层纸素A 7-O-葡糖苷酸;Ⅱ型来自芹菜素,包括芹菜素7-O-葡糖苷酸(灯盏甲素)、泽兰黄酮7-O-葡糖苷酸和灯盏乙素(野黄芩素7-O-葡糖苷酸);Ⅲ型来自木犀草素,包括木犀草素7-O-葡糖苷酸、6-羟基木犀草素7-O-葡糖苷酸和金圣草黄素7-O-葡糖苷酸(图1)。
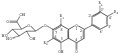 图1 植物黄酮葡糖苷酸衍生物分子结构 |
按照所含黄酮葡糖苷酸的优势种类,可将植物分为3类:第1类植物的优势种类是Ⅰ型黄酮葡糖苷酸如黄芩、棱茎黄芩(Scutellaria scandens)等(Tomimori et al., 1985; Takino et al., 1987; Miyaichi et al., 1988; 周锡钦等, 2009);第2类植物的优势种类是Ⅱ型黄酮葡糖苷酸,如半枝莲(S. barbatae) (Qiao et al., 2011)、美洲黄芩(S. lateriflora)、灯盏花和多舌飞蓬(E. multiradiatus) (Zhang et al., 2008);第3类植物同时含有高含量的Ⅰ型和Ⅱ型黄酮葡糖苷酸,如黄芩属S. tomentosa和S. wrightii,含有高含量的灯盏乙素和黄芩苷。其他一些植物,如野甘草(Scoparia dulcis) (Subramanian and Nair, 1973)、长管大青(Clerodendrum indicum)和欠愉大青(C. infortunatum) (Kawasaki et al., 1988)、Plantago hakusanensis、金鱼草(Antirrhimun majus) (Harborne, 1963; Asen et al., 1972)、紫苏(Yoshida et al., 1993; Yamazaki et al., 2003)、玄参科苦玄参(Picria fel-terrae) (Huang et al., 1999)等也含有黄酮葡糖苷酸,主要是Ⅱ型和Ⅲ型,但其含量均很低。
值得特别关注的是,3种类型的黄酮葡糖苷酸在植物体内的分布不同。Ⅰ型黄酮葡糖苷酸主要存在于植物根中,而Ⅱ型黄酮葡糖苷酸主要分布于植物地上部分。黄芩根中主要含Ⅰ型黄酮葡糖苷酸,含量依次是黄芩苷>千层纸素7-O-葡糖苷酸>汉黄芩苷,主要分布在根的上部和主根,然后是侧根和茎的下部,叶片和花中含量很低(Tani et al., 1985; Xu et al., 2010),S. tomentosa和S. wrightii黄芩苷的分布也是如此(Nurul et al., 2011)。灯盏花、S. tomentosa和S. wrightii的灯盏乙素含量分布依次是叶片、花、茎和根(牟兰, 2011)。
综上所述,植物黄酮葡糖苷酸的存在与分布有明显的物种特异性,表现在不同植物种类所含的黄酮葡糖苷酸组成不同,优势种类也不同,在植物体内的分布也不同,说明不同种类植物存在不同的生物合成途径与调控机理。
2植物葡糖苷酸衍生物的生物合成途径
植物黄酮生物合成发生在花色素苷/原花色素途径的一个分支点上,黄烷酮是其直接前体,但是3种基本黄酮的分支点不同。白杨素的分支点发生在肉桂酸,4CL催化其合成肉桂酰-CoA,然后在CHS,CHI和FSⅡ催化下合成白杨素,由此合成Ⅰ型黄酮葡糖苷酸(A路线);芹菜素的分支点发生在柚皮素,FSⅡ催化其合成芹菜素,由此合成Ⅱ型黄酮葡糖苷酸(B路线);木犀草素的合成有3条途径合成木犀草素,由此合成Ⅲ型黄酮葡糖苷酸(C路线),第1条途径起点在对香豆酸,C3H催化其形成咖啡酸,4CL催化咖啡酸合成咖啡酰-CoA;第2条途径是4CL催化对香豆酸合成对香豆酰-CoA,C3H再催化其合成咖啡酰-CoA。这两条途径形成的咖啡酰-CoA在CHS,CHI和FSⅡ的作用下合成木犀草素;第3条途径是F3'H催化柚皮素合成圣草酚,FSⅡ再催化其合成木犀草素(图2)。
尽管植物体内也存在Ⅲ型黄酮葡糖苷酸,但其含量很低。尚未有报道某种植物有高含量的Ⅲ型黄酮葡糖苷酸。如灯盏花含有高含量的木犀草素(Chu et al., 2005),但木犀草素7-O-葡糖苷酸、6-羟基木犀草素7-O-葡糖苷酸含量很低,所以C路线在植物体内所占比例很低(图2用虚线表示)。因此植物体优势黄酮葡糖苷酸的积累存在3种方式,即第1类植物通过A路线合成Ⅰ型黄酮葡糖苷酸,主要发生在植物地下部分;第2类植物通过B路线合成Ⅱ型黄酮葡糖苷酸,主要发生在植物地上部分;第3类植物通过A和B两条路线合成Ⅰ型和Ⅱ型黄酮葡糖苷酸。
 图2 植物黄酮及其葡糖苷酸衍生物的生物合成途径 |
3黄酮葡糖苷酸生物合成关键酶及其基因的调控
苯丙烷类代谢是植物许多次生物质,包括类黄酮、木质素和香豆素等生物合成途径的共同起始部分(Dixon and Paiva, 1995)。PAL催化其第一部反应,而且是其限速反应。药用植物黄芪(Astragalus membranaceus)的主要类黄酮成分是槲皮素,黄芪黄化幼苗的PAL基因的表达显著受到UV辐射、机械损伤和白光的诱导,在烟草中表达会提高PAL酶的活性,增加槲皮素含量(Liu et al., 2006)。与黄芪不同,黄芩含有3个PAL基因(分别是SbPAL1, SbPAL2和SbPAL3),其中SbPAL1转录水平在茎中最高,SbPAL2在叶片中转录水平最高,SbPAL3则在根中转录水平最高(Xu et al., 2010)。黄芩叶片悬浮培养细胞培养基中加入诱导子(茉莉酸甲酯)可以提高PAL、C4H和4CL基因的表达水平,并且能够促进黄芩苷、黄芩素和汉黄芩素的生物合成。
CHS和CHI催化合成植物黄酮的直接前体物质黄烷酮,包括松属素、柚皮素和圣草酚。黄芩发根主要含有Ⅰ型黄酮葡糖苷酸,因此推测其CHS酶的底物主要是肉桂酰-CoA,而不是对香豆酰-CoA,但后来的研究表明CHS酶对肉桂酰-CoA和对香豆酰-CoA有几乎相同的催化活性。这就表明决定黄芩合成Ⅰ型黄酮葡糖苷酸的关键反应发生在CHS酶以前的上游。黄芩发根中CHS基因的表达不受到环境胁迫,如UV辐射、机械伤害和酵母的诱导,这与其他植物的CHS表达完全不同(Zhou et al ., 2003),同时也与黄芩悬浮培养细胞(来自叶片)中CHS基因的表达不同,后者受到诱导子(茉莉酸甲酯)可以提高PAL、C4H、4CL和CHS基因的表达水平,并且能够促进黄芩苷、黄芩素和汉黄芩素的生物合成。
黄酮合成酶(flavone synthase, FS)催化在黄烷酮的C2和C3之间引入双键合成黄酮,是植物黄酮生物合成的第一步反应(图2)。高等植物进化出两种完全独立的酶系统催化黄烷酮合成黄酮,即黄酮合成酶Ⅰ(FSⅠ)和黄酮合成酶Ⅱ(FSⅡ)。FSⅠ是一种2-酮戊二酸/Fe2+依赖的单加氧酶,仅存在于伞形科(Apiaceae)植物体内;FSⅡ是一种NADPH和分子氧依赖的细胞色素P-450单加氧酶,广泛存在于伞形科以外的其他植物体内(Heller et al., 1993)。FSⅡ属于植物细胞素P450蛋白的一个超基因家族,CYP93B. FSⅡ的活性很早就得到证实(Stotz et al., 1981),并已克隆多种植物FSⅡ基因cDNA全长,酵母细胞中表达的重组蛋白都能够将黄烷酮转变为相应的黄酮(Martens and Forkmann, 1999)。但是上述研究多集中于花器官或花色苷相关黄酮的合成,对于植物营养器官黄酮合成酶的研究则少有报道。药用植物高含量的黄酮葡糖苷酸主要在植物根或叶中积累,说明其黄酮合成酶基因表达有不同的时空表达模式,对环境因素的反应也可能不同。遗憾的是,药用植物黄酮葡糖苷酸生物合成研究,仍仅局限于少数苯丙烷代谢和类黄酮代谢途径少数酶基因的克隆与表达研究,如查尔酮合成酶(chalcone synthase, CHS)。
植物类黄酮的种类多样性是来自与其骨架结合的化学基团的种类与位置。黄酮最多的羟化位点是3,5,7,3'和4' (Stobiecki and Nair, 2006),其中4'-OH来自苯丙烷代谢途径中的香豆酸的4-OH;3'-OH来自类黄酮3'羟化酶(flavonoid 3'-hydroxylase)。5和或7位是在类黄酮骨架合成时,由CHS所催化形成的(Schröder et al., 1997)。但是药用植物黄芩、灯盏花等的主要黄酮均为6-OH黄酮及其葡糖苷酸衍生物,如黄芩素、黄芩苷、野黄芩素和灯盏乙素等,说明这些植物体内存在特殊的黄酮6-羟化酶(flavone 6-hydroxylase, F6H),其催化芹菜素合成野黄芩素或者是白杨素合成黄芩素(图2)。需要说明的是,尽管灯盏花含有大量的木犀草素,6-羟基木犀草素的含量却非常低,说明灯盏花F6H对木犀草素缺乏催化活性。黄芩Sb UBGAT (UDP-葡糖醛酸:黄芩素7-O-葡糖醛酸转移酶,UDP-glucuronate: baicalein 7-O-glucuronosyltransferase)催化黄酮合成黄酮葡糖苷酸,其特异性地葡糖苷酸化邻位有取代基的黄酮(如黄芩素和野黄芩素)的7-OH,而邻位没有取代基的黄酮(如芹菜素等)则不能作为底物(Nagashima et al., 2000),因此黄酮6-OH的形成对7-OH的葡糖苷酸化也有重要意义。
目前,已经报道的植物类黄酮6-羟化酶有两种,分别催化黄酮醇和黄烷酮产生6-OH。自然界植物只有少数种类的6-OH的黄酮醇(Wollenwerber and Diets, 1981),黄酮醇6-羟化酶最早从一种金腰属植物(Chrysosplenium americanum)中得到纯化,专一性地催化部分甲基化的黄酮醇的6位羟化,是一种2-酮戊二酸依赖的二甲氧酶(2-oxoglutarate-dependent dioxygenase, ODD),其cDNA已经得到克隆(Anzellotti et al., 2000)。另一种类黄酮6-羟化酶克隆自大豆(Glycine max L.),是一种P-450单甲氧酶,其酵母表达重组蛋白CYP71D9对黄烷酮活性最高,而对黄酮芹菜素和木犀草素有较低的催化活性。这些研究为研究黄酮6-OH的合成提供理论基础,但目前仍缺乏对黄酮6位与其它位点羟化分子机理的了解。
类黄酮7-O-葡萄糖醛酸转移酶(flavonoid 7-O-glucuronosyltransferase, F7GAT)催化黄酮与UDPGA (UDP-葡萄糖醛酸, UDP-glucuronic acid)合成黄酮葡糖苷酸(图2)。由于黄酮葡糖苷酸在唇形目植物,因此植物F7GAT的研究主要集中于唇形目植物。最早得到纯化的F7GAT是黄芩的Sb UBGAT,其cDNA也得到了克隆(GenBank: AB042277.1)。最新研究克隆了唇形目光紫黄芩(Scutellaria laeteviolacea)、紫苏(P. frutescens)、金鱼草(Antirrhinum majus)和芝麻(Sesamum indicum)等的F7GAT基因(Noguchi, et al., 2009)。这些植物(包括黄芩) F7GAT的底物特异性,即其糖基供体是UDPGA而不是UDP-葡萄糖,是因为单个氨基酸残基(Arg取代Trp)改变所引起的,这是黄酮葡糖苷酸形成的分子基础。但是,除唇形目外,其他植物的F7GAT尚没有研究,其他植物F7GAT的底物特异性形成的分子机理是否也是如此需要深入的研究。
作者贡献
刘毅完成文献检索及论文初稿的写作;杨生超是本项目的负责人;张广辉,陈军文指导论文写作与修改。
致谢
本研究由国家自然科学基金(8130499)资助。
参考文献
Asen S., Norris K.H., and Stewart R.N., 1972, Copigment of aurone and flavone from petals of Antirrhinum majus. Phytochemistry, 11: 2739-2741
http://dx.doi.org/10.1016/S0031-9422(00)86505-X
Chu Q.C., Wu T., Fu L., and Ye J.N., 2005, Simultaneous determination of active ingredients in Erigeron breviscapus (Vant.) Hand-Mazz. by capillary electrophoresis with electrochemical detection. Journal of Pharmaceutical and Biomedical Analysis, 37(3): 535-541
http://dx.doi.org/10.1016/j.jpba.2004.11.018
Dixon R.A., and Paiva N.L., 1995, Stress-induced phenylpropanoid metabolism. Plant Cell, 7(7): 1085-1097
http://dx.doi.org/10.1105/tpc.7.7.1085 http://dx.doi.org/10.2307/3870059
Gershenzon J and Dudareva N., 2007, The function of terpene natural products in the natural world. Nat Chem Biol, 3(7): 408-414
http://dx.doi.org/10.1038/nchembio.2007.5
Harborne J.B., 1963, Plant polyphenols. X. Flavone and aurone glycosides of Antirrhinum. Phytochemistry, 2(4): 327-334
http://dx.doi.org/10.1016/S0031-9422(00)84856-6
Heller W and Forkmann G., Biosynthesis of flavonoids. In: Harborne, J.B. (Ed.), 1993, The flavonoids: Advances in research since 1986. Chapman & Hall, London, pp. 499-535
Huang Y., De Bruyne T., Apers S., Ma Y., Claeys M., Pieters L., and Vlietinck A., 1999, Flavonoid glucuronides from Picria fel-terrae. Phytochemistry, 52(8): 1701-1703
http://dx.doi.org/10.1016/S0031-9422(99)00242-3
Kawasaki M., Hayashi T., Arisawa M., Morita N., and Berganza L.H., 1988, 8-Hydroxytricetin 7-glucuronide, a β-glucuronidase inhibitor from Scoparia dulcis. Phytochemistry, 27(11): 3709-3711
http://dx.doi.org/10.1016/0031-9422(88)80811-2
Li L., Liu D.Y., Jiang J., and Hu P., 2006, Pharmacological progress of scutellarin. Chin Tradit Herb Drugs, 37(8): 9-11
Lim E.K., Ashford D.A., Hou B., Jackson R.G., and Bowles D.J., 2004, Arabidopsis glycosyltransferases as biocatalysts in fermentation for resioselective synthesis of diverse quercetin glucosides. Biotechnol Bioeng, 87(5): 623-631
http://dx.doi.org/10.1002/bit.20154
Liu J.J., Huang T.S., Cheng W.F., and Lu F.J., 2003, Baicalein and baicalin are potent inhibitors of angiogenesis: inhibition of endothelial cell proliferation, migration and differentiation. International Journal of Cancer, 106(4): 559-565
http://dx.doi.org/10.1002/ijc.11267
Liu R., Xu S., Li J., Hu Y., and Lin Z., 2006, Expression profile of a PAL gene from Astragalus membranaceus var Mongholicus and its crucial role in flux into flavonoid biosynthesis. Plant Cell Reports, 25(7): 705-710
http://dx.doi.org/10.1007/s00299-005-0072-7
Macías F.A., Galindo J.L., and Galindo J.C., 2007, Evolution and current status of ecological phytochemistry. Phytochemistry, 68(22-24): 2917-2936
http://dx.doi.org/10.1016/j.phytochem.2007.10.010
Martens S and Forkmann G., 1999, Cloning and expression of flavone synthaseⅡ from Gerbera hybrids. The Plant Journal, 20(5): 611-618
http://dx.doi.org/10.1046/j.1365-313X.1999.00636.x
Martens S., and Mithöfer A., 2005, Flavones and flavonesynthases. Phytochemistry, 66(20): 2399-2407
http://dx.doi.org/10.1016/j.phytochem.2005.07.013
Miyaichi Y., Imoto Y., Tomimori T., and Namba T., 1988, Studies on the nepalese crude drugs. IX. On the flavonoid constitüents of the root of Scutellaria scandens Buch.-Ham.ex D.Don, Chem Pharm Bull, 36(7): 2371-2376
http://dx.doi.org/10.1248/cpb.36.2371
Moy L., 2011, Cloning of chalcone synthase gene in Erigeron breviscapus and relation between its expression and Scutellarin content, Thesis for M.S., Yunnan Agriculture University, Supervisor: Yang S.C., pp.1-49 (牟兰, 2011, 灯盏花查尔酮合成酶基因克隆及其表达与灯盏乙素含量关系研究, 硕士学位论文, 云南农业大学, 导师: 杨生超, pp.1-49)
Nagashima S., Hirotani M., and Yoshikawa T., 2000, Purification and characterization of UDP-glucuronate:baicalein 7-O-glucuronosyltransferase from Scutellaria baicalensis Georgi. cell suspension cultures. Phytochemistry, 53(5): 533-538
http://dx.doi.org/10.1016/S0031-9422(99)00593-2
Noguchi A., Horikawa M., Fukui Y., Fukuchi-Mizutani M., Iuchi-Okada A., Ishiguro M., Kiso Y., Nakayama T., and Ono E., 2009, Local differentiation of sugar donor specificity of flavonoid glycosyltransferase in Lamiales. Plant Cell, 21(5): 1556-1572
http://dx.doi.org/10.1105/tpc.108.063826
Qiao S., Shi R., Liu M., Zhang C., Yang W., Shi X.W., Jiang X.J., Wang C.Y., and Wang Qiao., 2011, Simultaneous quantification of flavonoids and phenolic acids in Herba Scutellariae barbatae and its confused plants by high performance liquid chromatographytandem mass spectrometry. Food Chemistry, 129: 1297-1304
http://dx.doi.org/10.1016/j.foodchem.2011.05.064
Ross J., Li Y., Lim E.K., and Bowles D.J., 2001, Higher plant glycosyltransferases. Genome Biol, 2: reviews3004-reviews3004.6
Schröder J.,1997, A family of plant-specific polyketide synthases: facts and predictions. Trends Plant Sci, 2(10): 373-378
http://dx.doi.org/10.1016/S1360-1385(97)87121-X
Stobiecki M and Kachlicki P., 2006, in: Grotewold, E. (Ed.), The Science of Flavonoids, Springer, New York, pp. 47-69
http://dx.doi.org/10.1007/978-0-387-28822-2_2
Stotz G and Forkmann G., 1981, Oxidation of flavanones to flavones with flower extracts of Antirrhinum majus (snapdragon). Zeitschrift für Naturforschung, 36c: 737-741
Subramanian S.S and Nair A.G.R., 1973, Scutellarin and hispidulin 7-O-glucuronide from the leaves of Clerodendrum indicum and Clerodendron infortunatum. Phytochemistry, 12: 1195
http://dx.doi.org/10.1016/0031-9422(73)85054-X
Takino Y., Miyahara T., Arichi E., Arichi S., Hayashi T., and Karikura., 1987, Determination of some flavonoids in Scutellariae radix by high-performance liquid chromatograpgy. Chem Pharm Bull, 35(8): 3494-3497
Tani T., Katsuki T., Kubo M., and Arichi S., 1985, Histochmistry. Ⅶ. Flavones in Scutellarias radix. Chem Parm Bull., 33(1): 4894-4900
http://dx.doi.org/10.1248/cpb.33.4894
Tomimori T., Jin H., Miyaichi Y., Toyofuku S., and Namba T., 1985, Studies on the constituents of Scutellaria Species. Ⅵ. On the flavonoid constituents of the root of Scutellaria baicalensis Georgi (5), Quantitative analysis of flavonoids in Scutellaria roots by high-performance liquid chromatography, Yakugaku Zasshi, 105: 148-155
Wollenwerber E., and Diets V.H., 1981, Occurrence and distribution of free flavonoid aglycones in plants. Phytochemistry, 20(5): 869-932
http://dx.doi.org/10.1016/0031-9422(81)83001-4
Wozniak D., Lamer-Zarawska E., and Matkowski A., 2004, Antimutagenic and antiradical properties of flavones from the roots of Scutellaria baicalensis Georgi. Nahrung/Food, 48(1): 9-12
Xu H., Park N.I., Li X.H., Kim Y.K., Lee S.Y., and Park S.U., 2010, Molecular cloning and characterization of phenylalanine ammonia-lyase, cinnamate 4-hydroxylase and genes invoved in flavone biosynthesis in Scutellaria baicalensis. Bioresource Technology, 101(24): 9715-9722
http://dx.doi.org/10.1016/j.biortech.2010.07.083
Yamazaki M., Nakajima J., Yamanashi M., Sugiyama M., Makita Y., Springob K., Awazuhara M., and Saito K., 2003, Metabolomics and differential gene expression in anthocyanin chemo-varietal forms of Perilla frutescens. Phytochemistry, 62(6): 987-995
http://dx.doi.org/10.1016/S0031-9422(02)00721-5
Yang X.F., He W., and Lu W.H., 2003, Effects of scutellarin on liver function after brain ischemia/reperfusion in rats. Acta Pharmacol Sin, 24(11): 1118-1124
Yoshida K., Kameda K., and Kondo T., 1993, Digulucuronoflavones from purple leaves of Perilla ocimoides. Phytochemistry, 33: 917-919
http://dx.doi.org/10.1016/0031-9422(93)85304-A
Zhang Z.F., Sun W.X., Luo P., Wu L.P., Ye L.M., and Zhang H., 2008, Simultaneous determination of five main active constituents of Erigeron multiradiatus by HPLC-DAD-MS, Journal of Pharmaceutical and Biomedical Analysis, 48(3): 980-985
http://dx.doi.org/10.1016/j.jpba.2008.06.010
Zhou X.Q., Liang H., Lu X.H., Cai S.Q., Wang B., and Zhao Y.Y., 2009, Flavonoids from Scutellaria baicalensis and their bioactivities, Beijing Daxue Xuebao (Journal of Peking University (Health sciences), 41(5): 578-584 (周锡钦, 梁鸿, 路新华, 蔡少青, 王邠, 赵玉英, 2009, 中药黄芩主要黄酮类成分及其生物活性研究. 北京大学学报(医学版), 41(5): 578-584)
Zhou Y., Magashima S., Hirotani M., Suzuki H., and Yoshikawa T., 2003, Expression of the chaconne synthase gene in Scutellaria baicalensis hairy root cultures was unusually reduced by environmental stresses. Plant Biotechnology, 20(3): 207-214
http://dx.doi.org/10.5511/plantbiotechnology.20.207