2重庆市水稻工程中心, 重庆, 401329
3重庆中一种业有限公司, 重庆, 400060
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2015 年, 第 13 卷, 第 2 篇
收稿日期: 2015年01月07日 接受日期: 2015年02月08日
本文首次以英文发表在 Molecular Plant Breeding上。现依据版权所有人授权的许可协议,采用 Creative Commons Attribution License 协议对其进行授权,用中文再次发表与传播。只要对原作有恰当的引用, 版权所有人允许并同意第三方无条件的使用与传播。如果读者对中文含义理解有歧义,请以英文原文为准。
引用格式(中文):
欧阳杰等, 2015, 水稻雄性不育突变体012S-3的遗传分析和基因定位, 分子植物育种(online), 13(2): 1009-1014 (doi: 10.5376/mpb.cn.2015.13.0002)
引用格式(英文):
Ou et al., 2015, Genetic Analysis and Gene Mapping of A Male Sterile Mutant 012S-3 in Rice, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 13(2): 1009-1014 (doi: 10.5376/mpb.cn.2015.13.0002)
雄性不育是水稻杂种优势利用的重要资源,对雄性不育现象的研究具有重要理论意义和实践价值。本研究以自然突变的水稻雄性不育突变体012S-3为试验材料,对其表型特征和花粉育性等进行调查,并构建遗传群体,利用分子标记对目的基因进行初步定位,然后应用基因组重测序技术对其进行精细定位。结果表明,012S-3是一个典型的无花粉普通型雄性不育材料,其不育性状受1对隐性核基因控制。初步定位分析目的基因与SSR标记RM6081存在连锁关系,其遗传距离约为34.4 cm;进一步的精细定位分析,找到3个候选基因:LOC_Os07g35880、LOC_Os07g35920和LOC_Os07g35940,其中LOC_Os07g35880 和LOC_Os07g35940编码β-淀粉酶,属于水稻中新发现的花粉致死基因。该不育基因的成功定位可为其进一步的分离克隆及其在水稻分子设计育种中的应用奠定了基础。
研究背景
雄性不育是农作物杂种优势利用的基础。雄性不育系培育是杂种水稻育种的关键步骤,目前全世界推广的杂交水稻来源于利用核质互作雄性不育的“三系法”和温光敏核不育的“两系法”。“三系法”由于受恢保关系限制,育种程序复杂、周期长,不能随意配制杂交组合、遗传资源利用率较低,并且杂交种子生产较繁琐;“两系法”虽然杂交组合配制不受恢保关系限制,但不育系的育性易受环境温度和光照变化的影响,杂交种子生产风险较大。利用育性不受光温影响、杂交组合配制不受恢保关系制约的单隐性核不育基因培育的不育系能够克服“三系法”和“两系法”的缺陷,兼具“三系法”的育性稳定性和“两系法”配组灵活性的优点。近年来,美国杜邦先锋公司率先在玉米中实现了基于隐性核不育的杂种优势利用,并将其种子生产技术命名为Seed production technology (SPT)技术(Hondred et al., 2009, http://www.ipaustralia.com.au/ applicant/e-i-du-pont-de-nemours-and-company/patents/AU2009214457/),其原理是利用现代生物技术,将花粉育性恢复基因、花粉致死基因和标记筛选基因紧密连锁,构建植物遗传转化表达载体,通过转基因技术,导入到隐性核雄性不育突变体中,从而恢复不育系的育性使之保持和繁殖,实现一系两用的目的,有效地解决了隐性核雄性不育系的繁殖难题。
尽管SPT技术最早应用于玉米,但是其技术思想同样也可以应用于水稻。2010年9月,在中国科技部“国家高技术研究发展计划”(批准号:2009AA101201; 2011AA10A107)的支持下,SPT技术思想在水稻中率先得到了证实和应用,并被称之为“智能不育杂交育种技术”或“第三代杂交水稻技术”。中国科技部网站对该重要技术突破进行了报道(http://www.most.gov.cn/kjbgz/201009/t2010 0920_82153.htm)。智能不育技术将现代生物技术与传统育种方法成功结合,使得水稻雄性隐性核不育基因的利用成为了可能。
根据GRAMENE (http://www.gramene.org/)网站的数据库记载,目前在该数据库登录的水稻雄性不育基因或突变体有137个,其中有35个基因实现了染色体定位,而实现定位的基因中仅有14个被克隆,包括第1染色体上的ABI5 (Zou et al., 2008)、MSP1 (Nonomura et al., 2003)、RTS (Luo et al., 2006)、SaF和SaM (Long et al., 2008),第3染色体上的MEL1 (Nonomura et al., 2007)和PAIR1 (Nonomura et al., 2004),第6染色体上的AID1 (Zhu et al., 2004)和nop (Jiang et al., 2005),第7染色体上的UDT1 (Jung et al., 2005),第8染色体上的XA13 (Chu et al., 2006),第9染色体上的RAD (Moritoh et al., 2005),第10染色体上的WDA1 (Jung et al., 2006),第12染色体上的Dmc1 (Deng and Wang, 2007)。由此可见,水稻中还有大量的雄性不育基因没有被定位和克隆,这些基因的进一步的定位与克隆将有助于全面地了解雄配子体发育的分子机制,并为水稻SPT技术的建立提供丰富的基因和种质资源。
本研究对一个衍生自武育粳3号与粳糯合川糯杂交后代的雄性不育突变材料(012S-3)进行了表型鉴定、遗传分析、分子标记和基因组重测序定位,旨在为该不育基因的分离克隆及其在水稻分子设计育种中的应用奠定基础。
1结果与分析
1.1 012S-3突变体的表型特征
与F3群体姊妹可育株相比,012S-3突变体的株高、株型和叶型都没有明显的变化(图1A);颖壳大小和形态也没有明显差异(图1B);012S-3突变体植株开花时,花药瘦小、干瘪,外观呈乳白色,用碘染色法镜检花粉育性,未发现花粉颗粒(图1C),说明012S-3属于无花粉型不育突变体。
.png) 图1 012S-3突变体的形态特征及花粉I2-KI染色 注: A: 012S-3突变体(右)与姊妹可育株(左)的植株形态; B: 开花时012S-3突变体(右)与姊妹可育株(左)颖壳和花药; C: 012S-3突变体(右)与姊妹可育株(左)的花粉I2-KI染色 Figure 1 Morphological characteristic of 012S-3 mutants and I2-KI staining of pollen grains Note: A: The plant morphology of 012S-3 mutant (right) and wild-type fertile plant (left); B: The glumes and anthers of 012S-3 mutant (right) and wild-type fertile plant (left) during flowering; C: The pollens of 012S-3 mutant (right) and wild-type fertile plant (left) by I2-KI staining |
1.2 012S-3雄性不育基因的遗传分析
分别在重庆巴南区忠兴镇(海拔290 m)、南川区河图乡(海拔780 m)和海南英州观察012S-3不同播种期的小花育性,突变体在不同光周期和温度条件下均表现相同的不育性,说明该不育特性不受光、温等环境因子调控,属于普通雄性不育类型。
012S-3与4917 (粳稻临早1号与宁粳4号杂交后代)、4923 (龙粳26与武连粳1号杂交后代)和5011B (籼粳交保持系) 3份育性正常的水稻材料杂交,所得F1群体的花粉育性正常,结实率达到71.2%~80.8%。同时,在F2群体中,各植株的花粉育性和小穗育性差异十分显著,可明显分为可育和不育两类,可育株花药饱满,外观金黄色,开花时花药开裂、散粉正常,套袋自交结实率在70%以上;而不育株花药瘦小、干瘪,外观乳白色,开花时无花粉散出,套袋自交不结实,没有中间过渡类型。统计F2群体中这两种类型植株数,可育与不育植株数符合3:1分离比例(表1),表明该突变体的雄性不育特性是由1对隐性核基因控制。
1.3 012S-3雄性不育基因的染色体定位
以(012S-3/4923) F2群体中的235个不育单株为定位群体,用360对较均匀分布于水稻12条染色体上的SSR引物扩增亲本012S-3和4923的DNA,然后用在两亲本间表现出多态性的引物扩增可育和不育近等基因池,再用在池中检测到多态的引物扩增F2不育单株。结果发现,位于水稻第7染色体长臂的SSR标记RM6081与目标基因存在连锁关系,遗传距离是34.4 cm (图2)。
为了进一步定位目的基因,对(012S-3/4923) F2群体中约40个可育单株的DNA混合池、约120个不育单株的DNA混合池及亲本012S-3单株做高通量测序,然后对测序结果进行比对,不育单株混合池先与亲本012S-3单株寻找相同纯合突变,然后再与可育单株混合池寻找非相同突变(即亲本有, 可育单株混合池无的纯合突变)。结果在第7条染色体上找到1 170个SNP突变位点,其中突变在基因上的有390个,结合突变基因引起的表型变化(不育)及初步定位在染色体的大概位置,找到3个候选基因:LOC_Os07g35880、LOC_Os07g35920和LOC_Os07g35940,其中LOC_Os07g35880和LOC_Os07g35940都是正义链上编码β-淀粉酶的基因,而LOC_Os07g35920是反义链上的一个编码基因。
 |
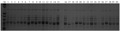 图2 SSR标记RM6081在(012S-3/4923)F2群体中的分离 注: M: 100 bp DNA ladder marker (Takara); 1~3: F2可育株混合池; 4~6: F2不育株混合池; 7~15: F2不育单株; 16~30: F2可育单株 Figure 2 Segregation of SSR marker RM6081 in the F2 population of 012S-3/4923 Note: M: 100 bp DNA ladder marker (Takara); 1~3: Pools of fertile plants in F2; 4~6: Pools of sterile plants in F2; 7~15: Sterile plants in F2; 16~30: Fertile plants in F2 |
2讨论
2.1基因的多效性
孙小秋等(2011)发现的水稻雄性不育突变体801A,表现为颖壳变细、扭曲,剑叶变短、变窄、内卷,穗颈包颈等特征,这说明它可能存在着“一因多效”的问题,这类种质资源负向性状十分明显,对育种利用极其不利。而012S-3突变体除了育性发生变化外,其余表型如株型、株高、叶型和颖壳等与野生型和F3群体姊妹可育株相比都无明显变化,不存在“一因多效”的问题,有利于进一步的育种利用。
2.2分子标记定位和重测序定位相结合
目前,GRAMENE数据库中记载的雄性不育基因被定位在第7染色体上的仅有4个,它们分别是MS8、PMS1、TMS2和UDT1。MS8对环境不敏感,也属于普通的雄性不育基因,被初步定位于第7染色体39.4~82.2 cm (JRGP RFLP 2000)之间;PMS1属于光敏雄性不育基因,TMS2属于温敏雄性不育基因,这两个基因的表型与目的基因的表型不相符;UDT1也属于无花粉型普通雄性不育基因,该基因已经被克隆,定位于第7染色体75.9~78.9 cm (JRGP RFLP 2000)和21 813 241~21 815 056 bp (Rice japonica MSU6)之间,而我们的初步定位将目的基因定位于距分子标记RM6081 (41.7~41.7 cm, IRMI 2003)的遗传距离为34.4 cm的位置,也就是大约在染色体41.7+34.4=76.1 cm的位置,结合UDT1的表型及在染色体的位置。我们曾怀疑突变体012S-3也是由UDT1基因突变引起的,但是通过进一步的基因组重测序,发现突变体012S-3的UDT1基因并没有发生突变,而离UDT1基因不远的β-淀粉酶基因LOC_Os07g35880、LOC_Os07g35920和LOC_Os07g35940 (21 471 055~21 506 356 bp, Rice japonica MSU7)的编码区域发生了多个SNP位点突变。
2.3水稻花粉致死基因
SPT技术主要包括三大基因结构元件:花粉育性恢复基因、花粉致死基因和标记筛选基因。其中,花粉致死基因起着至关重要的意义,它在花粉发育后期杀死转基因花粉,从而达到防止转基因花粉漂移的目的(Hondred et al., 2009, http://www.ipaustralia.com.au/applicant/e-i-du-pont-de-nemours-and-company/patents/ AU2009214457/)。目前水稻中已经克隆了超过30个的隐性核不育基因(王超等, 2013),因此其对应的花粉育性恢复基因也不难获得。而水稻中的花粉致死基因仅仅有一个被报道:Osg1,该基因编码一个β-1,3-葡聚糖酶,Osg1基因RNAi抑制植株(Osg1-RI植株)表现为雄性不育,原因是从四分体时期到小孢子早期这一过程中,Osg1-RI植株花粉中包裹四分体的胼胝质壁的降解被延迟了,导致小孢子无法及时释放到花粉囊腔中,使其进一步的发育受到阻碍,最终导致花粉细胞的败育(Wan et al., 2011)。最早用于玉米SPT保持系表达盒的花粉致死基因zm-aa1编码一个α-淀粉酶,而本研究中定位到的是一个β-淀粉酶基因,可能同样起到花粉致死的效果,该基因的定位为其进一步的克隆和功能验证奠定了良好的基础,从而为水稻“智能不育杂交育种技术”的建立提供有用的基因和种质资源。
3材料与方法
3.1材料
水稻雄性不育突变体材料012S-3来源于一个普通粳稻(武育粳3号)与粳糯(合川糯)杂交后代的自然突变体。其他野生型水稻材料4917、4923和5011B,均由重庆市农业科学院水稻研究所提供。
3.2突变体外观形态观察及花粉育性鉴定
突变体外观形态直接在田间观察并拍照;水稻孕穗期将可育植株和不育植株移栽到塑料盆中,然后进行正常的肥水管理,等到开花初期,取当天将要开花的小穗,在载玻片上挑取其花药并捣碎,用浓度为1%的I2-KI染色,置于重庆奥特光学仪器有限责任公司生产的生物显微镜BK5000下观察花粉育性状况。
3.3不育性状的遗传分析
2012年秋季在海南陵水英州用突变体012S-3为母本,分别与4917、4923和5011B等杂交,春季种植F1并套袋自交,2013年在重庆南川河图、大观种植F2。成熟时以群体为单位分单株统计不育性状的分离情况,进行遗传分析。
3.4基因定位
根据育性调查与分析结果,从F2 (012S-3/4923)中选取40株正常可育株和235株不育株组成初步定位群体,分单株叶片提取DNA,同时,随机选取18株正常可育株构建3个DNA池(每池6株),用18株不育株构建另外3个DNA池,6个池同时检测多态性。水稻叶片总DNA提取采用CTAB法(Murray and Thompson, 1980)。SSR分析中所用到的引物序列引自Gramene网站(http://www.gramene.org),引物由上海生工公司合成。PCR试剂从北京鼎国昌盛生物技术有限责任公司购买,使用德国Senso Labcycler Basic Plus PCR仪进行扩增。PCR反应体系为超纯水6.1 μL、10× Buffer 1 μL、2.5 mmol/L dNTPs 0.8 μL、rTaq酶(2 μ/μL) 0.1 μL、上下游引物各1 μL、DNA模板1 μL。PCR扩增程序为95℃,4 min;94℃,30 s,55℃,30 s,72℃,40 s;72℃,7 min;25℃,1 min;32个循环。利用10%的非变性PAGE胶对PCR产物进行检测,银染显色,用佳能数码相机IXUS80IS拍照记录基因型数据。
为了进一步对目的基因进行精细定位,40株正常可育株的DNA混合池、约120株不育株的DNA混合池和1株012S-3突变株的DNA被送往苏州泓迅生物科技有限公司,委托其对上述3个样本进行基因组重测序。测序是使用illumina HiSeq2500高通量测序仪进行测序。产生的约30G 数据与水稻基因组比对,将产生的read还原到基因组序列上,然后根据比对结果先寻找每个样本的点突变,这些突变可能是与育性有关的点突变。点突变进一步通过是否在编码基因上进行筛选,筛去不是在编码区的点突变。最后结合初步定位的结果以及与突变体表型相关的功能基因的信息对点突变做出进一步的筛选。
作者贡献
欧阳杰是本研究的实验设计和实验研究的执行人,并完成数据分析,论文初稿的写作;王楚桃参与实验设计,试验结果分析;朱子超、何永歆、蒋刚和黄乾龙负责实验材料的田间种植与管理;管玉圣和熊英辅助实验的执行;李贤勇是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者阅读并同意最终的文本。
致谢
本研究由重庆市农业科学院“百名博士引进培养工程”项目(2013-2015)和重庆科技攻关项目(cstc2012ggC80002)共同资助。
Chu Z.H., Yuan M., Yao J.L., Ge X.J., Yuan B., Xu C.G., Li X.H., Fu B.Y., Li Z.K., Bennetzen J.L., Zhang Q.F., and Wang S.P., 2006, Promoter mutations of an essential gene for pollen development result in disease resistance in rice, Genes Dev., 20(10): 1250-1255
http://dx.doi.org/10.1101/gad.1416306
Deng Z.Y., and Wang T., 2007, OsDMC1 is required for homologous pairing in Oryza sativa, Plant Mol. Biol., 65(1-2): 31-42
http://dx.doi.org/10.1007/s11103-007-9195-2
Jiang S.Y., Cai M., and Ramachandran S., 2005, The Oryza sativa no pollen (Osnop) gene plays a role in male gametophyte development and most likely encodes a C2-GRAM domain-containing protein, Plant Mol. Biol., 57(6): 835-853
http://dx.doi.org/10.1007/s11103-005-2859-x
Jung K.H., Han M.J., Lee D.Y., Lee Y.S., Schreiber L., Franke R., Faust A., Yephremov A., Saedler H., Kim Y.W., Hwang I., and An G., 2006, Wax-deficient anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development, Plant Cell, 18(11): 3015-3032
http://dx.doi.org/10.1105/tpc.106.042044
Jung K.H., Han M.J., Lee Y.S., Kim Y.W., Hwang I., Kim M.J., Kim Y.K., Nahm B.H., and An G., 2005, Rice undeveloped tapetum1 is a major regulator of early tapetum development, Plant Cell, 17(10): 2705-2722
http://dx.doi.org/10.1105/tpc.105.034090
Long Y.M., Zhao L.F., Niu B.X., Su J., Wu H., Chen Y.L., Zhang Q.Y., Cuo J.X., Zhuang C.Q., Mei M.T., Xia J.X., Wang L., Wu H.B., and Liu Y.G., 2008, Hybrid male sterility in rice controlled by interaction between divergent alleles of two adjacent genes, Proc. Natl. Acad. Sci. USA, (48):18871-18876
http://dx.doi.org/10.1073/pnas.0810108105
Luo H., Lee J.Y., Hu Q., Nelson V.K., Eitas T.K., Lickwar C., Kausch A.P., Chandlee J.M., and Hodges T.K., 2006, RTS, a rice anther-specific gene is required for male fertility and its promoter sequence directs tissue-specific gene expression in different plant species, Plant Mol. Biol., 62(3): 397-408
http://dx.doi.org/10.1007/s11103-006-9031-0
Moritoh S., Miki D., Akiyama M., Kawahara M., Izawa T., Maki H., and Shimamoto K., 2005, RNAi-mediated silencing of OsGEN-L (OsGEN-like), a new member of the RAD2/XPG nuclease family, causes male sterility by defect of microspore development in rice, Plant Cell Physiol., 46(5): 699-715
http://dx.doi.org/10.1093/pcp/pci090
Murray M.G., and Thompson W.F., 1980, Rapid isolation of high molecular weight plant DNA, Nucleic Acids Res., 8(19): 4321-4325
http://dx.doi.org/10.1093/nar/8.19.4321
Nonomura K., Nakano M., Fukuda T., Eiguchi M., Miyao A., Hirochika H., and Kurata N., 2004, The novel gene HOMOLOGOUS PAIRING ABERRATION IN RICE MEIOSIS1 of rice encodes a putative coiled-coil protein required for homologous chromosome pairing in meiosis, Plant Cell, 16(4): 1008-1020
http://dx.doi.org/10.1105/tpc.020701
Nonomura K.I., Miyoshi K., Eiguchi M., Suzuki T., Miyao A., Hirochika H., and Kurata N., 2003, The MSP1 gene is necessary to restrict the number of cells entering into male and female sporogenesis and to initiate anther wall formation in rice, Plant Cell, 15(8): 1728-1739
http://dx.doi.org/10.1105/tpc.012401
Nonomura K.I., Morohoshi A., Nakano M., Eiguchi M., Miyao A., Hirochika H., and Kurata N., 2007, A germ cell specific gene of the ARGONAUTE family is essential for the progression of premeiotic mitosis and meiosis during sporogenesis in rice, Plant Cell, 19(8): 2583-2594
http://dx.doi.org/10.1105/tpc.107.053199
Sun X.Q., Fu L., Wang B., Xiao Y.H., and Deng X.J., 2011, Genetic analysis and molecular mapping of the rice male sterile mutant 802A, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 44(13): 2633-2640 (孙小秋, 付磊, 王兵, 肖云华, 邓晓建, 2011, 水稻雄性不育突变体802A的遗传分析及基因定位, 中国农业科学, 44(13): 2633-2640)
Wan L.L., Zha W.J., Cheng X.Y., Liu C., Lv L., Liu C.X., Wang Z.Q., Du B., Chen R.Z., Zhu L.L., and He G.C., 2011, A rice β-1,3-glucanase gene Osg1 is required for callose degradation in pollen development, Planta, 233(2): 309-323
http://dx.doi.org/10.1007/s00425-010-1301-z
Wang C., An X.L., Zhang Z.W., Yang Q., Rao L.Q., Chen X.B., Fang C.C., and Wan X.Y., 2013, Research progress and prospect of breeding technological system based on recessive genic male-sterile genes in plants, Zhongguo Shengwu Gongcheng Zazhi (China Biotechnology), 33(10): 124-130 (王超, 安学丽, 张增为, 杨青, 饶力群, 陈信波, 方才臣, 万向元, 2013, 植物隐性核雄性不育基因育种技术体系的研究进展与展望, 中国生物工程杂志, 33(10): 124-130)
Zhu Q.H., Ramm K., Shivakkumar R., Dennis E.S., and Upadhyaya N.M., 2004, The ANTHER INDEHISCENE1 gene encoding a single MYB domain protein is involved in another development in rice, Plant Physiol., 135(3): 1514-1525
http://dx.doi.org/10.1104/pp.104.041459
Zou M.J., Guan Y.C., Ren H.B., Zhang F., and Chen F., 2008, A bZIP transcription factor, OsABI5, is involved in rice fertility and stress tolerance, Plant Mol. Biol., 66(6): 675-683
http://dx.doi.org/10.1007/s11103-008-9298-4