2. 云南省农业科学院农业环境资源研究所, 昆明, 650205
3. 昆明学院生命科学与技术系, 昆明, 650214
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2012 年, 第 10 卷, 第 25 篇 doi: 10.5376/mpb.cn.2012.10.0025
收稿日期: 2012年05月09日 接受日期: 2012年05月17日 发表日期: 2012年06月01日
引用格式(中文):
孔垂思等, 2012, 氮饥饿诱导对稻瘟菌分泌蛋白组影响的研究, 分子植物育种(online) Vol.10 No.25 pp.1179-1184 (doi: 10.5376/mpb. cn.2012.10.0025)
引用格式(英文):
Kong et al., 2012, Proteomic Analysis of Nitrogen Starvation Induced Secretome from Magnaporthe oryzae, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.10 No.25 pp.1179-1184 (doi: 10.5376/mpb.cn.2012.10.0025)
氮是生物必不可少的营养元素,病原菌在与寄主的互作中对氮元素的竞争也就显得尤为重要。利用蛋白质双向凝胶电泳技术分析在含氮培养条件下稻瘟病菌蛋白质谱的变化,可了解该病菌氮营养代谢的特征,分析不同组分蛋白质的毒性,可了解这些蛋白在与寄主互作中氮营养争夺的特点,从营养争夺的角度分析稻瘟病菌与水稻互作的机制。本实验首先利用液相等电聚焦电泳分离稻瘟病菌Y98-16菌株在氮饥饿诱导下的分泌蛋白,并在水稻感病品种丽江新团黑谷(LTH)的叶片上进行致伤接种。结果显示,等电点4.2~6.9范围内的分泌蛋白中对LTH叶片有较强的毒性。然后利用pI4-7分离范围的胶条对全氮培养与氮饥饿诱导下稻瘟病菌分泌蛋白进行比较蛋白质组学的研究。结果表明Y98-16在全氮培养条件下平均检测到238个蛋白点,在氮饥饿诱导下平均检测到173个蛋白点,其中表达量有显著变化的蛋白点有51个(上调22个, 下调29个),利用串联质谱鉴定了其中26个蛋白质。对这些蛋白质功能的分析表明,这些蛋白功能涉及代谢、催化、应激、发育、防御/抗胁迫、细胞分裂等过程。
由Magnaporthe oryzae侵染水稻引起的稻瘟病是水稻生产上危害最为严重的病害(Baker et al, 1997)。稻瘟菌也是研究植物与真菌病原相互作用的重要模式生物。近年来的研究表明,病原菌分泌到细胞外的蛋白质在其与寄主的互作中发挥着关键作用(Stergiopoulos and de Wit, 2009)。利用双向电泳等蛋白质组学研究方法对于植物病原真菌菌丝体及分泌蛋白质的研究为揭示其发育和致病机制提供了大量的候选蛋白进行下一步研究(Gonzalez-Fernandez and Jorrin-Novo, 2012; Espino et al, 2010)。Talbot等人的实验表明氮饥饿胁迫能够诱导稻瘟病菌产生可形成病斑的致病性分泌蛋白(Talbot et al, 1997)。苏源等发现不同致病力菌株的稻瘟病菌在氮饥饿胁迫下产生分泌蛋白的致病力也不同(周晓罡等, 2009)。这些结果表明,了解氮饥饿胁迫对稻瘟病菌分泌蛋白组的影响对于阐释其致病机制具有重要意义。蛋白质组由Marc Wilkins于1995年首次提出,是指在特定的时间和空间上,一个细胞或一个组织基因组所表达的全部相应蛋白质(Wasinger et al., 1995)。双向电泳和质谱技术是目前广泛使用的蛋白质组学实验方法。本课题组已经初步建立了稻瘟病菌分泌蛋白双向电泳的试验方法并对不同致病力菌株的分泌蛋白质的电泳图谱进行了比较(蔡永占等,2010)。本实验中首先利用液相等电聚焦将稻瘟病菌的分泌蛋白质按等电点进行组分分离。将这些组分在水稻感病品种LTH的叶片上进行致病力大小的检测而获得主要致病蛋白质分布的等电点范围,根据此范围选择相应等电点分离区间的胶条分别对稻瘟病菌在全氮培养和氮饥饿诱导条件下的分泌蛋白质进行双向电泳。通过对二维图谱的分析比较而获得表达量差异点并进行质谱鉴定。
1结果与分析
1.1液相等电聚焦及致病力检测
通过电泳,Rotofor将稻瘟病菌分泌的总蛋白质分离为酸性蛋白质(pH<7)和碱性蛋白质(pH>7)两个类群共20个组分。各组分测得的pH梯度分布见图1。结果表明Rotofor能够有效的将稻瘟菌分泌的总蛋白按等电点分开成20个组分。活性测试中在这两个类群的蛋白中均有致病作用的组分并且症状不完全相同,酸性蛋白活性组分造成的病斑要大于碱性蛋白。这初步说明稻瘟病菌分泌蛋白质的致病性是多个蛋白质共同作用的结果,酸性蛋白质可能是其中主要的致病成分。图2中展示了部分组分接种的典型症状。其中,致病性较强的组分集中于酸性蛋白2、6、7、9和10这五个组分(pH4.2~pH 6.9)。
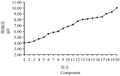 图1 Y98-16氮饥饿诱导下总蛋白经液相等电聚焦电泳分离后各组分pH |
图2 Y98-16分泌总蛋白Rotofor液相等电聚焦电泳后部分组分接种丽江新团黑谷叶片后的症状 |
1.2双向电泳结果及差异分析
本实验分别获得菌株Y98-16在全氮培养与氮饥饿诱导下的2-DE分泌蛋白考染图谱,且制备的凝胶染色效果好、本底浅,各点分离清晰,无明显横向或纵向拖尾,能满足双向电泳软件分析的需要,从图中(图3所示)可以看出分泌蛋白在116.0 kD~14.4 kD之间均有分布,主要集中在80.0 kD~30.0 kD,蛋白PI从5~6广泛存在,用PDQuest7.4图像分析软件构建了分泌蛋白质组匹配差异图谱,其中在全氮培养条件下菌株分泌蛋白质组图谱上检测到平均238个蛋白点,在氮饥饿条件下菌株分泌蛋白电泳图谱上检测到平均173个蛋白点,两者均有表达的蛋白质点有139个,分别占各自的80%和58%,其中差异显著51个(其中氮饥饿诱导下蛋白表达量相对于全氮培养下上调的有22个, 下调的有29个),在全氮培养下表达的有99个,在氮饥饿下表达的有34个(表1)所示,由此可看出两处理间蛋白表达的数量和表达量存在差异,可用于差异分析。
 图3 稻瘟病菌Y98-16分泌蛋白的2-DE图谱 |
表1 Y98-16在全氮培养与氮饥饿条件下的分泌蛋白表达差异比较 |
1.3差异表达蛋白的质谱鉴定
从Y98 -16菌株在全氮培养与氮饥饿诱导下显著差异表达的分泌蛋白中随机挖取蛋白点30个,鉴定了26个蛋白质点,图3中标出了这些差异点的位置。根据Gene ontology程序对每个鉴定的蛋白质功能进行了分类,分析结果见表2。在被鉴定的26个蛋白质点中,除去6个功能未知或不明确的蛋白质外,共有20个有功能描述的蛋白质,这些蛋白点大部分含有信号肽,只有极少数不含信号肽,可能是通过其它非典型分泌途径分泌的(结果见表2)。通过对差异点的质谱鉴定及其功能分类可以得出这些蛋白功能涉及代谢、催化、应激、发育、防御/抗胁迫、细胞分裂等过程。
 表2 蛋白质谱鉴定结果 |
1.4被鉴定蛋白的功能分析
Y98-16菌株在氮饥饿诱导下特异表达的分泌蛋白有9号(gi|145602874)丝氨酸羧肽酶S28,属于α/β水解酶家族成员之一,对丝氨酸羧肽酶类蛋白的功能研究表明,SCPL基因在参与种子萌发中储藏蛋白的水解、细胞程序性死亡中细胞成分的自溶、种子发育、抗逆境等诸多过程中起作用;27号(gi|39974523)糖基水解酶家族16,属于葡聚糖酶超家族成员之一,参与糖类代谢过程;10号(gi|39946606)醛糖1差向异构酶(变旋酶)负责葡萄糖和其他醛糖在α与β形式间的端基互变,涉及碳水化合物代谢过程。
在氮饥饿诱导下Y98-16菌株分泌蛋白的表达量相对于全氮培养条件下上调的蛋白有8号(gi|145602874)丝氨酸羧肽酶S28,他们属于α/β水解酶家族成员之一,对丝氨酸羧肽酶类蛋白的功能研究表明,SCPL基因在参与种子萌发中储藏蛋白的水解、细胞程序性死亡中细胞成分的自溶、种子发育、抗逆境等诸多过程中起作用;12号(gi|145610386)糖基水解酶家族7,属于葡聚糖酶超家族成员之一;20号(gi|39971981)混连葡聚糖酶;5号(gi|39970863)天冬氨酸蛋白酶,这个家族是肽酶家族成员之一,可能参与蛋白质的水解,是一种广泛存在于微生物、动物、植物等体内的酶;14/15/21号(gi|39973165)脯氨酰寡肽酶家族,参与蛋白质水解;16号(gi|145613536) ML domain:磷脂酰肌醇转移蛋白,与油脂识别有关,特别是在病原菌相关产物的识别上;30号(gi|39968551) Kelch motif:是一个基序,以果蝇的突变体来命名的半乳糖氧化酶;26号(gi|145610394)蛋白酶相关结构域:这种结构域在植物的液泡受体中被发现,研究表明这种结构域形成一个像盖子一样的结构覆盖活性蛋白酶的活性位点,从而影响液泡受体蛋白的识别。
在氮饥饿诱导下Y98-16菌株分泌蛋白的表达量相对于全氮培养条件下下调的蛋白有28 (gi|39976459) β-甘露聚糖酶广泛存在于自然界中,甘露聚糖是植物半纤维素的重要组分,甘露聚糖的完全酶解需要β-甘露聚糖酶;13号(gi|39971041)羧酸酯酶,它是α/β水解酶家族成员之一;7号(gi|39964139)假想蛋白,功能未知;22号(gi|39952025) WSC结构域:这个结构域可能涉及到淡水化合物的合成,其余功能未知(表2)。
2讨论
氮饥饿可能是植物病原真菌侵染至寄主组织内进一步生长时面临的环境胁迫之一(Bolton et al., 2008)。氮饥饿可影响稻瘟病菌N调控相关基因及部分与致病相关的分泌蛋白质的产生(Donofrio et al., 2006)。但其具体的作用机制目前尚不清楚。本实验利用双向电泳对比较氮饥饿及含氮培养条件下稻瘟病菌分泌蛋白质组的差异进行了比较分析。结果显示,氮饥饿可影响稻瘟病菌N代谢及相关调控相关基因的表达。这些蛋白质表达量的提高反映了稻瘟病菌为适应氮饥饿胁迫而增强了N代谢相关途径。糖基水解酶(glycoside hydrolases, GH)是降解植物细胞壁多糖成分主要的酶类(Zoran, 2008)。本实验中发现在鉴定的26个蛋白点中,氮饥饿诱导下上调和特异表达的蛋白点有18个,占鉴定蛋白的69%,其余8个蛋白下调。Mosquera等的实验表明,在稻瘟病菌侵染水稻叶片的早期产生了较大数量的分泌蛋白质。其中多数是与细胞壁相关的酶类,本实验利用氮饥饿胁迫后48 h后的分泌蛋白质进行分析,与Mosquera等实验中稻瘟病菌侵染水稻的时间接近。这些结果说明,氮饥饿胁迫可能促进了稻瘟病菌细胞壁多糖降解酶的产生以有利于其侵染的进行。分泌蛋白质主要是稻瘟病菌分泌到寄主组织中,在其二者的相互作用中发挥信号识别、代谢调控和致病等作用(Ebbole, 2007)。本实验中被鉴定的蛋白可能在稻瘟菌与水稻的互作过程中发挥着不同的功能,但确切功能将在进一步的实验中证实,同时在这些蛋白点中, gi|145605481和gi|39971041已被证明与致病相关(Jeon, 2007),蛋白点(gi|145602874)被证明在水稻侵染期间高度表达(Mathioni, 2011),表明从分泌蛋白中可找到效应蛋白的候选蛋白。
3材料与方法
3.1试验材料
稻瘟菌菌株Y98-16在含氮液及氮饥饿的液体培养参考蔡永占等的方法(蔡永占等, 2010)。将水稻品种LTH的种子在培养箱内28℃黑暗培养催芽3 d后,移栽温室中生长,待第4片叶完全展开时接种。
3.2液相等电聚焦及致病力检测
将2 L氮饥饿诱导下的滤液冻干后,转入透析袋中于去离子水中透析24 h。透析结束后的溶液以12 000 rpm、4℃离心20 min,用加入3% (w/v)的Biolyte缓冲液(pI3-10)的10 mL去离子水混合后进行液相等电聚焦电泳。将Rotofor (Bio-rad)整套设备安装完毕后,在阳极电极室内加入0.1 mol/L H3PO4,在阴极电极室内加入0.1 mol/L NaOH溶液各35 mL。在电泳槽内加入去离子水以5 W恒定功率电泳至电流强度无明显变化。取出去离子水,加入18 mL混合好的样品溶液以10 W固定功率运行。起始电压在700 V左右,在2 h后,电压逐步上升至1 200 V,并在1 250 V附近小范围变化。当此状态持续30 min时,停止电泳,将接样管插入电泳室上的小孔,用真空泵与接样器连接并抽真空接收20个组分的样品。各组分的样品先在1 mol/L的无菌Nacl溶液中透析一夜,再在去离子水中透析12 h以消除Biolyte对致病性检测的影响。处理后的样品冻干后用去离子水重溶用Bradford法测定蛋白质浓度并调整其蛋白质浓度为1 μg/μL,以水为对照用于LTH叶片接种的活性测定。致病力大小通过在水稻叶片致伤接种后病斑的大小进行分析。
3.3双向电泳
采用三氯乙酸-丙酮法提取分泌蛋白(蔡永占等, 2010)。在蛋白滤液中加入100%三氯乙酸至滤液终浓度为15%,充分混匀后4℃沉淀过夜,12 000 rpm,4℃离心30 min,弃上清。沉淀用冷丙酮悬浮后于-20℃放置1 h。2 000 rpm,4℃离心30 min,弃上清,将沉淀真空干燥后于-80℃保存。沉淀用水化上样缓冲液重新悬浮,利用Bradford法测定蛋白质浓度,调整上样为1 mg,上样体积600 μL,进行双向电泳。用pH4-7 17 cm IPG胶条(Bio-rad)进行水化。被动水化14 h。在PROTEAN IEF Cell聚焦仪(Bio-rad)上进行聚焦。其电压程序设定如下:50 V慢速升压20 min;250 V慢速升压30 min;500 V快速升压1 h;1 000 V快速升压1 h;4 000 V线性升压2 h;9 000 V线性升压3 h,并维持运行时间至60 000 Vh结束。聚焦好的胶条分别进行2次平衡操作,每次15 min。平衡液母液配方为:6 mol/L尿素、2% SDS、50 mmol/L pH8.8 Tris-HCl、30%甘油和0.002%溴酚蓝。第一次平衡时在母液中加入2%DTT。第二次平衡时则换为6%IAA。平衡好的IPG胶条用电泳缓冲液冲洗好后小心地放在12%的凝胶上,在胶条的负极端加入蛋白质分子量Mark (SM0431, Fermentas),用1%琼脂糖封胶液固定好胶条。用PROTEANRⅡ Xi Cell电泳槽(Bio-rad)以恒电压进行电泳,起始电压为70 V,待溴酚蓝指示线越过胶条后,电压改为300 V,至电泳结束。电泳结束后胶的染脱色及图像的分析见苏源等方法(苏源等, 2011)。
3.4质谱鉴定及数据库检索
将表达量有差异的蛋白质点从胶上取下送上海中科新生命科技公司在ABI公司的串联飞行时间质谱仪(4800 Plus MALDI TOF/TOF Analyzer)进行质谱分析。将通过质谱仪分析获得的质谱峰数据通过Mascot程序(http://www.matrixsciece.com)进行蛋白质检索。检索的数据库为稻瘟病菌基因组的数据库。检索条件为:(1)蛋白质的可信度≥95%;(2)氨基酸序列覆盖率>20%;(3)Mowse值 ≥60 (P<0.05)。对得到的这些蛋白质序列用SignalP 3.0软件预测其是否含有信号肽序列(Bendtsen et al, 2004)。将质谱鉴定后得到的蛋白质序列在Gene ontology程序(http://amigo. geneontology.org/cgi-bin/amigo/blast.cgi)中选择稻瘟病菌进行功能分类(Eilbeck et al., 2005)。
作者贡献
孔垂思、苏源和余萍是本实验研究的执行人;孔垂思、苏源及余萍完成数据分析,论文初稿的写作;杨静和刘林参与实验设计,试验结果分析;李成云和朱有勇是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家“973”项目(2011CB100400和2012CB722900)资助。作者感谢两位匿名的同行评审人的评审和修改建议。
参考文献
Baker B., Zambryski P., Staskawicz B., and Dinesh-Kumar S P., 1997, Signaling in plant-microbe interactions, Science, 276(2): 726-733
http://dx.doi.org/10.1126/science.276.5313.726 PMid:9115193
Bolton M.D., and Thomma B.P.H.J., 2008, The complexity of nitrogen metabolism and nitrogen-regulated gene expression in plant pathogenic fungi, Physiological and Molecular Plant Pathology., 72(4-6): 104-110
http://dx.doi.org/10.1016/j.pmpp.2008.07.001
Cai Y.Z., Su Y., Kong C.S., Yang J., Liu L., and Li C.Y., 2010, Comparison analysis of Secretary Proteins Induced by Nitrogen Starvation of Different Pathogenicity Magnaporthe grisea Isolates by Two-Dimensional Gel Electrophoresis, Yunnan Nongye Daxue Xuebao (Journal of Yunnan Agricultural University), 25(6): 775-785 (蔡永占, 苏源, 孔垂思, 杨静, 刘林, 李成云, 2010, 氮饥饿环境中稻瘟病不同致病力菌株分泌蛋白的双向电泳图谱分析, 云南农业大学, 25(6): 775-785)
Donofrio N.M., Oh Y., Lundy R., Pan H., Brown D.E., Jeong J.S., Coughlan S., Mitchell T.K., and Dean R.A., 2006, Global gene expression during nitrogen starvation in the rice blast fungus, Magnaporthe grisea, Fungal Genet Biol., 43(9): 605-617
http://dx.doi.org/10.1016/j.fgb.2006.03.005 PMid:16731015
Ebbole D.J., 2007, Magnaporthe as a model for understanding host-pathogen interactions, Annu. Rev. Phytopathol., 45: 437-456
http://dx.doi.org/10.1146/annurev.phyto.45.062806.094346 PMid:17489691
Eilbeck K., Lewis S.E., Mungall C.J., Yandell M., Stein L., Durbin R., and Ashburner M., 2005, The Sequence Ontology: a tool for the unification of genome annotations, Genome Biol., 6(5): R44
http://dx.doi.org/10.1186/gb-2005-6-5-r44 PMid:15892872 PMCid:1175956
Espino J.J., Gutiérrez-Sánchez G., Brito N., Shah P., Orlando R., and González C., 2010, The Botrytis cinerea early secretome, Proteomics., 10(16): 3020-3034
http://dx.doi.org/10.1002/pmic.201000037 PMid:20564262
Gonzalez-Fernandez R., and Jorrin-Novo J.V., 2012, Contribution of proteomics to the study of plant pathogenic fungi, J. Proteome Res., 11(1): 3-16
http://dx.doi.org/10.1021/pr200873p PMid:22085090
Jeon J., Park S.Y., Chi M.H., Choi J., Park J., Rho H.S., Kim S., Goh J., and Yoo S., 2007, Genome-wide functional analysis of pathogenicity genes in the rice blast fungus, Nat. Genet., 39(4): 561-565
http://dx.doi.org/10.1038/ng2002 PMid:17353894
Mathioni S.M., Beló A., Rizzo C.J., Dean R.A., and Donofrio N.M., 2011. Transcriptome profiling of the rice blast fungus during invasive plant infection and in vitro stresses, BMC Genomics, 12: 49
http://dx.doi.org/10.1186/1471-2164-12-49 PMid:21247492 PMCid:3037901
Stergiopoulos I., de Wit PJ., 2009, Fungal effector proteins, Annu. Rev. Phytopathol., 47: 233-263
http://dx.doi.org/10.1146/annurev.phyto.112408.132637 PMid:19400631
Su Y., Yu P., Kong C.S., Cai Y.Y., Yang J., Liu L., and Li C.Y., 2011, Preliminary study of the total proteins of roots, stems and Leaves in wheat seedling using two-dimensional electrophoresis., Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 9: 1366-1372 (苏源, 余萍, 孔垂思, 蔡翌阳, 杨静, 刘林, 李成云, 2011, 小麦幼苗根、茎和叶蛋白质双向电泳的初步研究, 分子植物育种(online), 9: 1366-1372)
Talbot N..J., McCafferty H.R.K ., Ma M., Moore K., and Hamer J.E.,1997, Nitrogen starvation of the rice blast fungus Magnaporthe grisea may act as an environmental cue for disease symptom expression, Physiological and Molecular Plant Pathology., 50(3): 179-195
http://dx.doi.org/10.1006/pmpp.1997.0081
Wasinger V.C., Cordwell S.J., Cerpa-Poljak A., Yan J.X., Gooley A.A., Wilkins M.R., Duncan M.W., Harris R., Williams K.L., and Humphery-Smith I., 1995, Progress with gene-product mapping of the Mollicutes: Electrophoresis, 16(7): 1090-1094
http://dx.doi.org/10.1002/elps.11501601185 PMid:7498152
Zhou X.G., Su Y., Li C.Y., Ding Y.M., Zhang S.S., Sun M.L., and Li J.B., 2009, Pathogenicity analysis of secretory protein of the rice blast fungus under nitrogen starvation, Zhiwu Bingli Xuebao (Acta Phytopathologica Sinica)., 9(5): 481-500 (周晓罡, 苏源, 李成云, 丁玉梅, 张绍松, 孙茂林, 李进斌, 2009, 氮胁迫条件下稻瘟病菌分泌蛋白致病性分析, 植物病理学报, 9(5): 481-500)
Zoran M., 2008, Physiological roles of plant glycoside hydrolases, Planta, 227(4): 723-740
http://dx.doi.org/10.1007/s00425-007-0668-y PMid:18046575