2.国家小麦改良中心泰安分中心, 山东农业大学农学院, 泰安, 271018
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2010 年, 第 8 卷, 第 8 篇 doi: 10.5376/mpb.cn.2010.08.0008
收稿日期: 2010年09月17日 接受日期: 2010年10月21日 发表日期: 2010年11月01日
陈桂玲等, 2010, 利用功能标记检测小麦品质相关性状的基因组成, 分子植物育种 Vol.8 No.8 (doi: 10.5376/mpb.cn.2010.08.0008)
利用新型功能分子标记可以快速准确地鉴定小麦品种相关基因的等位变异。本研究利用高分子量麦谷蛋白亚基(high molecular weight glutenin subunits, HMW-GS)Glu-A1、Glu-D1 位点上的标记 UMN19、UMN25 和 UMN26,位于 7AL、7B 染色体与黄色素含量相关的八青番茄红素合成酶基因 (Phytoene synthase, PSY) Psy-A1、Psy-B1 的标记 YP7A、YP7B-1,以及位于2AL、2DL 染色体的多酚氧化酶(Polyphenol oxidase, PPO)活性基因标记PPO18、PPO29等7个小麦品质相关性状功能性分子标记,对山东省近年选育的44份小麦品种(系)进行了基因等位变异检测。结果表明:在Glu-A1位点含有优质亚基Ax2*的材料5份,占11.3%,在Glu-D1位点含有优质亚基组合5+10的材料有8份,占18.1%,同时含亚基Ax2*、5+10的材料1份,占2.3%;在7A染色体上含Psy-A1b (低黄色素含量)等位变异基因的材料7份,占15.9%,在7B染色体上含Psy-B1b(低黄色素含量)等位变异基因的材料17份,占38.3%,在7A、7B染色体上同时含低黄色素含量等位变异基因的材料3份,占6.8%;在2AL染色体上含Ppo-A1b(低PPO活性)等位变异材料33份,占75%,在2DL染色体上含Ppo-D1a (低PPO活性)等位变异材料22份,占50%,在2AL、2DL染色体上同时含低PPO活性等位变异基因的材料16份,占36.3%。所用的7个标记均为基因特异性标记,扩增结果稳定,可有效地应用于小麦品质改良的分子标记辅助选择。
随着结构及功能基因组学的飞速发展,基因功能标记的开发与应用逐渐成为小麦等重要农作物分子育种的重要方向。利用功能型分子标记对小麦品质相关性状进行检测具有快速、准确、方便等特点,在分子标记辅助育种上大大提高了选择效率;同时为育种过程中亲本选择和确定材料的利用价值提高重要信息(杨景华等, 2008; Bagge et al., 2007;2008)。因而,在小麦育种工作中具有较大应用价值,特别在小麦品质改良方面受到广泛应用(何中虎等,2006)。
高分子量谷蛋白亚基、黄色素含量、籽粒PPO活性等性状对小麦面粉韧性、粘性、光滑性、适口性、面粉及面制食品色泽具有重要影响,最终影响日常生活所食用面制品的加工品质(如面包, 面条和馒头等)。高分子量谷蛋白亚基(HMW-GS)主要影响面团的粘弹性、面粉加工品质和烘烤品质,由Glu-A1、Glu-B1、Glu-D1位点控制。每个位点由两个紧密连锁的基因组成,分别编码X-type和Y-type两种类型的亚基,并且每个基因位点都存在大量等位变异。在Glu-A1、Glu-D1位点上的等位基因Ax2*和1/null、Dx5+Dy10和Dx2+Dy12与小麦的烘烤品质关系密切,是评价育种材料烘烤品质的重要指标,因此常选用对烘烤品质贡献极大的Ax2*、Dx5+Dy10基因来改良面包小麦品质。其中Ax2*、5+10亚基与高面筋强度密切相关,而null、2+12亚基与弱面筋强度相关联。
小麦籽粒黄色素含量主要影响面粉及加工品外观颜色,因此加工面条、馒头等面制品应选择低黄色素含量的小麦品系,从而使面制品具有较好的外观品质和销售价值。而影响小麦黄色素含量的关键基因——八氢番茄红素合成酶(PSY)基因,由多个基因位点控制,但位于7A、7B等同源群上检测到的QTL效应值最大(Elouafi et al.,2001)。He等(2008; 2009)针对黄色素含量这一性状开发的功能性基因标记YP7A、YP7B-1,可以有效地将位于小麦7AL、7B染色体上控制不同黄色素含量的等位基因Psy-Ala、Psy-Alb和Psy-Bla、Psy-Blb区分开。
小麦籽粒中多酚氧化酶(PPO)活性与面条等面制品在制作过程中颜色变褐密切相关,不同小麦品种间PPO活性差异很大,主要受PPO基因的等位变异影响。面粉中PPO的含量虽然仅占籽粒总PPO含量的3%,但可以解释面制品加工和贮藏过程中色泽褐变的50%-70% (Kruger et al.,1994)。PPO催化内源酚酸的氧化成为醌类物质,后者经自身聚合或与多肽的氨基基团聚合生成褐色多聚体,导致面团褐变,严重影响面制品的外观质量和商品价值(Jimenez et al.,1999)。Mares等(2001)研究发现控制PPO活性的主效基因位于第二同源群染色体上,其它染色体如3B、3D、6B、6D上亦存在一些微效基因。张立平等人(2005)研究结果表明位于2AL、2DL染色体上的PPO活性基因能够分别解释37.2%-50.1%和25.1%-29.1%的表型变异,认为是控制PPO活性的主效基因。Sun等(2005)和He等(2007;2008)在2AL和2DL染色体上开发了多酚氧化酶主效基因的功能性基因标记PPO18和PPO29,可以有效区分控制高多酚氧化酶活性和低多酚氧化酶活性的等位基因。以上相关品质性状的功能标记为分子标记辅助选择育种和小麦种质的鉴定奠定了基础,同时也加快了小麦品质改良成的步伐。
本实验利用UMN19、UMN25、UMN26、YP7A、YP7B-1、PPO18、PPO29等标记对部分山东省冬小麦品种进行相关基因的分子检测,目的是进一步验证相关标记的有效性和实用性,为利用功能标记进行分子育种奠定基础,并进一步明确不同的材料所具有的基因种类及相关品质状况,选育具有优良性状的小麦种质,为小麦品质育种优良亲本材料的选育提供依据。
1 结果与分析
1.1 供试材料HWM-GS组成的等位变异
本研究所用的UMN19、UMN25、UMN26均为共显性标记,其中标记UMN19在含Ax2*的材料中可扩增出344bp的片段,在含Ax1、null的材料中可扩增出362bp的片段(图1);标记UMN25在Dx2 的材料中可扩增出299bp的片段,在含Dx5的材料中可扩增出281bp的片段;标记UMN26在含Dy10的材料中可扩增出397bp的片段,在含Dy12的材料中可扩增出415bp的片段(图2)。44份小麦品种(系)在Glu-A1位点含有亚基Ax2*的材料5份,分别为山农2618、山农6343、临麦2号、临麦4号、鲁麦5号,占11.3%。在Glu-D1位点含有亚基组合5+10的材料有8份,分别为山农12、山农8355、泰农18、烟农19、烟农21、鲁麦5号、济宁12、淄麦12号,占18.1%;其中材料济宁13和山农2618在Glu-D1位点扩增出3条带,是一种特殊类型,有待进一步研究(图2)。其中在Glu-A1扩增出Ax2*的材料、Glu-D1位点均表现优质亚基(Ax2*、5+10)的材料1份,只有鲁麦5号。
|
|
|
|
1.2 供试材料黄色素含量基因的等位变异
共显性功能标记YP7A,在高黄色素含量和低黄色素含量的小麦材料中分别可以扩增出194bp和231bp大小的片段(图3),相对应的等位变异基因分别为Psy-Ala、Psy-A1b;共显性标记功能YP7B-1,在高黄色素含量和低黄色素含量的小麦材料中分别可以扩增出151bp和156bp大小的片段,相对应的等位变异基因为分别为Psy-B1a、Psy-B1b。供试材料中在7A染色体上含Psy-A1b等位变异基因的材料7份,分别为山农14、山农664、临麦2号、临麦4号、鲁麦21、鲁麦23、淄麦12号,占15.9%。在7B染色体上含Psy-B1b等位变异基因的材料17份,占38.3%。其中山农14、鲁麦21、淄麦12号在7A、7B染色体上同时含低黄色素含量基因的等位变异基因,占6.8%。
|
图3 引物YP7A的的PCR扩增结果 |
1.3 供试材料多酚氧化酶基因的等位变异
共显性功能标记PPO18,在高多酚氧化酶活性和低多酚氧化酶活性的小麦材料中分别可以扩增出685bp和876bp大小的片段,相对应的等位变异基因分别为Ppo-Ala、Ppo-Alb(图4);显性功能标记PPO29,在低PPO活性的材料中无扩增片段,高PPO活性的材料中扩增490bp的片段,相应的等位基因分别为Ppo-Dla和Ppo-Dlb。供试材料在2AL染色体上含Ppo-A1b(低PPO活性)等位变异材料33份,占75%,在2DL染色体上含Ppo-D1a(低PPO活性)等位变异材料22份,占50%;在2AL、2DL染色体上同时含低PPO活性等位变异基因的材料16份,占36.3%。
|
图4 引物PPO18的PCR扩增结果 |
2讨论
2.1小麦功能型分子标记的开发与利用
近年来,随着分子生物学技术的快速发展和众多小麦基因的发现,已获得许多重要农艺性状相关基因的分子标记,其中SSR、EST-SSR和AFLP标记已广泛应用于小麦遗传图谱的绘制、基因的分子标记分析和辅助育种等方面。但是目前广泛使用的基于PCR基础的分子标记如SSR、AFLP等标记一般是扩增非编码区域(重复序列),或是随机在基因组中扩增,得到的位点一般与目标性状基因存在一定的遗传距离。这使得分子标记在应用上与其目标有一定的偏差。而重要农艺性状基因定位与图位克隆以及分子标记辅助育种等都要求标记位点与目标性状基因间的距离较近,而目前使用的这些分子标记普遍距离编码序列较远或很难在目标性状基因附近存在标记位点。
随着结构及功能基因组学的飞速发展,基于目的基因开发形成的目的基因标记或功能型分子标记(functional markers,FMs)成为一类新型分子标记类型。Andersen和Lübberstedt(2003)最早定义了功能型分子标记的概念,即与表型相关的功能基因基序中功能型单核苷酸多态性位点开发而成的新型分子标记。功能型分子标记不依赖于分子遗传作图,由于该标记直接检测的是功能基因的不同等位变异,所以比传统的分子标记在标记补助育种中更具有优越性。
目前在小麦中,已有许多不同基因的功能标记的研究和报道(Bagge et al., 2007),如Sun(2005)和He等(2007)分别开发的多酚氧化酶(PPO)活性等位基因、He等(2008)开发的八氢番茄红素合成酶(PSY)等位变异基因、高低分子麦谷蛋白、Wx蛋白、籽粒硬度等品质相关性状功能标记基因被开发利用;Ellis(2002)开发的矮秆基因Rht1、Rht2和Rht8的分子标记;Yan等(2003;2004) 和Fu(2005)在Vrn-A1、Vrn-B1、Vrn-D1和Vrn-B3位点开发的春化基因分子标记;另外白粉病基因Pm3(Tommasini et al., 2006)、抗穗发芽基因(郭凤芝等,2009)、春化基因(姜莹等,2010)等陆续被开发利用。本实验利用的高分子量谷蛋白亚基、黄色素含量、籽粒PPO活性等与品质性状相关的功能标记扩增结果特异性强、条带清晰,PCR扩增条带与前人文献结果一致(杨芳萍等,2008;肖永贵等,2008),表明利用功能标记对相关性状的检测方法简单、重复性好、准确率高、结果可靠,可以很好的区分不同遗传背景材料,并进一步验证了以上标记的有效性和实用性。在品质育种中可直接利用这些标记进行标记辅助选择、小麦新品种选育,以提高育种效率、加快育种进程。随着小麦基因组计划的进展和基因组序列的公布,将会有越来越多的功能标记被开发出来,用于小麦育种的标记辅助选择。
2.2 材料的优良等位变异
综合以上三个性状分析:山农14、淄麦12号既含有低黄色素含量等位基因Psy-A1b、Psy-B1b,又含有低PPO活性基因Ppo-Alb、Ppo-Dlb;鲁麦5号含有低黄色素含量等位基因Psy-B1b和低PPO活性基因Ppo-Alb、Ppo-Dlb。这三个可作材料为改良面制食品外观品质的候选亲本,有利于提高面条和馒头等传统食品的色泽。另外,鲁麦5号含有优质亚基Ax2*、5+10的等位基因,淄麦12号含有优质亚基5+10的等位基因。在所检测的50份材料中鲁麦5号和淄麦12号综合品质性状比较好,在面制品加工行业可作为优选材料,不仅有利于改变食品色泽,而且面团弹性较强。在今后的小麦品质育种工作中,鲁麦5号和淄麦12号作为候选亲本,有利于改善小麦品质性状,加快小麦品质改良的步伐。
不同的面制食品对小麦品质的要求也有所不同,就馒头、面条、面包而言,对面粉的色泽及面筋强度的要求较高,需要进一步的改良。在所检测的山东省小麦材料中黄色素含量(PSY)、PPO活性基因及高分子谷蛋白亚基的等位变异基因存在着一定差异。检测中含低黄色素含量的等位变异基因Psy-A1b、Psy-B1b的材料分别占14 %、34%。可见山东省小麦品种中Psy-A1b、Ppo-Alb的频率较低,在过去的小麦育种中还没有针对黄色素含量(PSY)基因进行选择,因此在今后小麦新品种的选育及育种过程中,应重视低黄色素和低PPO活性两种指标,在面制品加工过程中有望减缓食品的变褐速度,进一步提高面条、馒头等面制品的白度。高分子量麦谷蛋白亚基(HMW-GS)是决定面团弹性的重要因素,与强面筋强度密切有关。在检测的50份材料中含有优质亚基Ax2*、5+10的材料频率分别为18%、18%。由此可见山东省小麦品种(系)含优质高分子麦谷蛋白亚基(HMW-GS)的材料普遍较少,在今后的小麦育种工作中有待进一步加强。在所检测的几个品质性状均符合要求的材料没有发现,其中鲁麦5号和淄麦12号聚合的优良品质性状较多。因此,在今后的小麦育种工作中需要加强以多个优良品质性状的聚合为重点的品质性状改良,从而提高小麦的综合加工性能。
3材料与方法
3.1实验材料
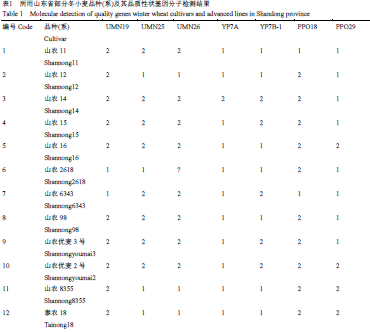
供试小麦材料于2009年秋在国家小麦改良中心泰安分中心实验基地播种,次年3月返青时期进行田间取样。所用44份山东省小麦品种(系)的名称和来源见表1。
|
表1 所用山东省部分冬小麦品种(系)及其品质性状基因分子检测结果 |
3.2基因组DNA的提取
每个材料选取幼嫩叶片,用改良的CTAB法(Hill-Ambroz et al., 2002)提取小麦基因组DNA,并用琼脂糖电泳检测DNA的质量,用于品质基因位点的检测。
3.3 参照材料的特异性标记
本实验所用的特异标记UMN19、UMN25、UMN26、YP7A、YP7B-1、PPO18、PPO29均为前人开发(Liu et al.,2008;He et al.,2007,2008,2009;)。PCR反应体系及扩增条件:实验所用标记反应体系均为25μL,含2.5μL10×PCR buffer,2μL 2mmol •L–1 MgCl2,1.5μL 200 mmol •L-1 dNTPs,每个引物1μL约10 ng,基因组DNA (3μL) 30~100ng、TaqDNA聚合酶1U,其余由ddH2O补至25μL。标记UMN19、UMN25、UMN26的扩增程序为:94℃预变性5min;94℃变性30s;60℃复性30s;72℃延伸1.5min; 40个循环;72℃最后延伸5min。标记YP7A、YP7B-1的扩增程序为:95℃预变性5min;95℃变性30s;复性温度(分别为65℃、60℃)30s;然后72℃延伸30s;经35个循环;最后72℃延伸5min。PPO18、PPO29的扩增程序为:95℃预变性5min;94℃变性1min;复性温度(分别为52℃、68℃)退火1min;72℃延伸(时间分别为1min、40s);36个循环;最后72℃延伸5min。
PCR扩增的产物用6%的非变性聚丙烯酰胺凝胶电泳(PAGE)检测,缓冲液体系为1×TE溶液,经硝酸银染色显影,最后采用天能GIS凝胶图像处理系统扫描成像。
作者贡献
陈桂玲是本实验的实验设计和实验研究的执行人;并且完成了数据分析,论文初稿的写作;余利参与了田间取样及DNA的提取,崔法在实验操作及论文初稿修改过程中给予了较多的帮助和指导。王洪刚老师主要为实验完成提供了实验仪器、设备及其操作平台。导师李兴锋是本实验的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金资助项目(No:30800684)资助,感谢国家小麦改良中心泰安分中心实验室所有人员在本实验过程中的技术支持和有益的建议,感谢匿名的同行评审人的评审建议和修改建议。
参考文献
Andersen J.R., Lubberstedt T., 2003, Functional markers in plants, Trends in Plant Science, 8(11): 554-560
Bagge M., Xia X.C., Lubberstedt T., 2007, Functional markers in wheat, Current Opinion in Plant Biology, 10:211-216
Bagge M., Lübberstedt T., 2008, Functional markers in wheat:technical and economic aspects, Mol Breeding, 22:319-328
Ellis M. H., Spielmeyer W., Gale K.R., Rebetzke G.J., Richards R.A., 2002, Perfect markers for Rht-B1b and Rht-D1b dwarfing genes in wheat, Theor Appl Genet, 105: 1038-1042
Elouafi I., Nachit M.M., Martin L.M.,2001, Identification of a microsatellite on chromosome 7B showing a strong linkage with yellow pigment in durum wheat(Triticum turgidum L.var.durum),Hereditas,135: 255-261
Fu D., Szücs P., Yan L., Helguera M., Skinner J.S., Zitzewitz J.V., Hayes P.M., Dubcovsky J., 2005, Large deletions within the first intron in VRN-1 are associated with spring
growth habit in barley and whaet, Mol Genet Genomics, 273:54-65
Guo F.Z., Liang W.G., Fan Q.Q., Huang C.Y., Gao Q.R., Li G.Y., 2009,The Distribution
and Evolution of Allelic Variation of Vp1B3 in Shandong Wheat, Mailei Zuowu Xuebao(Journal of Triticeae Crops),29(4):575-578(郭凤芝,梁伟光,樊庆琦,黄承彦,高庆荣,李根英,2009,穗发芽相关基因Vp1B3 不同等位变异在山东小麦中的分布于演变,麦类作物学报, 29(4):575-578)
He Z.H., Yan Y.M., Zhuang Q.S., Zhang Y., Xia X.C., Zhang Y., Wang D.S., Xia L.Q., Hu Y.K., Min H.,Chen X.M., Yan J., Zhou Y.,2006, Establishment of Quality Evaluation System and Utilization of Molecular Methods for the Improvement of Chinese Wheat Quality, Zhongguo Nongye Kexue (Scientia Agricultura Sinicca),39(6):1091-1101(何中虎,晏月明,庄巧生,张艳,夏先春,张勇,王德森,夏兰芹,胡英考,民华,陈新民,阎俊,周阳,2006, 中国小麦品种品质评价体系建立与分子改良技术研究,中国农业科学, 39(6):1091-1101)
He X.Y., Zhang Y.L., He Z.H., Wu Y.P., Xiao Y.G., Ma C.X., Xia X.C.,2008, Characterization of phytoene synthase 1 gene (Psy1) located on common wheat chromosome 7A and development of a functional marker,Theoretical and Applied Genetics, 116:213-221
He X.Y., He Z. H., Zhang Y. L., Sun J.D., Morris F.C., Fuerst P.E., Xia X.C.,2007, Allelic variation of polyphenol oxidase (PPO) genes located on chromosomes 2A and 2D and development of functional markers for t he PPO genes in common wheat , Theoretical and Applied Genetics, 115:47-58
He X.Y., He Z.H., Ma W., Appels R., Xia X.C., 2009, Allelic variants of phytoene synthase 1(Psy1) genes in Chinese and CIMMYT wheat cultivars and development of functional markers for flour colour, Mol Breeding, 23:553-563
Hill-Ambroz K.L., Brown-Guedira G.L., Fellers J.P., 2002, Modified rapid DNA extraction protocol for high throughput microsatellite analysis in wheat, Crop Sciense, 42:2088-2091
Jimenez M., Dubcovsky J., 1999, Chromosome location of genes affecting polyphenol oxidase activity in seeds of common and durum wheat, Plant Breeding, 118:395-398
Jiang Y., Huang L.Z., Hu Y.G., 2010, Distribution of Vernalization Genes in Chinese Wheat Landracesand Their Relationship with Winter Hardness,Zhongguo Nongye Kexue(Scientia Agricultura Sinicca),43(13):
2619-2632(姜莹,黄林周,胡银刚,2010, 中国小麦地方品种春花基因的分布及其与冬春性的关系,中国农业科学, 43(13):2619-2632)
Kruger J.E., Hatcher D.W., DePauw R., 1994, A whole seed assay for polyphenol oxidase in Canadian prairie spring wheats and its usefulness as a measure of noodle darkening, Cereal Chemistry, 71: 324-326
Liu S.X., Chao S.M., Anderson J.A.,2008, New DNA markers for high molecular weight glutenin subunits in wheat, Theoretical and Applied Genetics, 118: 177-183
Mares D.J., Campbell A.W., 2001, Mapping components of flour and noodle colour in Australian wheat, Australian Journal of Agricultural Research, 52:1297-1309
Sun J.D., Zhang L.P., Xia X.C., He L.H., Ge X.X., Wang H.,2005, Validation of SSR Marker Assisted Selection for Polyphenol Oxidase Activities in Common Wheat, Zhongguo Nongye Kexue (Scientia Agricultura Sinicca), 38(7):1295-1299 (孙道杰,张立平,夏先春,何中虎,葛秀秀,徐兆华,王辉,2005,小麦多酚氧化酶(PPO)活性的SSR标记筛选与验证,中国农业科学,38(7):1295-1299)
Tommasini L., Yahiaoui N., Srichumpa P., Keller B.,2006, Development of functional markers specific for seven Pm3 resistance alleles and their validation in the bread wheat gene pool, Theoretical and Applied Genetics, 114:165-175
Wang X.P., Ma C.X., He K.Q., Si H.Q.,Zhang Y.L.,2008, Development and Application of a STS Marker for Grain PPO Gene Located on Chromosome 2D in Common Wheat, Zhongguo Nongye Kexue (Scientia Agricultura Sinicca),41(6):1583-1590 (王晓波,马传喜,何克勤,司红起,张叶伦, 2008,小麦2D染色体多份氧化酶(PPO)基因STS标记的开发与应用,中国农业科学, 41(6):1583-1590)
Xiao Y.G., He X.X., Sun D.J., Xia X.C., He Z. H., 2008, Molecular Identification and Distribution of the Polyphenol Oxidase Genes in Chinese Winter Wheat Cultivars, Zhongguo Nongye Kexue (Scientia Agricultura Sinicca), 41(5):954-960)(肖永贵,何心尧,刘建军,孙道杰,夏先春,何中虎,2008,我国冬小麦品种多酚氧化酶活性基因等位变异检测及其分布规律研究,中国农业科学, 41(5):954-960)
Yan L., Helguera M., Kato K., Fukuyama S., Sherman J., Dubcovsky J., 2004, Allelic variation at VRN-1 promoter region in polyploidy wheat, Theor Appl Genet, 109:1677-1686
Yan L., Loukoianov A., Blech A., Tranquili G., Ramakrishna W., Sanmiguel P., Bennetzen J.L., Echenique V., Dubcovsky J., 2004, The wheat VRN2 gene is a flowering repressor down-regulated by vemalization, Science, 303: 1640-1644
Yan L., Loukoianov A., Tranquili G., Helguera M., Fahima T., Dubcovsky J., 2003, Positional cloning of the wheat vemalization gene VRN1, Proc Natl Acad Sci USA, 100:6263-6268
Yang F.P., He X.X., He Z.H., Shang X.W., Yang W. X., Xia X. C., 2008, Molecular Detection and Distribution of Allelic Variation of a Gene for Yellow Pigment Content in Chinese Winter Wheat Cultivars, Zhongguo Nongye Kexue (Scientia Agricultura Sinicca), 41(10):2923-2930(杨芳萍,何心尧,何中虎,尚勋武,杨文雄,夏先春, 2008,中国小麦品种黄色素含量因等位变异分子检测及其分布规律研究,中国农业科学, 41(10):2923-2930)
Yang J.H., Wang S.W., Liu X.Y., Yang J.F., Zhang M.F., 2008, Development and Application of Functional Markers in Higher Plants , Zhongguo Nongye Kexue (Scientia Agricultura Sinicca), 41(11):3429-3436 (杨景华,王士伟,刘训言,杨加付,张明方,2008,高等植物功能性分子标记的开发与利用,中国农业科学,41(11):3429-3436)
Zhang L.P., Ge X.X., He Z.H., Wang D.S., Xia X.C., Mark M.S., 2005, Mapping QTLs for Polyphenol Oxidase Activity in a DH Population from Common Wheat, Zuowu Xuebao(Acta Agronomica Sinica),31:7-10(张立平,葛秀秀,何中虎,王德森,闫俊,夏先春,Mark M Sutherland, 2005,普通小麦多酚氧化酶活性的QTL分析,作物学报, 31:7-10)