2.四川农业大学生命科学与理学院, 雅安, 625014
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2010 年, 第 29 卷, 第 7 篇 doi: 10.5376/gab.cn.2010.29.0007
收稿日期: 2010年11月26日 接受日期: 2010年12月21日 发表日期: 2010年12月21日
李文博等, 2010, 马铃薯品种米拉无性变异系“Rsy17”的生化标记鉴定, 基因组学与应用生物学(Online) Vol.29 No.7 (doi: 10.5376/gab.cn.2010.29.0007)
为鉴定和评价马铃薯品种“米拉”及其无性变异系后代“Rsy17”的遗传差异,本试验采用聚丙烯酰胺凝胶电泳,分别对其块茎水溶蛋白、盐溶蛋白、醇溶蛋白和叶片过氧化物酶(POD)同工酶进行电泳分析。结果表明,“米拉”及其无性变异系后代“Rsy17”的各标记均可获得清晰易辩的电泳图谱,并显示出各自特有的谱带组合。其中水溶蛋白、盐溶蛋白、醇溶蛋白和POD同工酶显示:差异条带数目分别为6条(50%)、3条(30%)、8条(66.7%)、5条(71.4%)。由此可证,变异系材料“Rsy17”与亲本“米拉”确有遗传差异。而这几种标记方法既可构建成一套马铃薯生化标记鉴定技术体系,也可为马铃薯品种资源鉴定提供技术保证。
我国马铃薯(Solanum tuberosum. L)种质资源有限,品种遗传背景单一,亲缘关系较近(金光辉, 1999, 作物品种资源, 4: 12-13)。因此,扩大收集、保存种质资源并加以深入研究鉴定是保证我国马铃薯育种工作取得突破性成就的先决条件。目前,马铃薯品种资源鉴定多采用以形态学为基础的重要农艺性状标记,如植株特征、块茎性状、花、淀粉含量等(张绍荣等, 2010; 李军, 2007)。这些性状易受栽培方式和生长环境等因子影响,使鉴定准确度低;同时,用于形态学标记的基因位点数目少,对于部分相似近缘品种(系)难以区分(刘勋甲等, 1998)。此外,还有快速发展的分子标记如RAPD、AFLP、SSR等(薛淮等, 2000; 邸宏等, 2006; 段艳凤等, 2009)多种形式的鉴定方法,这类方法虽具有较高的准确性,但实验条件要求高。因此,探索一套马铃薯品种资源快速准确鉴定的新技术体系具有重要意义。
生化标记(biochemical markers)是在蛋白质多态性的基础上发展起来的标记方法.主要包括同工酶和贮藏蛋白标记(张传军等, 2006)。它作为一种简捷、准确度高、多态性好、可操作性强的品种资源鉴定手段,已广泛应用于水稻(蒋冬花等, 2007)、小麦(郝小燕等, 2006)和玉米(李艳等, 2007)等多种作物,而在马铃薯中只有为数不多的研究(Bárta et al., 2003; Humera, 2006; Svetlana and Eva, 2006)。本实验为评价马铃薯品种“米拉”及其无性变异系后代“Rsy17”的近缘关系,通过对它们的水溶蛋白、盐溶蛋白、醇溶蛋白和POD同工酶进行电泳分析,比较和分析各种生化标记手段的优势,并试图建立一套马铃薯品种资源生化标记技术体系,以期为马铃薯品种选育及系统演化研究提供技术保证,并服务于育种工作和生产实践。
1结果与分析
1.1水溶性蛋白质电泳分析
根据电泳图谱(图1)显示,水溶蛋白电泳可获分辨率高的图谱,可将“米拉”及其变异系“Rsy17”电泳条带分为三个主要区组,即W1、W2、W3区。W1区差异较大,W2区有一定差异,W3区几乎无差异。两份材料共分离出12条迁移率不同的条带,6条(50%)为“Rsy17”所特有的条带,6条(50%)为两材料的共同条带,它们的遗传相似系数为0.50。表明米拉及其变异系材料确有遗传差异,水溶蛋白电泳可用于马铃薯品种资源的鉴定。
.png) 图1 水溶蛋白电泳图谱 |
1.2盐溶性蛋白质电泳分析
通过对电泳图谱(图2)的分析,马铃薯“米拉”及其变异系“Rsy17”的盐溶蛋白质电泳谱带也主要集中在三个区域,即S1、S2、S3区。三个区域均存在一定差异,但差异不明显。两份材料共分离出10条迁移率不同的条带,3条(30%)为特异性条带,7条(70%)为两材料的共同条带,两材料的遗传相似系数为0.70。表明两材料具有遗传差异,但差异较小,也可用于品种标记,但对于部分近缘品种(系)可能达不到较好的鉴定效果,故盐溶蛋白电泳分析只可作为生化鉴定的一种辅助手段。
.png) 图2 盐溶蛋白电泳图谱 |
1.3醇溶性蛋白质电泳分析
通过对“米拉”与“Rsy17”醇溶蛋白电泳分析,可获分离效果好、蛋白分离条带多的电泳图谱(图3)。根据图谱显示可将其分为两个主要区组,即A1和A2区。其中,A2区差异较大,几乎均为各自的特征条带,A1区也有部分差异。两材料共分离出12条迁移率不同的条带,8条(66.7%)有特异性,4条(33.3%)为两材料的共同条带,遗传相似系数为0.33。醇溶蛋白电泳分析结果表明,两材料遗传差异大,有较好的鉴定效果,可作品种资源鉴定的重要标记。
|
|
1.4过氧化物酶同工酶电泳分析
根据“米拉”与“Rsy17”POD同工酶电泳图谱(图4)显示,同工酶电泳谱带清晰易辩,且相对较集中。两材料分别分离出3条和6条谱带,共分离出7条迁移率不同的条带,5条(71.4%)为两材料的特征性条带,2条(28.6%)为两材料的共同条带,遗传相似系数为0.29。POD同工酶电泳分析表明,两材料间遗传差异较大。因此,POD同工酶可作为马铃薯品种资源鉴定的又一重要指标。
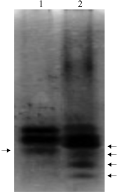 图4 过氧化物酶同工酶电泳图谱 |
1.5小结
通过以上4种聚丙烯酰胺凝胶电泳分析结果表明,几种生化标记方法均可获得清晰易辩、蛋白质分离效果好、谱带多的图谱。各种标记结果均显示出品种(系)的谱带组合,表明变异系与亲本确有遗传差异,其遗传相似系数盐溶蛋白最高,POD同工酶最低。对比分析各种鉴定方法,各具特色,标记结果也不尽相同。从实验操作来看,A-PAGE电泳醇溶蛋白最简捷,Native-PAGE电泳同工酶相对较繁琐、时间长。再从电泳结果来看,SDS-PAGE电泳水溶蛋白、盐溶蛋白的图谱最清晰,其次是Native-PAGE电泳过氧化物同工酶,A-PAGE电泳醇溶蛋白在马铃薯的中应用技术条件还有待进一步优化,获得清晰度更高的图谱;醇溶蛋白和水溶蛋白分离出的条带最多、效果最好,其次是盐溶蛋白,过氧化物酶同工酶分离的条带最少,带型较集中。而从鉴定结果来看,POD同工酶差异最大,醇溶蛋白次之,水溶蛋白差异较小,盐溶蛋白差异最小。综上所述,过氧化物同工酶标记准确性最高,醇溶蛋白标记效率最高,盐溶蛋白标记效果较差。因此,在马铃薯生化标记鉴定中醇溶蛋白和同工酶标记为主,水溶蛋白次之,盐溶蛋白可作为一种辅助手段。
2讨论
2.1马铃薯无性系芽变发生及利用
马铃薯遗传基础复杂,其育种最有效的途径是针对推广品种的个别缺点进行改良。因此,无性芽变和体细胞杂交在品种改良和新品种的选育中得到了广泛运用,如布尔斑克、红纹白和男爵等都是利用芽变选育出来的。在植物组培中,由于组培环境引发了细胞异染色质DNA延迟复制,产生了较田间自然突变率高出500倍的大量变异(刘进平等, 2001, 华南热带农业大学学报, 7(2): 22-29, 34),本实验的变异系材料来源即是米拉在组培过程中产生的无性系芽变。近年来的研究还表明在保持原有性状基本稳定的前提下,植物组织、细胞培养过程原生质体再生株系在表型、细胞和分子水平的遗传变异十分丰富,一个组织培养周期内可产生1%~3%的无性系变异,有时甚至高达90%以上(孙振元等, 2005)。因此,开发自然芽变或多种诱变产生的无性系变异材料,对丰富我们的遗传资源和种质资源的持续扩大收集、保存,对我国马铃薯育种工作具有较大的辅助作用。
2.2马铃薯生化鉴定的应用前景
生化标记作为一种简捷、准确性高、重复性好、可操作性强的作物品种资源鉴定方法,弥补了其它遗传鉴定手段的缺陷,诸如品种资源间的亲缘关系和系统进化进程研究、品种真实性检验、系统分类及地理分布的研究、遗传多样性研究、新品种鉴定和植物抗性选育等(肖复明等, 2003)方面。因此,通过各种方式的生化标记,建立马铃薯品种资源生化鉴定技术颇具价值。总结前人研究和结合本实验结论,生化标记技术虽具有诸多优势,但目前在马铃薯上少有应用,其技术亟待优化,如醇溶蛋白电泳图谱清晰度有待提高,这可能与马铃薯醇溶蛋白含量、分子量、凝胶浓度和pH等多个因素相关。
3材料与方法
3.1供试材料
米拉(Mira),德国品种,1956年引入我国,又名“德友1号”。中晚熟品种,生育期为115 d左右。淀粉加工及鲜食兼用型。抗晚疫病,高抗癌肿病,不抗粉痂病,退化慢。一般产量为1 000~1 500 kg/667 m2。适于无霜期长、雨多湿度大、晚疫病易流行的西南一季作山区种植。多分布在湖北、贵州、四川和云南等地。
马铃薯品种“米拉”及其无性变异系“Rsy17”的脱毒原种,由四川农业大学农学院马铃薯研究与开发中心提供。变异系材料经两年四季种植表型性状优良,且不发生分离。
3.2主要试剂
考马斯亮蓝R250 (Fluka公司),丙烯酰胺、N,N’-甲叉双丙烯酰胺、四甲基乙二胺、过硫酸铵、三羟甲基氨基甲烷、甲基绿、甘氨酸(Solarbio公司),氯化钠、2-氯乙醇、磷酸二氢钾、磷酸氢二钾、硫酸亚铁、三氯乙酸等(国产分析纯)。
3.3主要仪器
BS210S电子分析天平(Sartorins公司),DYCZ-28A型电泳槽,DYY-6B型稳压稳流电泳仪(北京六一仪器厂),高速冰冻离心机(Sigma公司),D90数码相机(Nikon公司),移液枪(BIOHIT公司)。
3.4各种蛋白质电泳
3.4.1水溶性蛋白质电泳
将马铃薯新鲜块茎去皮50℃烘干至恒重,研磨,过80目筛,获马铃薯干粉。称取50 mg马铃薯干粉,加250 µL H2O室温浸提2 h,间歇震荡,10 000 r/min离心10 min(韩琳娜和李红梅, 2009)。采用SDS-PAGE电泳(芶琳和单志, 2010),分离胶为12.5%,浓缩胶为3%,电极缓冲液为pH 8.3 Tris-Gly溶液(含SDS),室温稳压150 V电泳2 h。考马斯亮蓝染色,拍照绘图。
3.4.2盐溶性蛋白质电泳
称取50 mg马铃薯干粉,加250 µL 2% NaCl溶液室温浸提2 h,10 000 r/min离心10 min (刘勇和姚惠源, 2006)。电泳及检测方法同3.4.1。
3.4.3醇溶性蛋白质电泳
采用A-PAGE电泳,借助郝小燕等(2006)方法,并略有改进。称取50 mg马铃薯干粉,加250 µL 25% 2-氯乙醇室温提取6 h,10 000 r/min离心10 min,凝胶浓度为12.4%,胶联度3.3%,室温稳压500 V电泳20~30 min。
3.4.4 POD同工酶电泳
称取1 g新鲜的马铃薯叶片(倒三叶),加入1 mL 0.1 mol/L pH 7.0磷酸缓冲液,冰浴研磨,浸提15 min,10 000 r/min,4℃离心20 min (王伟玲等, 2008)。采用Native-PAGE电泳(芶琳和单志, 2010),4℃稳压200 V电泳6 h。抗坏血酸-联苯胺染色(张永成和田丰, 2007),拍照绘图。
致谢
本研究由四川省科技厅马铃薯优质高产关键技术研究与产业化示范项目(05NG001-021-2)、植物生产类国家级人才培养模式创新试验区项目(00108902)和四川农业大学创新基金项目(1315)共同资助。
参考文献
Bárta J.C., Čurn V., and Diviš J., 2003, Study of biochemical variability of potato cultivars by soluble protein, isoesterase, and isoperoxidase electrophoretic patterns, Plant Soil and Environment-UZPI, 49(5): 230-236
Di H., Chen Y.L., and Jin L.P., 2006, Genetic diversity analysis of some chinese cultivated potato varieties using AFLP markers, Yuanyi Xuebao (Acta Horticulturae Sinica), 33(6): 1349-1352 (邸宏, 陈伊里, 金黎平, 2006, 中国马铃薯部分栽培品种遗传多样性的AFLP分析, 园艺学报, 33(6): 1349-1352)
Duan Y.F., Liu J., Bian C.S., Duan S.G., Xu J.F., and Jin L.P., 2009, Construction of fingerprinting and analysis of genetic diversity with SSR markers for eighty-eight approved potato cultivars (Solanum tuberosum L.) in China, Zuowu Xuebao (Acta Agronomica Sinica), 35(8): 1451-1457 (段艳凤, 刘杰, 卞春松, 段绍光, 徐建飞, 金黎平, 2009, 中国88个马铃薯审定品种SSR指纹图谱构建与遗传多样性分析, 作物学报, 35(8): 1451-1457)
Gou L., and Shan Z., eds., 2010, Biochemistry experiment, Southwest Traffic University Press, Sichuan, China, pp.76-82 (芶琳, 单志, 编著, 2010, 生物化学实验, 西南交通大学出版社, 中国, 四川, pp.76-82)
Han L.N., and Li H.M., 2009, Biochemical marker character analysis of white flower Danshen and violet flower Danshen, Shizhen Guoyiguoyao (Lishizhen Medicine and Materia Medica Research), 20(1): 211-212 (韩琳娜, 李红梅, 2009, 白花丹参和紫花丹参生化标记分析, 时珍国医国药, 20(1): 211-212)
Hao X.Y., Wang H.L., Liu C., and Ma H., 2006, A improved PAGE electrophoresis method by ISTA gliedin applied to the reality and purity of identification of wheat variety, Zhongzi (Seed), 25(2): 10-13 (郝小燕, 王红玲, 刘春, 麻浩, 2006, 改进的ISTA麦醇溶蛋白聚丙烯酰胺凝胶电泳方法在小麦品种真实性和纯度鉴定中的应用, 种子, 25(2): 10-13)
Humera A., 2006, Biochemical and molecular marks of somaclonal variantsand induced mutants of potato (Solanum tuberosum L), University of the Punjab, Lahore, Pakistan, pp.70-72
Jiang D.H., Yang B.F., Ye Y., Li J., Huang D.N., and Wei X.H., 2007, Total content and polymorphism of seed storage proteins in rice, Zhongguo Shuidao Kexue (Chinese Journal of Rice Science), 21(6): 673-676 (蒋冬花, 杨宝峰, 叶砚, 李杰, 黄大年, 魏兴华, 2007, 水稻种子贮藏蛋白总含量分布和多态性分析, 中国水稻科学, 21(6): 673-676)
Li J., 2007, Evaluation of the characteristics of virus free potato and its use in hybridization, Zhongguo Malingshu (Chinese Potato), 21(5): 261-265 (李军, 2007, 马铃薯种质资源脱毒后特性鉴定及亲本利用评价, 中国马铃薯, 21(5): 261-265)
Liu X.J., Zheng Y.L., and Yin Y., 1998, The development of genetic markers' and molecular markers' application on crops breedingⅠDevelopment of genetic markers and assay technique of molecular markers, Hubei Nongye Kexue (Hubei Agricultural Sciences), (2): 38-39, 64 (刘勋甲, 郑用琏, 尹艳, 1998, 遗传标记的发展及分子标记在农作物遗传育种中的运用Ⅰ遗传标记的发展及分子标记的检测技术(续), 湖北农业科学, (2): 38-39, 64)
Li Y., Hao J.P., Zheng Y.J., and Wang J., 2007, Analysis of the maize storage protein subunits with SDS-PAGE, Anhui Nongye Kexue (Journal of Anhui Agricultural Sciences), 35(15): 4626-4627 (李艳, 郝建平, 郑亚军, 王将, 2007, 玉米贮藏蛋白质的提取及亚基电泳分析, 安徽农业科学, 35(15): 4626-4627)
Liu Y., and Yao H.Y., 2006, Study on extraction technique of salt-soluble protein of proso millet, Liangyou Shipin Keji (Science and Technology of Cereals, Oils and Foods), 14(6): 21-23 (刘勇, 姚惠源, 2006, 黄米盐溶性蛋白提取工艺研究, 粮油食品科技, 14(6): 21-23)
Sun Z.Y., Han L., and Li Y.F., 2005, Progress in the study and application of plant somaclonal variation, He Nong Xuebao (Acta Agricuturae Nucleatae Sinica), 19(6): 479-484 (孙振元, 韩蕾, 李银凤, 2005, 植物体细胞无性系变异的研究与应用, 核农学报, 19(6): 479-484)
Svetlana S., and Eva M., 2006, Characterisation of potato (Solanum tuberosum L.) varieties by electrophoresis of tuber proteins, Plant Breed, 42(4): 142-146
Wang W.L., Wang Z., and Wang J.Y., 2008, Optimization of determination method of peroxidase activity in plant, Shiyanshi Yanjiu Yu Tansuo (Laboratory Research and Exploration), 5(3): 54-57 (王伟玲, 王展, 王晶英, 2008, 植物过氧化物酶活性测定方法优化, 实验室研究与探索, 5(3): 54-57)
Xiao F.M., Zhang A.S., and Liu D.M., 2003, Biochemical markers and its application in studying plant, Jiangxi Linye Keji (Jiangxi Forestry Science and Technology), (5): 27-29 (肖复明, 张爱生, 刘东明, 2003, 生化标记及其在植物研究中的应用, 江西林业科技, 5: 27-29)
Xue H., Liu M., Wang Y.L., Zhang C.H., and Li S.R., 2000, Peroxidase isoenzymes analysis and RAPD molecular detection on potato under simulated microgravity, He Nong Xuebao (Acta Agricuturae Nncleatae Sinica), 14(4): 218-224 (薛淮, 刘敏, 王亚林, 张纯花, 李社荣, 2000, 模拟微重力条件下马铃薯的同工酶检测及RAPD产物分析, 核农学报, 14(4): 218-224)
Zhang C.J., Liu Y.X., and Xiao Y.P., 2006, Genetic diversity and genetic markers used in plants, Shanxi Shifan Daxue Xuebao: Ziran Kexueban (Journal of Shaanxi Normal University: Nat Sci Ed), 34(3): 275-278 (张传军, 刘亦肖, 肖娅萍, 2006, 遗传多样性与植物的遗传标记, 陕西师范大学学报: 自然科学版, 34(3): 275-278)
Zhang S.R., Long G., and Cao X., 2010, Comprehensive appraisal of a group of potato strains breeded by bijie institute of agriculture, Zhongzi(Seed), 29(1): 92-95 (张绍荣, 龙国, 曹曦, 2010, 一组自育马铃薯品系的综合鉴定, 种子, 29(1): 92-95)
Zhang Y.C., and Tian F., eds., 2007, The method of potato experiment, China Agricultural Science and Technology Press, Beijing, China, pp.199-200 (张永成, 田丰, 编著, 2007, 马铃薯试验研究方法,中国农业科学技术出版社, 中国, 北京, pp.199-200)
.png)