2. 海南海德热带农业资源研究所, 三亚, 572025
3. 广西大学生命科学与技术学院, 南宁, 530005
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2010 年, 第 29 卷, 第 9 篇 doi: 10.5376/gab.cn.2010.29.0009
收稿日期: 2010年11月07日 接受日期: 2010年12月09日 发表日期: 2010年12月31日
李惠杨等, 2010, Bt应用于蚊的生物防治, 基因组学与应用生物学(Online) Vol.29 No.9 (doi: 10.5376/gab.cn.2010.29.0009)
蚊是一种主要的疾病媒介,能够传播疟疾、丝虫病、圣路易脑炎、日本流行性乙型脑炎、登革热、西尼罗热和黄热病等疾病。这些疾病严重威胁欠发达地区及热带地区人们的健康和生命,在非洲,仅疟疾每年就夺走100 000人的生命。目前,这些蚊媒疾病还没有非常有效的疫苗,而控制蚊媒疾病中的媒介逐渐成为控制和消灭这些疾病的首选。由于化学杀蚊剂存在高残留、容易产生抗性和污染环境的隐患,人们逐渐把眼光投向了以B. thuringiensis为首的生物杀蚊剂。Bt作为目前最有价值的生物农药,不仅在控制农作物害虫方面成绩斐然,还在控制蚊等疾病媒介和防治流行性疾病方面表现出巨大的潜力和价值。本文重点讨论蚊媒疾病及B. thuringiensis作为一种有效的杀蚊剂的生物学特征,包括杀蚊Bt菌株的分离、杀蚊晶体蛋白基因的分离克隆、杀蚊晶体蛋白的结构功能作用机制,以及杀蚊基因工程的相关研究进展。
目前,全世界纪录蚊虫共3 500多种,分3个亚科,三十多个属(图1)。我国已知蚊类有18 个属、48 个亚属、400种或亚种(Porter et al., 1993; 陆宝麟等, 1997, 科学出版社, pp.1-884)。蚊的生长发育分卵、幼虫、蛹和成虫4期,成虫在黄昏和夜间活动,雄蚊不吸血,以花蜜和植物汁液为食。雌蚊必须吸食人和动物的血液保证卵巢正常发育繁殖后代,雌蚊必须将卵产在水中,孳生场所包括湖泊、沼泽、稻田、沟渠、水井、水坑、缸罐、下水道和道路积水中等(White, 2004)。
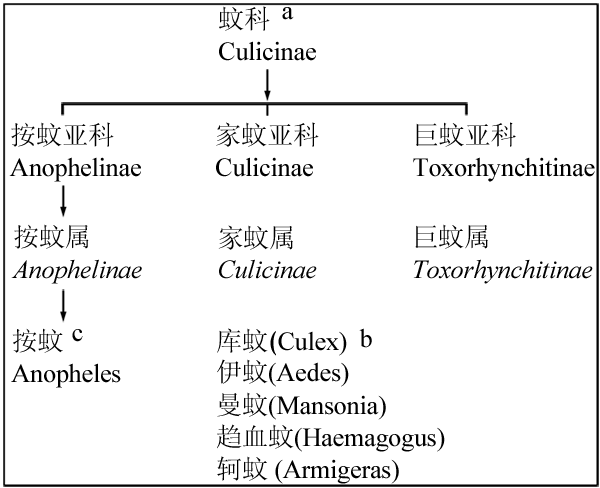 图1 蚊的分类 |
蚊是一种人类和动物重要疾病的媒介昆虫,携带和传播目前全世界广泛流行各种流行疾病,如疟疾、丝虫病、黄热病、登革热和流行性乙型脑炎等疾病,蚊媒病毒主要有黄病毒属(Flavi virus)、甲病毒属(Al pha virus)、布尼亚病毒属(Bunya virus)和白蛉热病毒属(Phlebo virus),少数其它病毒属的蚊媒病毒,如巴泰病毒(Batai)和Colti 病毒等也有报道(张海林等, 2004, 中国人兽共患病杂志, 20(9): 45-46; Reiter, 2001)。蚊媒疾病是我国一些地区很严重的公共卫生问题。 疟疾的主要传播媒介是嗜人按蚊、中华按蚊、微小按蚊和大劣按蚊。淋巴丝虫病的传播媒介为致倦库蚊、淡色库蚊、嗜人按蚊和中华按蚊,嗜人按蚊和中华按蚊也是马来丝虫病的传播媒介。三带喙库蚊是流行性乙型脑炎的主要传播媒介。登革热登革出血热为白纹伊蚊和埃及伊蚊(陆宝麟和赵彤言, 2000)。
尽管一个多世纪来,全世界竭力去控制蚊媒疾病,但各种蚊媒疾病不但没有消失,反而在局部地区有施虐加剧之势。登革热病毒在过去几十年里不断扩大传播范围,埃及伊蚊在20世纪中期基本得到控制,但现在又重新回来了,并引发大规模的出血性热。在过去10年里,西尼罗河病毒成为全美地方性流行疾病,基孔肯雅病毒已经进入印度洋地区和亚洲大陆,乙型脑炎的传播范围也不断扩大,进入印度次大陆和大洋洲。尤其是疟疾依然是一种重要的地方性流行疾病,主要危害儿童和青少年,每年有3 500万~50 000万起病例,其中每年至少一百多万儿童死于疟疾(Campbell et al., 2002; Gubler, 2004; White, 2004;Pialoux et al., 2007),图2为引起疟疾的疟原虫的生活史。
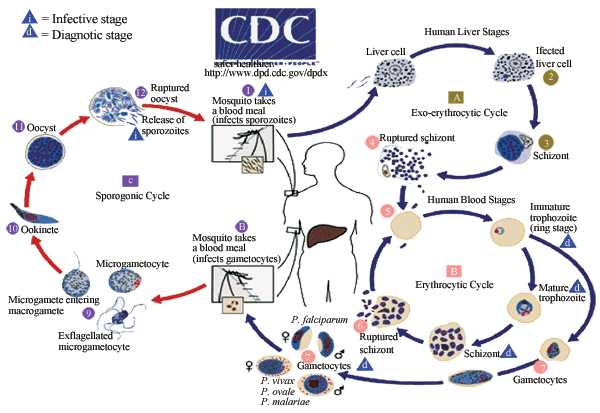 图2 疟原虫生活史(转载自美国疾病控制中心官方网站) |
控制蚊的主要策略和方法有环境防治、化学防治和生物防治等,环境防治指通过改善环境和人的居住条件及习惯,达到减少蚊虫孽生目的。近年,在我国开展的城市灭蚊中,其中就有采取通过消除孽生场所减少蚊虫孽生。在我国的黄河和淮河流域研究并推广的稻田湿润灌溉,改变常规的积水淹灌,从而改变了三带咏库蚊和中华按蚊孽生地达到控制蚊有效的繁殖(Curtis, 1992; Feng, 1937)。化学防治主要采取化学农药消杀蚊成虫,目前国内已研制并生产了马拉硫磷、杀螟松和辛硫磷等有机磷以及二氯苯醚菊醋、胺菊醋和拟除虫菊醋等多种杀虫剂。在我国室内主要采取喷洒拟除虫菊醋等杀蚊剂和蚊帐防治了嗜人按蚊和微小按蚊等叮咬,控制疟疾发病起了重要作用。虽然化学方法防治蚊虫效率高、见效快等优点,但污染环境,短期内导致抗性产生、高残留,甚至直接导致人畜中毒,必须寻找能够克服这些缺点的防治方法(蔡松武等, 2004; 陆宝粼, 2002, 中华卫生杀虫药械, 8(1): 3-5)。生物防治即直接利用生物本身或生物代谢物,来预防和控制另一种生物,最大的优点是不污染环境。生物防治蚊首先可以利用捕食性天敌,自然界由于蚊没有青蛙、蛇等足够数量的天敌,导致蚊虫以惊人的速度繁殖。其次蚊虫寄生物,如真菌和索线虫等,研究表明真菌L. agenidium、Coelomomyces 和Culicinomyces可以影响蚊虫的密度(Srinivasan and Kalyanasundaram, 2006)。另外是蚊虫病原体,典型代表是已经得到广泛研究和应用的苏云金杆菌和球形芽孢杆菌(Bs)。蚊虫生物控制越来越受到人们的重视。具体体现为生物防治方法作为综合防治的一部分逐渐加强,应用明显增多,逐渐向生物防治与生态防治随着人们对自身生存环境质量的要求越来越高,化学杀虫剂因为高毒、高残留、易产生抗性和易污染环境,正逐渐被更新或淘汰(Baumann et al., 1991; Priest, 1992; Roh et al., 2007)。
最近世界卫生组织根据现场实验和实验室得出的结果对各种生物防治剂进行了评估,苏云金杆菌以色列亚种各方面表现最佳,最有应用前景。Bt作为一种对昆虫线虫、原虫等有活性土著革兰氏阳性细菌,最大特点是在生长后期形成芽孢同时会在菌体一端或者两端形成一个或者多个晶体蛋白内含物(图3)。Bt是目前应用最为广泛的生物杀虫剂,其产量占整个生物杀虫剂的90%。Bt作为生物杀虫剂主要有2个应用领域,其一是用于控制危害农作物森林树木的毛虫(caterpillars),主要有咀嚼植物叶片的鳞翅目昆虫;其二是防治水生的传播各种人和动物疾病的媒介昆虫,包括蚊、蝇等。
 图3 Bt芽孢期细胞透射显微镜图(de Maagd et al., 2001) |
Bt作为一种土著的革兰氏阳性细菌其生态学还不是很清楚,但自然界普遍存在,从土壤、仓储物、昆虫尸体和植物体表面等各种各样的环境都分离到Bt菌株。Bt被认为是一种机会致病细菌,当Bt进入昆虫体内,合成的杀虫晶体蛋白会杀死昆虫,昆虫会为Bt芽孢萌发提供足够的营养。杀虫晶体蛋白(insecticidal crystal protein, ICP) 或δ内毒素是Bt活性主要成份。该毒素由晶体蛋白cry 基因(crystal protein genes)和溶细胞蛋白cyt 基因(cytolytic protein genes)编码。不同的杀虫晶体蛋白对膜翅目、同翅目、直翅目、食毛目的多种害虫以及植物病原线虫、螨类和原生动物有杀虫活性,但至今没有发现Bt的毒蛋白对哺乳动物有明显的副作用,所以现在大量的基础和应用研究围绕晶体蛋白物展开(Schnepf et al., 1998)。截止到2010年3月有204种杀虫晶体基因被克隆(具体信息参(http://www.biols.susx.ac.uk/Home/Neil_Crickmore/Bt/),这些基因相关分子生物学,包括结构和功能被不断诠释。本文将重点讨论自然界杀蚊Bt菌株分离、杀蚊的晶体蛋白结构功能及其基因的克隆,着重强调杀蚊的菌株和基因的在蚊控制的具体应用。
1杀蚊Bt菌株及晶体蛋白基因的分离
1.1杀蚊的Bt菌株
以色列亚种(Bti)是1977年发现杀蚊的Bt菌株,被证明是控制蚊及其它双翅目媒介昆虫非常有效和有潜力的生物杀虫剂(Seleena et al., 1995)。中国、巴西、加拿大、日本和阿根廷等国对本国杀蚊Bt菌株资源进行系统挖掘开发,大量特异的杀蚊Bt菌株从世界各地被分离鉴定,分别来源于土壤、植物、动物粪便和昆虫尸体,水中等各种各样的生境,同时属于不同的鞭毛血清型和亚种。土壤是微生物的大本营,植物表面、动物尸体和粪便里的细菌经过雨水冲刷等途径最终会进入土壤中。很多的杀蚊Bt菌株均分离于土壤样品,详情如表1 所列(Balaraman, 2005)。
 表1 杀蚊的Bt分离株血清型及来源 |
我国一些科研机构对国内的杀蚊Bt资源进行了挖掘和利用,中国科学院武汉病毒所、中国农科院植物保护研究所、华中农业大学、福建农林科技大学、中山大学和海南海德热带农业资源研究所等科研机构鉴定保藏了许多杀蚊Bt菌株,我国自主分离了云南亚种(Bt subsp. yunnanensis, 20ab)、玉米螟亚种(Bt subsp. astriniae, 8ac)、山东亚种(Bt subsp. shandongiensis, 20)、华中亚种(Bt subsp. huazhongensis, 40)等为国际认可的Bt新亚种。海南海德热带农业资源研究所方宣钧博士领导的研究团队对我国南方亚热带和热带地区的原始的自然保护区的土壤样品进行系统收集,并从中分离了许多杀蚊Bt菌株,这些菌株表现出很好原始性、特异性和杀蚊基因多样性(谢柳等, 2009;张文飞等, 2009)。值得特别说明是Bt 菌株S2160-1分离于广西大王岭自然保护区具有和Bt以色列亚种相当的活性,生物测定表明对致倦库蚊(LC50: 5.668 ng/mL)和白纹伊蚊(LC50: 21.113 ng/mL)活性非常高。但Bt S2160-1与Bt以色列亚种无论是蛋白谱和质粒型,还是基因型,都没有任何相似之处,而且目前从该菌株鉴定克隆了cry30Ea1、cry50Ba1和cry54Ba1等新型杀虫蛋白基因,可以预见Bt S2160-1将能在蚊的生物防治发挥巨大作业。
1.2杀蚊的晶体蛋白基因
杀蚊的Bt菌株含有晶体蛋白主要有两类,分别为溶细胞毒素Cyt类蛋白,另一类为晶体蛋白Cry蛋白。Cry蛋白和Cyt蛋白在序列和结构没有表现出任何的同源性,一般Cry蛋白有比较广的杀虫活性,靶标包括了鳞翅目、双翅目、鞘翅目、线虫和原虫等,cty蛋白一般只对蚊和蝇等双翅目昆虫有活性,而且对昆虫和哺乳动物红细胞、淋巴细胞和纤维细胞有溶细胞作用(Schnepf et al., 1998; Butko, 2003)。1989 年Hofte 和Whiteley (1989)提出HW分类系统,最先将 42 个杀虫蛋白酸分为5类,14 亚类,分类标准是蛋白氨基酸序列的相似性及其杀虫活性不同(表2)。但随着新的杀虫晶体蛋白基因被分离克隆,HW 分类系统变得矛盾重重,Crickmore等(1998)组成Bt毒素命名委员会于1995年提出新的分类原则,完全根据毒素蛋白的氨基酸序列同源性进行分类,氨基酸序列相似性45%、78% 和95%作为分类界限分4级,譬如氨基酸序列相似性小于45%划分为Cry1、Cry2等为第一等级,氨基酸序列相似性在45%至78%之间作为分类的第二等级,如cry54A、cry54B,如果氨基酸的相似性在在78%至95%则为分类的第三等级,如Cry30Ca、Cry30Cb等,氨基酸相似性大于95%为分类的第四等级,如Cry1Ac1、Cry1Ac2等。
 表2 苏云金芽胞杆菌杀虫晶体蛋白基因分类(Hofte and Whiteley, 1989) |
现在已经从Bti中分离了6类杀蚊毒素晶体蛋白基因,分别是Cry4A、Cry4Ba、Cry10Aa、Cry11Aa、Cyt1Aa 和Cyt2Ba,到目前已经有将近一百类杀蚊晶体蛋白基因被克隆分离,占杀虫蛋白基因总数的五成(表3)。现在分子生物学技术的迅猛发展大大加速基因分离速度,包括分子杂交、各种PCR技术、蛋白质测序、生物测定、表达文库、显微镜技术、基因组测序和质谱技术及基因芯片等技术被广泛用于杀虫蛋白基因的鉴定克隆上(Kou and Chak, 1996; Masson et al., 1998; 刘旭光等, 2004; Beard et al., 2001)。我国在杀蚊基因克隆方面开展了广泛研究,海南海德热带农业资源研究所方宣钧博士课题组近两年来克隆了cry30Ea、cry40Da、cry50Ba和cry54Ba等杀蚊基因。
.png) 表3 杀蚊晶体蛋白基因 |
2杀蚊晶体蛋白结构功能和作用机理
2.1杀蚊晶体蛋白结构功能
杀蚊Cry同其它Cry蛋白一样,序列进行比对发现大多数Cry蛋白含有5个保守区(图4)。
.png) 图4 Cry蛋白的初级和三维结构 |
毒素蛋白C末端并非蛋白活性所必需的,原毒素进入昆虫肠道会被肠道的各种蛋白酶降解,但是C末端是蛋白与形成晶体蛋白空间结构相关。目前Cry3Aa、Cry1Aa、Cry2Aa、Cry3Bb1 和Cry4Ba晶体蛋白通过X-衍射晶体图谱确定了的三维结构,它们三维结构高度的相似,相似性远远高于其序列的相似性(Li et al., 1991; Grochuski et al., 1995; Boonserm et al., 2005)。晶体一般由3个结构域组成,N-端的结构域I又由6个α螺旋围绕中心疏水α螺旋构成α螺旋束(图5),结构域I 的α螺旋具有极性,一般认为主要作用在靶标昆虫上皮细胞形成穿孔病灶。结构域II是所谓的“棱镜”结构,如 “希腊钥匙”拓扑结构,结构域II与受体识别与结合有关,晶体毒蛋白杀虫特异性很多程度决定于其与受体特异专一的结合能力。C-末端的结构域III 是由两反向平行的β-折叠片组成的三明治结构,可能起稳定蛋白质结构的作用,并与结构域II一起参与识别和结合昆虫细胞表面受体,也有证据表明结构域III与细胞膜穿孔有关(de Maagd et al., 2001; Schnepf et al., 1998)。
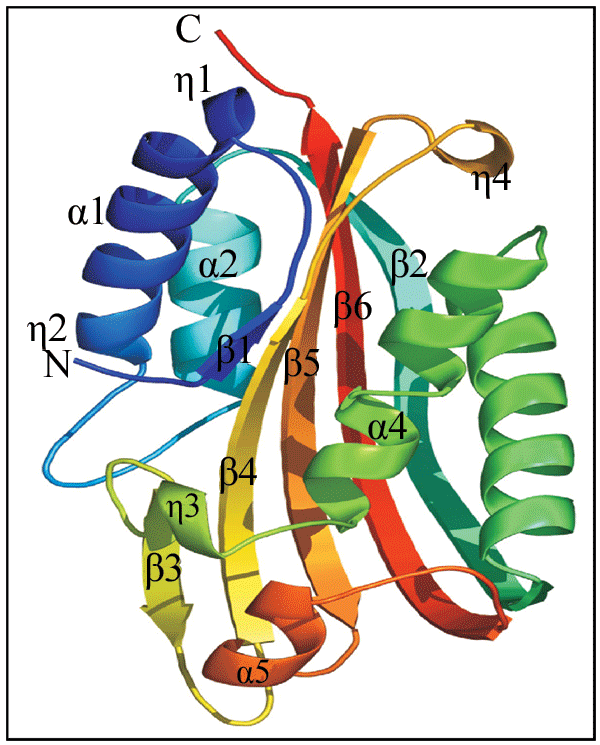 图5 Cyt2Ba蛋白单体晶体结构 |
Cyt蛋白和Cry蛋白在序列上没有表现出任何同源性,不同的Cyt蛋白进行序列多重比对分析,发现4个保守区普遍存在于Cyt蛋白中。Cyt蛋白三维结构最早始于Ward等(1988)对Cyt1A蛋白的结构的分析,由于当时同源的蛋白结构模型数据资料,仅仅凭借不充分的计算机算法进行剖析,但得到的模型抓住了结构一些特征,譬如Cyt三维结构中富含β折叠片,含有2个反向α螺旋束。后来研究人员利用X光晶体衍射法解析了Cyt2Aa蛋白的三维结构,Cyt蛋白由α螺旋和β折叠片结构组成,外层的由两α螺旋形成发卡结构,再围绕中央的β折叠片层(Li et al., 1996)。
2.2杀蚊晶体蛋白作用机理
一般认为Cry蛋白作用昆虫分几个主要步骤进行,如图6首先Cry蛋白被昆虫摄入进入中肠,毒蛋白被溶解在中肠碱性PH环境下。接着蛋白N-末端和C-末端被中肠里碱性蛋白酶消化,这样所谓的原毒素转变成活性片段,然后活性片段和昆虫中肠上皮细胞膜上表面上受体结合,结构域II和结构域III参与细胞膜表面受体识别和结合。接下来毒蛋白经过一系列的构象变化,结构域I中2个螺旋发夹结构插入细胞膜,结果导致细胞膜出现穿孔病灶,破坏的细胞膜内外的渗透压变化,PH平衡等造成细胞破坏(de Maagd et al., 2001)。
| 图6 Cry蛋白作用机理图示 |
对于鳞翅目有活性Cry蛋白的4种不同的受体已在不同的昆虫得到了描述,分别为钙粘蛋白样蛋白(CADR)、糖基磷脂酰肌醇(GPI)-氨基肽酶复合物(APN)、GPI-磷酸酶(ALP)复合物和270 kD的糖复合物(Jurat-Fuentes and Adang, 2004; Knight et al., 1994; Vadlamudi et al., 1995; Valaitis et al., 2001)。Cry1A蛋白作用烟草天蛾的模型中,Cry1A蛋白与2个相应的受体相互作用,结合在CADR受体Cry1Aa蛋白单体上的螺旋a1会被蛋白酶水解,促使形成250 kD低聚物,为形成穿孔前体,接下来前体会与-氨基肽酶复合物(APN)高亲和力结合,这样有利于蛋白低聚物插入脂质的细胞膜中(Bravo et al., 2004; Gómez et al., 2002; van et al., 1990)。穿孔前体稳定孔道形成也说明了低聚物是一种细胞嵌入蛋白的中间体。Cry蛋白与细胞膜特异的受体结合,并嵌入的细胞膜中形成穿孔,造成了昆虫病灶的形成(Bravo et al., 2004; Zhuang et al., 2002; Rausell et al., 2004)。
杀蚊Cry蛋白作用机理和杀鳞翅目Cry蛋白作用机制基本相仿。对双翅目有特异活性的Cry11Aa和Cry4Ba毒素,在埃及伊蚊幼虫的中肠刷状缘膜囊细胞膜上找到了与之结合的65 kD受体蛋白,后来进一步确定为GPI-ALP蛋白复合体,还发现Cry11Aa蛋白 Domain II 环 a-8区域与GPI-ALP蛋白复合体结合(Buzdin et al., 2002)。另外一个与Cry11Aa 蛋白结合的200 kD跨膜蛋白被鉴定为多种Cry蛋白受体,并且Charles 等研究表明以色列亚种晶体蛋白导致伊蚊的肠道上皮细胞组织病理学变化与Cry1A蛋白作用于鳞翅目昆虫相似,可能杀蚊晶体蛋白与其他内毒素的作用机理具有一致性(Charles and de Barjac, 1983; Fernandez et al., 2006)。但Cyt杀蚊机制有别于Cry蛋白,这可能也是杀蚊Cyt蛋白和Cry蛋白基因协同性,并且Cyt蛋白能够延缓昆虫对Cry蛋白的抗性。Cyt蛋白同Cry蛋白不同,α螺旋相对较少,而β折叠片相对较多,插入昆虫上皮细胞膜的不是α螺旋,而是β折叠片,显然Cyt形成穿孔的机制完全不同于Cry蛋白(Pérez et al., 2005; Schnepf et al., 1998)。
3杀蚊Bt工程菌株的构建
虽然现在已经从自然野生环境中分离了许多对蚊高毒的Bt菌株,包括以色列亚种、加拿大亚种、达姆斯塔特亚种、莫里逊亚种和汤普生亚种等。但野生菌株应用到生产实践总会有些缺陷和不足,研究人员希望采取现代生物技术手段进行遗传改造达到理想要求,其中基因组合、基因重组、基因突变(基因点突变、基因片段缺失或增加、基因杂交)、基因结构域置换、基因异源表达和提高基因表达量被广泛应用于Bt工程菌株。杀蚊工程菌构建目标主要是:(1)提高菌株杀虫活性,包括提高杀蚊蛋白表达量,多种杀蚊毒蛋白组合表达;(2)扩大菌株杀蚊范围,最好对库蚊、伊蚊和按蚊都有很高杀虫活性;(3)工程菌株通过遗产改良能够延缓昆虫对其的抗性;(4)杀蚊蛋白异源表达,进入幼蚊摄食区域,增加毒蛋白进入幼蚊体内机会(Porter et al., 1993; Federici et al., 2006)。
遗传改良野生杀蚊菌株的基本策略是基于球形芽孢杆菌(B. sphaericus, Bs)和Bt两大杀蚊细菌。近三十年来,如BS1593 a和Bs 2362,很多对蚊高毒的Bs菌株被分离,并从这些Bs菌株鉴定克隆了对蚊有活性的二元毒素和Mtx毒素蛋白。Bs杀蚊活性主要依靠产生的毒素蛋白,二元毒素蛋白为P51 和P42蛋白,分子量分别51.4 kD 和41.9 kD在芽孢期同样能够形成晶体,但要求两者同时表达才能组装成晶体蛋白,研究表明二元毒素只有同时存在才能发挥最大杀虫活性(Baumann et al., 1991; Charles and de Barjac, 1983)。Bs同Bti比较,两者对库蚊活性高,前者伊蚊活性高,对按蚊活性低;后者对按蚊活性很高,但对伊蚊活性低。另外整体而言Bs相对Bti活性略低,但Bs在野生环境,尤其是污水中,芽孢活性较Bti持效期要长(Priest, 1992)。
重组杀蚊芽孢杆菌杆菌策略之一,是将Bti中cry基因导入到相关的杀蚊Bs菌株中,其中Bs 2297作为接受cry基因的典型的受体菌株。总的来说,一旦Bs菌株含有cry基因会比原始菌株对各种蚊的活性更强。另外,埃及伊蚊和库蚊逐渐对Bs的二元毒素产生了相应的抗性,含有cry基因Bs重组菌株不但能够增加杀蚊活性,还可以昆虫抗性的产生。例如含有cry11A和cyt1A基因片段通过载体pPL603E导入到Bs 2362菌株中(Baumann et al., 1991; Pardo-López el al., 2009),这样重组球形芽孢杆菌既能够产生二元毒素,又能够产生Cry1A和Cyt1A蛋白。结构重组菌株对埃及伊蚊活性比原始Bs菌株高出十多倍。策略之二即把Bs的二元毒素导入到Bti菌株中,Bti已经具有丰富多样的杀虫蛋白和广谱高效杀虫活性,如果Bs的二元毒素同时表达,毫无疑问杀虫和延缓昆虫抗性的效果会更好。Bs 1593的二元毒素通过穿梭载体pBU4转化到Bti 4QS-72菌株中,除产生了原来的毒素蛋白,还表达了51.4 kD和 41.9 kD的蛋白,结果表明重组菌株比原来的任何原始菌株的杀蚊效果更好(Bourgouin et al., 1990)。笔者认为将Bti的cry基因转入到Bs菌株中更有优势,Bs作为受体菌株杀蚊效果更持久,在蚊的栖息地污水中效果较Bti更好(表4)。
| 表4 Bti重组菌表达Bs二元毒素对四龄库蚊的活性 |
杀蚊基因工程还包括将各种杀蚊蛋白基因被尝试在不同新的宿主中异源表达,柄杆菌(Caulobacter Crescentus)用来表达Cry4蛋白,柄杆菌在鞭毛帮助下能够不停运动,频繁在蚊幼虫栖息地活动,而且柄杆菌具有很强抗逆性,因此杀蚊毒素基因在柄杆菌表达大大增加幼蚊摄入毒蛋白的几率(Thanabalu et al., 1992)。蓝藻(Cyanobacteria)是一种单细胞原核生物,生活水面幼蚊摄食区,是蚊幼的主要食物之一。因此如果杀蚊蛋白能够在蓝藻中表达,杀蚊毒素蛋白能够更有效进入幼蚊体内发挥作用(Angsuthanasombat and Panyim, 1989)。美国、以色列、法国和中国国的科学家就尝试将Bt以色列亚种的晶体毒蛋白基因转入蓝藻细胞中表达,希望以此提高杀蚊剂的实际效果,遗憾是目前尚未解决杀蚊的cry基因在蓝藻中表达很低的瓶颈,但这并影响研究人员对此的热情,世界各地的科学家正利用各种方法和手段提高细菌原的毒素蛋白基因在蓝藻中的表达,提高杀虫效果。
近年科学家对杀蚊蛋白分子设计表现出浓厚的兴趣,美国俄亥俄州州立大学芽孢杆菌研究中心的Dean课题组用Cry4Ba蛋白的结构域Ⅱ去置换Cry1Aa 蛋白的结构域Ⅱ,结构重组蛋白分子对原来的靶标昆虫烟草天蛾(Manduca sexta)鳞翅目昆虫没有活性了,却对蚊双翅目昆虫有活性(Liu and Dean, 2006)。另外很多杀蚊毒素杀虫活性表现出良好的协调作用,把野生菌株本来不在一起的协调毒素重组在一起,不但杀蚊效果成倍增加,而且能够有效延缓昆虫抗性产生。Cry蛋白和Cyt 蛋白在一起杀蚊具有很好协同作用,Promdonkoy等(2005)将Cry4Ba和Cyt2Aa2蛋白一起在大肠杆菌中表达,郑大胜等将cry11Aa和cyt1Aa在一起表达,结果表明协同作用的毒素蛋白重组杀蚊效果优势明显。
4展望
蚊是许多重要疾病的媒介,譬如疟疾、丝虫病、圣路易脑炎、日本流行性乙型脑炎、登革热、西尼罗热、罗斯河热和黄热病等,这些疾病严重威胁不发达地区及热带地区人们的健康和生命安全,尤其是对儿童和青少年的危害更大。这些疾病都是通过蚊作为媒介传播的,近代不乏曾大面积流行过,但目前控制这些疾病的疫苗尚不能普及,也不是那么有效,控制这些疾病最最有效的途径,还是切断其传播源,即控制蚊高密度的滋生繁衍,防治上述疾病大面积传播流行。过去控制蚊虫主要依靠化学杀虫剂,其中DDT 曾风靡20 世纪,为最有效的杀虫剂,而后不断涌现出许多类型的化学杀杀蚊剂。化学杀蚊剂虽然高效,但并没有像人们预期那样消灭了蚊虫的危害,相反蚊虫更猖獗,疟疾、日本流行性乙型脑炎和登革热在局部地区本已消失,近年却死灰复燃,而且化学农药使用导致环境残留,误杀非靶标生物,引发昆虫抗性。尤其是化学农药付出了很高环境生态代价以及对人身体健康造成了直接的伤害,使人们迫切需要寻找一种更佳的方法来控制蚊及蚊媒疾病。
基于上述两难的境况,生物杀蚊剂优势凸显,尤其是Bt和Bs给生物控制蚊带来曙光,相对于化学杀蚊剂,Bt杀蚊剂具有安全、高效和经济诸多优点,尤其是昆虫不易产生抗性,不毒杀非靶标生物、不污染环境,对人畜安全。很快市场许多基于杀蚊Bt 菌株的生物杀虫剂出现,如Vectobac、Teknar、Bactimos、Skeetal、Bactimos、Teknar、Moskitur等。目前研究人员不断从自然界分离鉴定更多对蚊高毒的Bt菌株,同时杀蚊的基因也不断分离克隆,Bt菌株杀蚊基因也得到了充分的研究,现代生物技术手段广泛被应用于提高Bt菌株杀蚊效果,杀蚊工程菌获得了长足的进步,另外生物农药现代化发酵技术和制剂技术也向实际应用大踏步的前进。由此可以预见未来更多的新型的杀蚊菌株资源和高效杀蚊基因不断被发掘和利用,杀蚊机理不断被解析及现代生物技术广泛应用情况下,Bt在蚊防治及疾病控制领域将会有更大的作为。
致谢
本研究由中国Bt资源收鉴与利用项目和国家863 项目(2006AA022189)共同资助。
参考文献
Angsuthanasombat C., and Panyim S., 1989, Biosynthesis of 130-kilodalton mosquito larvicide in the cyanobacterium Agmenellum quadruplicatum PR-6, Appl. Environ. Microbiol., 55(9): 2428-2430
Bourgouin C., Delécluse A., de la Torre F., and Szulmajster J., 1990, Transfer of the toxin protein genes of Bacillus sphaericus into Bacillus thuringiensis subsp. israelensis and their expression, Appl. Environ. Microbiol., 56(2): 340-344
Baumann P., Clark M.A., Baumann L., and Broadwell A.H., 1991, Bacillus sphaericus as a mosquito pathogen: properties of the organism and its toxins, Microbiol. Rev., 55(3): 425-436
Beard C.E., Ranasingle C., and Akhurst R.J., 2001, Screen for novel cry genes by hybridization, Lett. Appl. Microbiol., 33(3): 241-245 doi:10.1046/j.1472-765x.2001.00982.x
Buzdin A.A., Revina L.P., Kostina L.I., Zalunin I.A., and Chestukhina G.G., 2002, Interaction of 65- and 62- kD proteins from the apical membranes of the Aedes aegypti larvae midgut epithelium with Cry4B and Cry11A endotoxins of Bacillus thuringiensis, Biochemistry (Moscow), 67(5): 540-546 doi:10.1023/A:1015594127636
Butko P., 2003, Cytolytic toxin Cyt1A and its mechanism of membrane damage: data and hypotheses, Applied and Environmental Microbiology, 69(5): 2415-2422 doi:10.1128/AEM.69.5.2415-2422.2003
Bravo A., Gómez I., Conde J., Muñoz-Garay C., Sánchez J., Miranda R., Zhuang M., Gill S.S., and Soberón M., 2004, Oligomerization triggers differential binding of a Bacillus thuringiensis Cry1Ab pore-forming toxin to aminopeptidase N receptor leading to insertion into membrane microdomains, Biochem. Biophys. Acta., 1667(1): 38-46
Balaraman K., 2005, Occurrence and diversity of mosquitocidal strains of Bacillus thuringiensis, J. Vect. Borne. Dis., 42(3): 81-86
Boonserm P., Davis P., Ellar D.J., and Li J., 2005, Crystal structure of the mosquito-larvicidal toxin Cry4Ba and its biological implications, Journal of Molecular Biology, 348(2): 363-382
doi:10.1016/j.jmb.2005.02.013
Charles J.F., and de Barjac H., 1983, Action des cristaux de Bacillus thuringiensis var. israelensis sur l’intestin moyen des larves de Aedes aegypti, en microscopie életronique, Ann. Microbiol. (Inst Pasteur), 134A: 197-218
Curtis C.F., 1992, Spraying bednets with deltamethrin in Sichuan, China Trop. Dis. Bull., 89(8): R1-R6
Crickmore N., Zeigler D. R., Feitelson J., Schnepf E., van Rie J., Lereclus D., Baum J., and Dean D.H., 1998, Revision of the nomenclature for the Bacillus thuringiensis pesticidal crystal proteins, Microbiol. Mol. Biol. Rev., 62(3): 807-813
Campbell G.L., Marfin A.A., Lanciotti R.S., and Gubler D.J., 2002, West Nile virus, Lancet Infect Dis., 2(9): 519-529 doi:10.1016/S1473-3099(02)00368-7
Cai S.W., Lin L.F., Lu W.C., Yin W.X., Yi J.R., and Duan J.H., 2004, Ultra-low-volume application of beta-cypermethrin for the control of Aedes albopictus in field, Zhongguo Meijie Shengwuxue Ji Kongzhi Zazhi (Chinese Journal of Vector Biology and Control), 15(6): 439-440 (蔡松武, 林立丰, 卢文成, 阴伟雄, 易建荣, 段金花, 2004, 高效氯氰菊酯超低容量喷雾杀灭室外白纹伊蚊的研究, 中国媒介生物学及控制杂志, 15(6): 439-440)
de Maagd R.A., Bravo A., and Crickmore N., 2001, How Bacillus thuringiensis has evolved specific toxins to colonize the insect world, Trends in Genetics, 17(4): 193-199 doi:10.1016/S0168-9525(01)02237-5
Feng L.C., 1937, The anopheline mosquitoes and the epidemiology of malaria in China, Chinese Med. J., 51: 1005-1020
Federici B.A., Park H.W., Bideshi D.K., Wirth M.C., and Johnson J.J., 2006, Recombinant bacteria for mosquito control, The Journal of Experimental Biology, 206: 3877-3885 doi:10.1242/jeb.00643
Fernandez L.E., Aimanova K.G., Gill S.S., Bravo A., and Soberón M., 2006, A GPI-anchored alkaline phosphatase is a functional midgut receptor of Cry11Aa toxin in Aedes aegypti larvae, Biochem. J., 394(pt1): 77-84
Grochuski P., Masson L., Borisova S., Pusztai-Carey M., Schwartz J.L., Brousse-au R., and Cygler M., 1995, Bacillus thuringiensis CryIA (a) insecticidal toxin: crystal structure and channel formation, J. Mol. Biol., 254(3): 447-464 doi:10.1006/jmbi.1995.0630
Gómez I., Sánchez J., Miranda R., Bravo A., and Soberón M., 2002, Cadherin-like receptor binding facilitates proteolytic cleavage of helix _-1in domain I and oligomer pre-pore formation of Bacillus thuringiensis Cry1Ab toxin, FEBS Lett., 513(2~3): 242-246
Gubler D.J., 2004, The changing epidemiology of yellow fever and dengue, 1900 to 2003: full circle? Comparative Immunology, Microbiology and Infectious Diseases, 27(5): 319-330 doi:10.1016/j.cimid.2004.03.013
Hofte H., and Whiteley H.R., 1989, Insecticidal crystal proteins of Bacillus thuringiensis, Microbiol. Rev., 53(2): 242-255
Jurat-Fuentes J.L., and Adang M.J., 2004, Characterization of a Cry1Ac-receptor alkaline phosphatase in susceptible and resistant Heliothis virescens larvae, Eur. J. Biochem., 271(15): 3127-3135 doi:10.1111/j.1432-1033.2004.04238.x
Knight P., Crickmore N., and Ellar D.J., 1994, The receptor for Bacillus thuringiensis CryIA (c) delta-endotoxin in the brush border membrane is aminopeptidase, N. Mol. Microbiol., 11(3): 429-436 doi:10.1111/j.1365-2958.1994.tb00324.x
Kou W.S., and Chak K.F., 1996, Identification of novel cry2-type genes from Bacillus thuringiensis strains on the basis of restriction fragment length polymorphism of the PCR-amplified DNA, Appl. Environ. Microbiol., 62(4): 1369-1 377
Li J.D., Carroll J., and Ellar D.J., 1991, Crystal structure of insecticidal δ-endotoxin from Bacillus thuringiensis at 2.5A resolution, Nature, 353(6347): 815-821 doi:10.1038/353815a0
Li J., Koni P.A., and Ellar D.J. 1996, Structure of the mosquitocidal delta-endotoxin CytB from Bacillus thuringiensis ssp. kyushuensis and implications for membrane pore formation, J. Mol. Biol., 257(1): 129-152 doi:10.1006/jmbi.1996.0152
Lu B.L., and Zhao T.Y., 2000, The mosquito studies in the past fifty years in China, Kunchong Xuebao (Acta Entomologica Sinica), 43(suppl.): 1-7 (陆宝麟, 赵彤言, 2000, 50年来我国的蚊类研究, 昆虫学报, 43(增刊): 1-7)
Liu X.G., Song F.P., Wen S.Y., Wang S.Q., Huang D.F., and Zhang J., 2004, Study of microarray detection method of cry genes from Bacillus thuringiensis, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 37(7): 987-992 (刘旭光, 宋福平, 文思远, 王升启, 黄大昉, 张杰, 2004, 苏云金芽孢杆菌cry基因芯片检测方法的研究, 中国农业科学, 37(7): 987-992