2. 海南海德热带农业资源研究所, 三亚, 572025
3. 东北林业大学盐碱地生物资源环境研究中心, 哈尔滨, 150040
* 同等贡献作者
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 19 篇 doi: 10.5376/gab.cn.2011.30.0019
收稿日期: 2010年12月22日 接受日期: 2011年04月21日 发表日期: 2011年04月27日
引用格式(中文):
刘卓明等, 2011,苏云金芽孢杆菌Cry1Ac22杀虫晶体蛋白在大肠杆菌中的表达与纯化,基因组学与应用生物学(online), Vol.30 No.19 pp.1120-1125 (doi: 10.5376/gab.cn.2011.30.0019)
引用格式(英文):
Liu et al., 2011, Heterologous expression and purification of Cry1Ac22 toxin from Bacillus thuringiensis W015-1, Bioscience Methods(Online), Vol.1 No.2(DOI:10.5376/bm.2010.01.0002)
用PCR技术从苏云金芽孢杆菌W015-1菌株中克隆了cry1Ac22基因,将该基因连接到pQE30原核表达载体上,构建了重组表达质粒pQE30-Cry1Ac22,并转化E. coli M15宿主菌。用IPTG诱导表达出了His-tag-Cry1Ac22融合蛋白。不同的IPTG浓度和培养温度的比较实验,获得了最佳诱导表达条件为:1 mmol/L IPTG浓度和28℃的培养温度。SDS-PAGE结果表明,转化了pQE30-Cry1Ac22的宿主菌株表达出了分子量为133 kD的His-tag-Cry1Ac22融合蛋白,表达的融合蛋白在细胞中以包涵体的形式存在。经Ni2+-NTA树脂亲和层析得到了纯化的His-tag-Cry1Ac22融合蛋白,并在体外检测纯化的目的蛋白浓度纯度达80%左右,浓度为1 177 μg/mL。生物活性测定表明工程菌株粗提液和纯化蛋白对小菜蛾二龄幼虫具有较高毒力。本研究为采用外源性Cry1Ac22蛋白制备抗体和进行定量杀虫活性的测定提供了方法。
苏云金芽胞杆菌(Bacillus thuringiensis, Bt)在芽孢形成的同时能产生杀虫晶体蛋白。自Schnepf和Whiteley 分离克隆了第1个Bt杀虫晶体蛋白基因以后(Schnepf et al., 1998),迄今为止,国际上已经克隆了近五百个cry基因,其中数目最多的是cry1家族类的基因。已公布的cry1A家族类基因包括cry1Aa、 cry1Ab、 cry1Ac、cry1Ad、cry1Ae、cry1Af、cry1Ag、cry1Ah和cry1Ai共9类93个基因,其中cry1Ac家族共含有34个基因(Crickmore et al., 2011, http://www.lifesci.sussex.ac.uk/home/Neil_HCrickmore/Bt/)。
Cry1Ac杀虫晶体蛋白首先在苏云金芽孢杆菌库尔斯达克变种HD73菌株中发现,为菱形晶体,分子量在129~138 kD之间(Adang et al., 1985)。由于对HD73详细研究和广泛的应用,HD73已成为Bt研究的模式菌株。Cry1Ac杀虫晶体蛋白由于广泛的用于转基因植物防治鳞翅目昆虫产生抗性而受到越来越多的关注,寻找新的菌株和多样化的杀虫晶体蛋白成为研究的热点。
Bt菌株W015-1是海南省热带农业资源研究所从僵蚕的肠道中分离出来的,其菌体的杀虫活性明显大于模式菌株HD73 (Xie et al., 2010)。W015-1在芽孢的形成过程中表达133 kD的杀虫晶体蛋白,该蛋白与HD73产生的杀虫蛋白具有明显的酶切位点多样性。
为了进一步了解Cry1Ac22杀虫晶体蛋白的特征和功能,本研究构建了pQE30-Cry1Ac22原核表达载体,并在大肠杆菌M15中大量表达和纯化了His-tag-Cry1Ac22融合蛋白,为采用外源性Cry1Ac22蛋白制备抗体和进行杀虫活性的测定奠定了基础。
1结果与分析
1.1 pQE30-Cry1Ac22原核表达载体的构建及鉴定
采用合成的引物扩增cry1Ac22基因,并构建出克隆载体。BamHⅠ和SalⅠ双酶切克隆载体得到大小为3 500 bp的片段,与预期大小一致,将该克隆载体命名为pMD18-T-Cry1Ac22 (图1A)。
阳性克隆测序结果证实与已知cry1Ac22基因全相同。将获得的pMD18-T-Cry1Ac22质粒和原核表达质粒pQE30 (图1B)经BamHⅠ和SalⅠ双酶切,连接转化大肠杆菌。获取重组子质粒,用BamHⅠ酶切鉴定,阳性重组质粒酶切产物与预期大小一致,命名pQE30-Cry1Ac22 (图1C)。重组质粒pQE30- Cry1Ac22的目的片段cry1Ac22长约3.5 kb,而其载体pQE30的长度是3.4 kb,重组子采用BamHⅠ和SalⅠ进行双酶切的片段非常的接近,电泳难以区分开来,采用BamHⅠ进行单酶切,获得1条6.9 kb的单带。
| 图1 pQE30-Cry1Ac22原核表达载体的构建及鉴定 |
将重组原核表达质粒pQE30-Cry1Ac22转化到E. coli M15感受态细胞中,挑取单菌落进行菌落PCR鉴定(图2)。图2表明1~5号泳道均为阳性转化子,说明重组质粒顺利转入到大肠杆菌宿主菌中。
| 图2菌落PCR鉴定阳性克隆 |
1.2重组融合蛋白在E. coli M15中表达及其表达条件优化
转入pQE30-Cry1Ac22重组质粒的大肠杆菌采用1 mmol/L IPTG诱导,获得诱导后的裂解液,在7.5%的聚丙烯酰胺胶上点样进行蛋白质电泳分析。由SDS-PAGE电泳图谱(图3)可见,在转化入pQE30- Cry1Ac22菌液的粗蛋白中,发现一条新的蛋白条带,分子量约133 kD左右,而未经IPTG诱导的菌液粗蛋白中未见此条带。结果初步表明,重组质粒pQE30-Cry1Ac22在IPTG诱导下,产生了融合蛋白6×His-Cry1Ac22,并得以高效表达;从表达趋势上看,随着诱导时间的延长,融合蛋白的表达量逐渐增加(图3)。
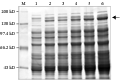 图3 融合蛋白6×His-Cry1Ac22表达的SDS-聚丙烯酰胺电泳分析 |
为了获得表达量均匀稳定的融合蛋白,对融合蛋白的表达条件进行了优化与筛选(图4)。诱导表达温度分别为21℃、28℃ 和37℃,IPTG浓度分别为0.1mmol/L、0.5 mmol/L和1.0 mmol/L。由于表达的目的蛋白分子量比较大,温度及IPTG浓度变化对蛋白表达会存在一定的影响。根据SDS-PAGE电泳分析及纯化过程中细菌培养条件,28℃的诱导温度和1.0 mmol/L IPTG 浓度确定为最适诱导表达条件(Bradford, 1976)。
 图4诱导温度以及IPTG浓度对融合蛋白表达的影响 |
1.3融合蛋白在E. coli M15中的诱导表达
在28℃ 120 r/min摇床培养和1.0 mmol/L IPTG诱导条件下对目标蛋白进行大量的表达,诱导时间分别设为3 h、6 h、9 h和12 h (图5),观察其不同的转化子的蛋白表达量。由图5可知,在表达的过程中,随着时间的延长,目的蛋白的表达量在不断的增加。同时,在相同条件下诱导不同的阳性转化子12 h,如图6所示,不同的转化子在诱导时间相同的条件下各自的表达量也不一样,选择表达状态最佳的菌株进行蛋白纯化。
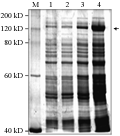 图5重组融合蛋白大量诱导表达 |
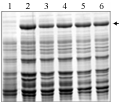 图6 28℃下1.0 mmol/L IPTG诱导不同转化子12 h后融合蛋白的表达情况 |
1.4融合蛋白的纯化
表达的包涵体蛋白采用尿素变性纯化的方法进行大量纯化。分别取含有目的蛋白的细菌裂解上清(纯化前)及收集的峰值洗脱液(纯化后)进行SDS-PAGE,133 kD附近可见目的蛋白的表达条带,且融合蛋白表达水平成为E. coli中总蛋白的主要成分,应用Ni2+-NTA树脂纯化的蛋白纯度达80%左右,并在体外检测纯化后的目的蛋白浓度,蛋白浓度为1 177 μg/mL(图7)。由图可知,通过实验纯化的目的融合蛋白,蛋白的纯度高,蛋白的含量相对比较少。
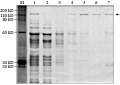 图7融合蛋白的变性大量纯化 |
1.5生物测定
将工程菌株和纯化蛋白进行杀虫生物活性测定,取培养20 h菌液及纯化蛋白稀释至适当浓度,喷洒于甘蓝叶上,饲喂二龄小菜蛾幼虫,置于25℃培养箱内,观察幼虫生长状态。喷洒了工程菌液和纯化蛋白的叶片上,小菜蛾食欲减退,行动迟缓,30 h后基本死亡。而未喷洒的对照叶片上,小菜蛾食欲正常,生长状态良好,个体肥大。通过测定工程菌和蛋白对小菜蛾害虫初孵幼虫的毒力,结果表明,构建的工程菌株及蛋白在低浓度下就对小菜夜蛾幼虫有很强的杀虫活性(数据未列出)。
2讨论
采用原核融合表达方式在大肠杆菌表达外源基因是目前普遍采用的一种高效表达方式。本研究所采用的原核表达载体pQE30是目前常用于蛋白质表达的质粒载体。它的结构特点是分子较小,只有约3.4 kb,易于操作,并且该载体带有源自pBR322的复制子和编码抗氨苄青霉素的序列,且有很强烈的T5启动子和编码6个组氨酸的纯化标签(Qiagen, 2001)。
表达宿主菌株E. coli M15是一个与pQE30表达载体相匹配的用于表达外源蛋白的宿主菌。利用该菌株能更有效的表达目的蛋白。当进行基因表达时,表达产物为6×His Tag与外源基因的融合体。表达的融合蛋白的稳定性好,不易被细菌蛋白酶降解,容易通过Ni2+-NTA树脂亲和层析柱进行分离纯化(Huang et al., 2008)。包涵体是在细菌中表达外源蛋白的主要形式,包涵体蛋白实际上是在细胞内凝集,形成活性的固体颗粒。这些颗粒的大小为0.5~1 μm,难溶与水,但易溶于变性剂如尿素(脲)及盐酸(Haacke et al., 2008)。形成包涵体有利于外源蛋白的高水平表达和防止蛋白酶对其的降解,也可避免外源蛋白对宿主细胞的毒害(Hao et al., 1996)。
本研究表达的cry1Ac22基因融合蛋白是以包涵体的形式存在。作为一个毒蛋白在宿主细胞中以包涵体的形式存在,降低了胞内外源蛋白的浓度,减少了对宿主细胞的毒害,有利于表达量的提高。采用尿素进行目的蛋白的变性纯化对Cry1Ac22蛋白的结构和功能影响较小。我们利用该方法纯化Cry1Ac22蛋白,以用于制备Cry1Ac22抗体,进一步开展Cry1Ac22蛋白的理化性质及体外毒性作用的研究。
3材料与方法
3.1菌株、质粒与试剂
供试菌株和质粒见表1。Taq DNA聚合酶、dNTP、DNA ladder Marker和λ DNA /HindⅢ Marker购自德美生物科技有限公司;SalⅠ和BamHⅠ购自TaKaRa公司;Ni2+-NTA树脂为Novagen公司产品。
| 表1供试菌株和质粒 |
3.2 Cry1Ac22的PCR扩增
根据GenBank中登录号为“EU282379”的苏云金芽胞杆菌cry1Ac22的序列设计合成扩增cry1Ac22的引物,同时在上、下游引物末端分别引入BamHⅠ和SalⅠ酶切位点。上游引物:GGA TCC ATG GAT AAC AAT CCG AAC ATC (划线处为BamHⅠ酶切位点);下游引物:GTC GAC TGA GTT TGC ATG AGA CTA TTC (划线处为SalⅠ酶切位点)。以W015-1质粒DNA为模板进行PCR扩增,扩增条件:95℃ 5 min,94℃ 30 s,54℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min。
3.3重组表达载体的构建
将经酶切后的载体pQE30和cry1Ac22目的基因按3:1摩尔数之比加入连接反应混合液中,加去离子水至总体积为20 μL,16℃过夜连接产生pQE30-Cry1Ac22表达载体,用于转化前置于冰上待用。解冻M15感受态细胞,取4 μL连接反应产物加入感受态细胞中,轻弹管壁,使其均匀分布,置冰上30 min,42℃热休克90 s,加入LB培养基400 μL,37℃振摇培养1 h,取100 μL转化液铺于含氨苄青霉素和50 ug/mL卡那霉素的的LB筛选平板上,置37℃过夜培养。挑取单菌落,利用特异引物进行菌落PCR,鉴定阳性克隆。
3.4 His-tag-Cry1Ac22融合蛋白的诱导表达及其表达条件优化
挑取阳性单菌落接种于5 mL LB液体培养基中,37℃收集1 mL菌液。将诱导后的菌液4 000 r/min 20 min离心收集,弃上清液并将样品于-80℃冷冻2 h。先加入5 mL裂解液悬浮,再加入至悬浮液为15 mL,加入溶菌酶至1 mg/mL,冰上振荡放置30 min后,取1 mL裂解液制样冷冻保存后备用。将裂解液置于10 000 r/min 4℃离心40 min,取1 mL上清液制样,SDS-PAGE电泳检测目的蛋白存在形式。在20℃、28℃和37℃ 3个不同的温度条件以及0.1 mmol/L、0.5 mmol/L和1.0 mmol/L 3个不同的IPTG浓度条件下诱导表达融合蛋白,收集菌液进行SDS-PAGE电泳分析,获得工程菌最佳诱导温度和最佳IPTG浓度。
3.5His-tag-Cry1Ac22融合蛋白的纯化
将收集的菌置于冰上15 min,加入Buffer B重悬菌体;室温下搅拌菌液15~60 min,完全裂解菌体后,10 000g离心20~30 min,收集上清液,同时取5 uL上清液制样保存进行SDS-PAGE电泳分析;加入1 mL 50%的Ni2+-NTA凝胶至裂解的上清液中,室温下温和振荡15~60 min;将裂解液和凝胶混合物加入到下端封口的凝胶柱中,打开下端盖子同时收集流出液,保留进行SDS-PAGE电泳;buffer C洗涤柱子,收集洗液进行SDS-PAGE电泳分析;buffer D洗脱柱子4次,再采用buffer E洗脱柱子4次,收集每次洗脱的液体,进行SDS-PAGE电泳分析。采用Ni2+-NTA树脂柱对融合蛋白进行亲和层析纯化。收集超离后的上清,将其转入装有Ni2+-NTA树脂的层析柱中,静置2 h。
3.6生物测定
小菜蛾(Plutella xylostella)幼虫(二龄幼虫)由本所饲养。小菜蛾杀虫活性的测定参照文献方法进行(Xie et al., 2010)。
作者贡献
刘卓明和柳参奎是本研究的实验设计和实验研究执行人,完成论文写作;李有志完成数据分析;方宣钧是项目的负责人,指导实验设计,数据分析,论文写作和修改。全体作者都阅读并同意最终的文本。
致谢
本研究受中国Bt收集与鉴定项目的资助。作者感谢东北林业大学盐碱地资源环境中心张欣欣博士,海南海德热带农业资源研究所张文飞先生及谢柳先生在本实验过程中的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Adang M.J., Staver M.J., Rocheleau T.A., Leighton J., Barker R.F., and Thompson D.V., 1985, Characterized full-length and truncated plasmid clones of the crystal protein of Bacillus thuringiensis subsp. kurstaki HD-73 and their toxicity to Manduca sexta, Gene, 36(3): 289-300 doi: 10.1016/0378-1119(85)90184-2
Bradford M.M., 1976, A rapid and sensitive method for the quantitation of microgram quantities utilizing the principle of protein dye binding, Anal. Biochem., 72(1-2): 248-254 doi: 10.1016/0003-2697(76)90527-3
Hao H., and Li H., 1996, The expression and purification of heterogeneous proteins synthesized in Escherichia coli, Zhongguo Shengwu Yaowu Zazhi (Chinese Journal of Biochemical Pharmaceutics), 17(5): 223-225 (郝宏, 李华, 1996, 大肠杆菌异源蛋白的表达与纯化研究近况, 中国生物药物杂志, 17(5): 223-225)
Haacke A., Fendrich G., Ramage P., and Geiser M., 2008, Chaper one over-expression in Escherichia coli: Apparent increased yields of soluble recombinant protein kinases are due mainly to soluble aggregates, Protein Expr. Purif., 64(2): 185-193 PMid: 19038347
Huang S.F., Liu D.B., Zeng J.M., Xiao Q., Luo M., Zhang W.P., Tao K., Wen J.P., Huang Z.G., and Feng W.L., 2008, Cloning, expression, purification and functional characterization of the oligomerization domain of Bcr-Abl oncoprotein fused to the cytoplasmic transduction peptide, Protein Expr. Purif., 64(2): 167-178 PMid: 19041400
Qiagen, ed., 2001, The QIAexpressionist. A handbook for high-level expression and purification of 6×His-tagged proteins, Hilden, Germany, pp.1-128
Sambrook J.E., Fritsch F., and Maaiatis T., eds., 2002, Experiment guidance of Molecular clone, Science press, Beijing, China, pp.483-485
Schnepf E., Crickmore N., van Rie J., Lereclus D., Baum J., Feitelson J., Zeigler D.R., and Dean D.H., 1998, Bacillus thuringiensis and its pesticidal crystal proteins, Microbiol. Mol. Biol. Rev., 62(3): 775-806 PMid: 9729609 PMCid: 98934
Xie L., Zhang W.F., Liu Z.M., Cai Y.G., Li Y.Z., and Fang X.J., 2010, Characterization of a new highly toxic isolate of Bacillus thuringiensis from the diapausing Larvae of silkworm and identification of crylA22 gene, Bt research, Vol 2010 No 1 (DOI: 10.5376/2010.2001)