2. 中国热带农业科学院生物技术研究所, 热带作物生物技术国家重点实验室, 海口, 571101
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 43 篇 doi: 10.5376/gab.cn.2011.30.0043
收稿日期: 2011年06月29日 接受日期: 2011年07月21日 发表日期: 2011年07月31日
引用格式(中文):
惠杜娟等, 2011,木薯中两种叶绿素提取方法的比较及其含量测定,基因组学与应用生物学(online), Vol.30 No.43 pp.1279-1283 (doi: 10.5376/gab.cn.2011.30.0043)
引用格式(英文):
Hui et al., 2011, Preliminary study on method for determination of chlorophyll in cassava leaves, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.43 pp.1279-1283 (doi: 10.5376/gab.cn.2011.30.0043)
叶绿素的含量是植物生理特别是光合作用的基本指标。木薯作为能源植物,研究其产能效率,就必须分析光合效率、测定其叶绿素含量。本文首先以TM6044木薯顶端完全伸展第三片叶为试材,通过80%丙酮和95%乙醇以及两者混合液共7组有机试剂为提取液,比较了研磨和浸提两种提取叶绿素的方法;以95%乙醇为提取液在不同浸提时间下测定叶绿素含量。结果除了80%丙酮外,其它各提取液的提取效果均是浸提法高于研磨法;95%乙醇的浸提效果随时间的延长叶绿素含量呈上升趋势;最终确定以毒性小的95%乙醇浸提12小时为最适方法。最后以此方法比较了木薯不同叶位叶绿素含量的差异,显示从顶端的第3片叶向下,叶绿素含量依次增加;第11片到第17片叶,叶绿素含量变化不大;到第19片叶,叶绿素的含量甚至有下降的趋势。本研究通过探讨木薯叶片叶绿素的提取试剂及方法的优劣,将为木薯田间大批量样本的叶绿素含量测定提供参考和依据。
木薯(Manihot esculanta Crantz)为大戟科(Euphorbiaceae)木薯属(Manihot)植物,是世界三大薯类作物之一,在我国主要分布于广西、广东和海南等热带、亚热带省区。木薯具备独特的生物学适应性和经济价值,特别是其超常的气候资源利用率,单位面积的生物能生产水平高于几乎所有栽培作物,因此培育高产优质的木薯品种至关重要。
绿色植物之所以能够自养,就是因为具有叶绿素,从而可吸收光能。植物利用光能效率的高低也主要取决于其叶绿素含量,因此叶绿素的含量是植物生理特别是光合作用的基本指标,对于叶绿素含量的测定是我们在农业科研和农业生产中会经常遇到的问题。长期以来,普遍采用的是Arnon (1949)提出的叶绿素含量的测定方法,这种方法是对Mackinney (1941)提出丙酮法的解释和推导。对于叶绿素提取试剂的选择,研究者们先后研究过丙酮(曹阳等, 2005; 王文杰等, 2009; Edelenbos et al., 2001; Lichtenthaler et al., 1996 )、80%丙酮(Yoshida et al., 2003; 黄帆等, 2007)二甲基亚砜(DMSO) (王文杰等, 2009; 张宪政, 1986, 辽宁农业科学, (3): 26-28)、二甲基亚胺(苏正淑和张宪政, 1989, 植物生理学通讯, (5): 77-78)、无水乙醇(徐国瑞等, 2010; 黄帆等, 2007; Gregor and MarŠálek, 2004 )、90%的无水乙醇(Arar and Collins, 1997)、丙酮+无水乙醇+蒸馏水的混合液(张宪政, 1986, 辽宁农业科学, (3): 26-28; 孙俊宝和王建新, 2010; 陈福明和陈顺伟, 1984, 混合液法测定叶绿素含量的研究, 林业实用技术, (2): 4-8)、丙酮乙醇混合液(徐国瑞等, 2010; 洪法水等, 2001; 张宪政, 1986, 辽宁农业科学, (3): 26-28)、正丁醇(孙俊宝和王建新, 2010)、甲醇(李得孝等, 2005)等的提取效果;提取的方法有研磨和浸提两种(苏正淑和张宪政, 1989, 植物生理学通讯, (5): 77-78; 黄帆等, 2007; Arar and Collins, 1997);对于叶绿素含量的表示方法,通常采用以叶片鲜重或是单位面积表示。本实验基于前人的研究,进一步探讨木薯叶片叶绿素的提取试剂及方法的优劣,为木薯田间大批量样本的叶绿素含量测定提供参考和依据。
1结果与分析
1不同提取液对研磨和浸提两种提取方法的比较
从图1可以看出,除了80%丙酮外,其它各提取液的提取效果均是浸提法高于研磨法,且经过方差分析,差异显著(Pr<0.05)。这可能是由于研磨法需要把材料研磨并经转移、过滤或离心处理,在操作过程造成了叶绿素的损失。与研磨法相比,浸提法虽耗时较长,但损耗较小提取效率高、操作比较简便,适于科研中大批量样品的测定。这一结论与李德孝等(2005)一致。
单从浸提法来看,除80%丙酮提取效率太低外,其它6组提取液的提取效率之间无显著性差异,鉴于95%乙醇作为提取试剂,毒性最小,对环境和操作者伤害小,所以后续试验的提取液均选95%乙醇,这与陈俊宝等(2010)对樱桃叶绿素提取所筛选的提取试剂不一致。
与其它组提取液相比,只有80%丙酮的研磨法效果高于浸提法,这可能由于在丙酮研磨过程中,有降解物产生,使提取液不稳定所致,但还没有相关理论可解释,具体原因还有待探索和研究。
叶绿素a与叶绿素b的比值一般都在3.6:1~2.9:1之间(结果未显示),随提取方法和提取液的变化不显著。
1.2 95%乙醇浸提效果随时间的延长叶绿素含量呈上升趋势
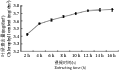
如图2所示,以95%乙醇为浸提液时,随着浸提时间的延长,叶绿素含量呈上升趋势。但在12 h以后到16 h之间,叶绿素含量的增加就不显著了,渐趋于平衡。由于在浸提开始后,叶绿素有一个由组织向外扩散的过程,因此提取出的叶绿素不断增加(徐国瑞等, 2010),当浸提时间为12 h时,组织中叶绿素向提取溶剂的扩散作用达到平衡,溶液中叶绿素含量达到最高。还有可能是由于浸提时间久了,即使在暗环境下,叶绿素有不同程度的降解,而降解的速率与这时段浸提的效率相当,甚至大于浸提增加的叶绿素量,所以叶绿素含量无法再大幅增加。此外,最佳的浸提时间还应与材料的量和浸提液量这两者的比值有关。材料越多,所需的浸提时间越长;所用浸提液体积越大,所需的浸提时间就越短。所以,对本试验的叶片材料和浸提液的比例来说,12 h为最佳浸提时间。
|
图2 95%乙醇不同浸提时间段叶绿素含量变化
Figure 2 Change of chlorophyll content at different time extracted by 95% ethanol |
1.3不同位置叶片叶绿素含量的变化
由图3可看出,从顶端的第3片叶向下,叶绿素含量依次增加,这可能由于叶片位置越偏下,叶龄大、叶片厚(本试验叶绿素含量以单位面积表示)、叶片色泽深,所以测得叶绿素含量高。在第11片到第17片叶,叶绿素含量变化不大;到第19片叶,叶绿素的含量甚至有下降的趋势,对于这一现象的原因,可能是随着叶龄的增加到一定程度,叶片中的叶绿素有不同程度部分降解,功能退化。木薯田间的种植密度如果过密,使植株下部叶片光照不足,也是导致下位叶叶绿素含量降低的一重要因素。
2讨论
对于木薯叶绿素的提取方法的比较,浸提法虽耗时,但提取效率高、操作简便、工作量小,适于大批量测定。对于几组浸提试剂,选择兼备提取效率和毒性较小的95%乙醇。在以顶端完全伸展的第三片叶为材料,以95%乙醇为浸提试剂时,确定最佳浸提时间为12 h。不同叶片位置的叶绿素含量随着叶位的偏下,先呈上升趋势,再趋于平衡,后有下降的趋势。此外,在叶绿素含量的表示方法上,选择以单位面积表示,而非传统的鲜重计量法,这样就不易受材料含水量变化的影响,也便于与单位叶面积表示的光合速率相联系(舒展等, 2010)。
总而言之,对植物叶绿素提取的最优方案没有统一的标准,不同的植物品种都有各自最佳的提取方案。为使试验数据有可比性,更有说服力,取材的叶位、叶龄、生育期等也很重要,甚至同一较大叶片的不同部位之间,叶绿素含量都有明显的差异。因此,对于最适的提取方法、提取液、浸提时间等都是对于特定的材料而言,是相对的,希望为后续的研究提供参考和借鉴。
3材料与方法
3.1材料
2010年10月份选择在海口地区生长了约2年的TM6044木薯,植株须生长一致且无病虫害,从植株顶端向下依次取材(第3、第5、第7、第9、第11、第13、第15、第17和第19片叶)。
无水乙醇、丙酮、碳酸钙和石英砂均为国产分析纯。采用UV-2450/2550型紫外可见分光光度计(SHIMADZU)测定OD值。
3.2不同提取液对研磨和浸提两种取提方法的比较
配制80%的丙酮、95%的乙醇以及80%的丙酮和95%乙醇不同混合比例的5种混合液(配制比例分别为3:1, 2:1, 1:1, 1:2和1:3)共7种提取液(孙俊宝和王建新, 2010)。
在大田栽培的木薯植株中选取顶端完全伸展的第3片叶子,将其清理干净,用知道确切面积的打孔器避开大叶脉打孔,得0.8 cm2的小片叶。
取4片小片叶分别加入3 mL以上7种提取液和少量的石英砂、碳酸钙在研钵中充分研磨,再过滤(分别用7种提取液清洗研钵及残渣, 并合并滤液),最后用不同的提取液冲洗研钵及滤纸等,最终定容至10 mL,测光密度(OD)值。
向预备试管中分别加入各种提取液10 mL,各放入4片小片叶,加盖并置于避光处,浸泡叶片,期间轻轻晃动棕色瓶几次,使得浸提更充分,20 h后待叶片完全变为白色测OD值。
将试管内的溶液到入比色杯之前,应将试管轻轻地晃动几次,使溶液均匀,然后按照Arnon (1949)的方法用分光光度计分别于663 nm和645 nm处测量光密度(OD)值。
先按Arnon (1949)的公式计算提取液的叶绿素浓度(CV, μg/mlL; Chl a=12.7×OD663-2.69×OD645, Chl b=22.9×OD645-4.86×OD663, CV=Chl a+Chl b.然后按下式计算以单位叶面积表示的叶绿素含量(mg/dm2):CA=CV 1/1 000 × 10 × 100/S=CV/S; 其中CA和CV的下标A和V分别代表面积和体积, S为用于提取叶绿素的叶片面积(cm2)) (舒展等, 2010)。
3.3 95%乙醇浸提效果随时间的变化
取木薯植株顶端完全伸展的第3片叶片并用打孔的方法取小叶片,将4片小片叶投入到含10 mL 95%乙醇的试管中,密封管口后于暗环境中浸取,每隔1 h轻轻摇晃试管,从2 h开始,每隔2 h测一次OD值,计算叶绿素含量。
3.4不同位置叶片叶绿素含量的不同
取木薯植株顶端完全伸展的第3、第5、第7、第9、第11、第13、第15和第17片叶片并用打孔的方法取小片叶,分别将各位置的4片小片叶投入到含10 mL 95%乙醇的试管中,密封管口后于暗环境中浸取,每隔1 h轻轻摇晃试管,12 h后测定OD值,并计算叶绿素含量。
3.5数据统计分析
试验所得数据均采用Excel软件整理并绘图,采用SAS 9.2软件进行统计分析
作者贡献
惠杜娟参与试验的设计、具体实验、数据处理及论文的撰写。冀乙萌负责具体实验的操作、论文最后的修改。李瑞梅和郭建春提供试验材料、指导试验的设计及论文的修改。
致谢
本研究由国家973重大基础性研究项目(2010CB126600); 国家863计划(2009AA10Z102); 木薯产业技术体系(No. nycytx-17)。在此,特别感激我的指导老师郭建春和师姐李瑞梅对我试验的指导,以及对论文提供的宝贵意见。还有和我一起做试验的冀乙萌同学,感谢你们所做的贡献。同时也感谢两位匿名评审人的评审意见和修改建议。
参考文献
Arar E. J. and Collins G. B., 1997, In vitro determination of chlorophyll a and pheophytin a in marine and freshwater algae by fluorescence, U.S. Environmental Protection Agency, Method445: 1-22
Arnon D. I., 1949, Copper enzymes in isolated chloroplast: Polyphenoloxidase in Beta vulgaris, Plant Physiology, 24(1): 1-15
http://dx.doi.org/10.1104/pp.24.1.1
PMid:16654194 PMCid:437905
Cao Y., Chen J.H., Yan W.D., Luo Y., and Li C.Z., 2005, Research of photosynthetic rate and contents of chlorophyll of Castanea mollissima BL, Hunan Linye Keji (Hunan Forestry Science and Technology), 32(5): 23-28 (曹阳, 陈建华, 阎文德, 罗勇, 李昌珠, 2005, 板栗叶绿素含量与光合速率研究, 湖南林业科技, 32(5): 23-28)
Edelenbos M., Christensen L.P., and Grevsen K., 2001, HPLC determination of chlorophyll and carotenoid pigments in processed green pea cultivars (Pisum sativum L.), Journal of Agricultural and Food Chemistry, 49(10): 4768-4774
http://dx.doi.org/10.1021/jf010569z
PMid:11600019
Gregor J., and MarŠálek B., 2004, Freshwater phytoplankton quantification by chlorophyll a: A comparative study of in vitro, in vivo and in situ methods, Water Research, 38(3): 517-522
http://dx.doi.org/10.1016/j.watres.2003.10.033
PMid:14723919
Huang F., Guo Z.Y., and Xu Z., 2007, Determined methods of chlorophyll from Lemma paucicostata, Shiyan Jishu Yu Guanli (Experimental Technology and Management), 24(5): 29-31 (黄帆, 郭正元, 徐珍, 2007, 测定浮萍叶绿素含量的方法研究, 实验技术与管理, 24(5): 29-31)
Li D.X., Guo Y.X., Yun H.Y., Zhang M., Gong X.Y., and Mu F., 2005, Determined methods of chlorophyll from maize, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 21(6): 153-155 (李德孝, 郭月霞, 员海燕, 张敏, 龚小燕, 穆芳, 2005, 玉米叶绿素含量测定方法研究, 中国农学通报, 21(6): 153-155)
Li D.X., Yun H.Y., Guo Y.X., Mu F., Gong X.Y., and Zhang M., 2006, Mixture solution soaking extraction efficiencies of chlorophyll from maize, Yumi Kexue (Journal of Maize Science), 14(1): 117-119 (李德孝, 员海燕, 郭月霞, 穆芳, 龚小燕, 张敏, 2006, 混合液浸提法测定玉米叶绿素含量的研究, 玉米科学, 14(1): 117-119)
Lichtenthaler H.K., Gitelson A., and Lang M., 1996, Non-destructive determination of chlorophyll content of leaves of a green and aurea mutant of tobacco by reflectance measurements, Journal of Plant Physiology, 148(3-4): 483-493
Mackinney G., 1941, Absorption of light by chlorophyll solutions, The Journal of Biological Chemistry, 140: 315-322
Shu Z., Zhang X.S., Chen J., Chen G.Y., and Xu D.Q., 2010, The simplification of chlorophyll content measurement, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 46(4): 399-402 (舒展, 张晓素, 陈娟, 陈根云, 许大全, 2010, 叶绿素含量测定的简化, 植物生理学通讯, 46(4): 399-402)
Sun J.B., and Wang J.X., 2010, Study on method for determination of chlorophyll in cherry leaves, Shanxi Nongye Kexue (Journal of Shanxi Agricultural Sciences), 38(3): 18-9, 33 (孙俊宝, 王建新, 2010, 樱桃叶绿素含量测定方法研究, 山西农业科学, 38(3): 18-19, 33)
Wang W.J., He H.S., Guan Y., Li W.X., Zhang Z.H., and Zu Y.G., 2009, Methodological comparison of chlorophyll and carotenoids contents of plant species measured by DMSO and acetone-extraction methods, Zhiwu Yanjiu (Bulletin of Botanical Research), 29(2): 224-229 (王文杰, 贺海升, 关宇, 李文馨, 张衷华, 祖元刚, 2009, 丙酮和二甲基亚砜法测定植物叶绿素和类胡萝卜素的方法学比较, 植物研究, 29(2): 224-229)
Xu G.R., Liu J.M., Yan G.H., Li M.J., He X., and Xu X.J., 2010, Quantification methods of chlorophyll from Juglans regia L. f. luodianense, Shandi Nongye Shengwu Xuebao (Journal of Mountain Agriculture and Biology), 29(5): 419-423 (徐国瑞, 刘济明, 闫国华, 李敏进, 何绪, 徐雪娇, 2010, 罗甸小米核桃叶绿素含量测定方法研究, 山地农业生物学报, 29(5): 419-423)
Yoshida E., Nakamura A., and Watanabe T., 2003, Reversed-phase HPLC determination of chlorophyll a and naphthoqinones in photosystem I of red algae: Existence of two menaquinone-4 molecules in photosystem I of Cyanidium caldarium, Analytical Sciences, 19(7): 1001-1005
http://dx.doi.org/10.2116/analsci.19.1001
PMid:12880082