2.上海师范大学生命与环境科学学院, 上海, 200234
3.中国科学院上海生命科学院植物生理生态研究所, 上海, 200032
 作者
作者  通讯作者
通讯作者
基因组学与应用生物学, 2011 年, 第 30 卷, 第 44 篇 doi: 10.5376/gab.cn.2011.30.0044
收稿日期: 2011年08月02日 接受日期: 2011年08月22日 发表日期: 2011年09月01日
引用格式(中文):
张建辉等, 2011,一个新的水稻类病斑突变体的鉴定及其基因分子定位,基因组学与应用生物学(online), Vol.30 No.44 pp.1284-1289 (doi: 10.5376/gab.cn.2011.30.0044)
引用格式(英文):
Zhang et al., 2011, Identification and molecular mapping of a novel lesion mimic mutant in rice (Oryza sativa), Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), Vol.30 No.44 pp.1284-1289 (doi: 10.5376/gab.cn.2011.30.0044)
在经60Coγ射线辐射的粳稻品种嘉花1号的突变体库中,筛选出一个环境敏感的营养生长阶段起始表达的类病斑突变体,暂命名为lmt (lesion mimic trait)。台盼蓝染色检测结果表明lmt类病斑的形成和发展是一个细胞程序化死亡的过程。遗传分析表明,该突变性状由1对隐性核基因控制。利用SSR和InDel分子标记对类病斑突变体lmt与籼稻9311杂交得到的F2群体进行基因定位,并把lmt基因定位在第10号染色体长臂端,位于标记MM1992和ID19004之间,遗传距离分别为0.4 cM和0.9 cM。本研究进一步为该基因的克隆及功能的分析奠定了基础,将有利于加深对水稻类病斑发生分子机理的理解。
植物类病斑突变体(lesion mimic mutant)是指植物在没有受到明显逆境、病原物侵害、物理或化学损伤时,在叶片上自发形成病斑的一类突变体(Hu et al., 1996)。根据植物病斑形成方式的不同,类病变可分为起始型和扩散型两类,起始型是指植物自发和随机地在叶片或植株中形成特定大小的坏死斑;扩散型又称蔓延型,是指叶片中一旦出现某一点的细胞坏死便会很快扩散到整个叶片,甚至茎秆或整个植株(Dietrich et al., 1997)。根据突变性状对环境因素的敏感程度,类病变可分为环境敏感型和环境钝感型;根据突变性状的发育进程,类病变还可分为全生育期型、营养生长阶段起始型和生殖生长阶段起始型(Wang et al., 2004)。类病斑的发生多与植物细胞程序性死亡、抗病生理过程、转基因、光信号等相关因子转导途径及活性氧与自由基的代谢活动等紧密相关(Balagué et al., 2003; Jabs et al., 1996; Jambunathan et al., 2001; Mittler and Rizhsky, 2000)。类病斑突变体广泛存在于各种植物中,拟南芥(Dietrich et al., 1994)、大麦(Buschges et al., 1997)、玉米(Gray et al., 1997)、花生(Badigannavar et al., 2002)、高粱(Mall et al., 2011)、烟草(Malamy et al., 1990)和大豆(Kosslak et al., 1997)等植物中均有报道。目前为止,在水稻中已经发现了40多个类病斑突变体(http://www.gramene.org/)。第一个克隆的水稻类病斑基因Spl7编码一个热应激转录因子,该基因功能缺失导致植物在环境胁迫(如高温)下细胞死亡(Yamanouchi et al., 2002)。Qiao等(2010)通过图位克隆方法分离了一个编码网格蛋白相关衔接蛋白复合物1介导亚基的水稻类病变基因Spl28。最近,Ma等(2011)报道了一个水稻类病条纹斑突变体lms1,并定位在第6号染色体400 kb内,有趣的是2010年韩国学者在该区域内克隆了一个炭疽黄绿斑马叶突变体基因zn,发现zn编码一个功能缺陷的类囊体结合蛋白,可能导致叶绿体发育过程失去保护,叶片积累了大量的活性氧,进而产生坏疽状病斑(Li et al., 2010)。类病斑基因的克隆为阐明类病斑形成的复杂分子机理提供了理论基础,同时对了解植物细胞程序性死亡以及植物抗病反应机理也具有重要意义。
本研究以新发现的一个水稻类病斑突变体为材料,对该突变体的生理、遗传特征和主要农艺性状进行了研究分析,并对该突变基因进行初步分子定位,以期为将来该基因的克隆、类病斑产生机理及基因功能研究提供理论依据。
1结果与分析
1.1突变体的表型特征
突变体植株苗期表型与野生型一致,上海(2010年)和海南(2009年)两地都没有出现类病斑。插秧后,随着水稻的快速生长,海南试验田突变体叶片开始出现大量黄褐色类病斑,病斑的数量随着叶片的生长快速增加,单个病斑的面积也在不断变大;至成熟期,除稻穗外,病斑遍布整个植株而成红褐色(图1-C、D);而上海试验田中突变体表型比较温和,病斑数量较少,单个病斑面积较小,即便是拔节期也只有较老叶片布满病斑(图1-A、B),显示突变体的类病斑性状表达易受环境影响,由此推测lmt是一个环境敏感型的营养生长阶段起始表达的类病斑突变体。
1.2突变体主要农艺性状
与野生型嘉花1号比,除穗长差异不大之外,突变体lmt的一些农艺性状发生显著变化,株高和千粒重分别下降5.78%和20.80%(表1)。
1.3 类病斑叶片发生细胞程序性死亡
台盼蓝染色是检测细胞死亡和细胞膜完整性的一种重要的组织学方法。图2中突变体lmt叶片有大量的淡蓝色小点,还有若干个大的深蓝色斑块,说明突变体叶片中有大量的细胞死亡,并在形成一些新的可见的类病斑。而野生型叶片虽然也有一些淡蓝色的小点,这可能是叶片发育过程中自然死亡的细胞。由此表明突变体类病斑的形成是一个细胞程序化死亡的过程。
1.4突变体性状的遗传分析
无论以lmt突变体为父本还是母本,与籼稻9311杂交F1代的表型均为正常野生型,表明该突变体为隐性核基因突变。对其杂交后代F2群体进行调查发现,正常表型植株(821株)和突变植株(239株)的比例符合3:1分离(χ2=3.27<χ0.052=3.84),表明lmt的类病斑性状由1对隐性核基因控制。
1.5 lmt基因定位
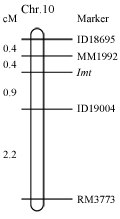
利用均匀分布在水稻12条染色体上的176对微卫星分子标记(SSR),对突变体lmt和杂交亲本9311进行多态性分析,在两个亲本间共发现有68对SSR引物存在多态性。然后,选取lmt突变体与9311的杂交后代中的21株突变型F2植株作为初定位群体进行扩增,发现突变基因lmt与第10号染色体上的分子标记RM3773连锁 (图3)。然后,利用新开发的插入缺失(Indel)标记(表2)以及来自9311与lmt杂交的239株突变表型F2植株作为精细定位群体,最终将lmt基因定位于分子标记MM1992和ID19004之间,其遗传距离分别为0.4 cM和0.9 cM (图4)。
2讨论
水稻全基因组测序的完成和微卫星分子标记数据库的公布以及新一代分子标记的开发,极大的方便了水稻分子生物学的研究,加速了水稻突变体的基因定位和克隆。本研究中,通过图位克隆将lmt的突变基因定位于第10染色体长臂的SSR标记MM1992和InDel标记ID19004之间,其遗传距离分别为0.4 cM和0.9 cM。目前,水稻第10号染色体上已经报道的类病变基因有2个(http://www.shigen.nig.ac.jp/rice/oryzabase/genes/traitGeneClasses.jsp),spl10和spl18,其中spl10位于第10号染色体25 cM附近(Ideta et al., 1993),该突变体分蘖期在整个叶片表现出细条斑和淡黄褐色斑块,同时对稻瘟病和白叶枯病的抗性增强(Mizobuchi et al., 2002),其表型明显不同于lmt的突变体,而spl18突变体是一个T-DNA插入突变体,基因定位在第10号染色体短臂,Spl18编码一个酰基转移酶类似蛋白,该基因过表达导致植株类病斑的产生和白叶枯病抗性增强(Mori et al., 2007)。由上述可知,定位在第10号染色体长臂上的lmt突变基因均不同于spl10和spl18基因,应该是一个新的水稻类病斑相关基因。
本研究的lmt突变体在苗期没有病斑,直到生长旺盛的分蘖期才出现病斑,表明该突变体是营养生长阶段起始型;突变体在海南种植时表型明显比上海种植时严重(图1),表明突变体的表型受环境因素的影响,因此是环境敏感型;同时台盼蓝染色显示深蓝色斑点呈散发状(图2),表明叶片细胞的死亡是随机分布的,因此突变体lmt的突变类型属于起始型。接下来,我们将对不同环境条件(光照、温度和湿度等)lmt突变体的表型进行详细的观察,以探明该突变体表型对环境的响应;同时,鉴于很多类病斑突变体能够不同程度的提高自身的抗病性,我们也将对lmt突变体的抗病性进行研究;目前,我们正在本文的基础上扩大作图群体,在定位区间内开发新的分子标记,以期为该突变基因的克隆、基因功能及类病斑发生机制的研究提供理论基础。
3材料和方法
3.1材料
以上海地区主栽粳稻(Oryza sativa subsp. keng)嘉花1号作为诱变材料,经60Co γ射线辐射处理后得到一个类病斑突变体,经多代自交其突变性状已稳定遗传,该突变体暂命名为lmt(lesion mimic trait)。
3.2突变体的表型观察
将突变体lmt及其野生型亲本嘉花1号种植在浙江省农业科学院海南陵水实验基地(2009年)和上海师范大学植物园试验田(2010年),从苗期始,观察它们的表型,重点观察类病斑出现的时期,病斑的大小、颜色及分布情况等。
3.3突变体农艺性状调查
海南陵水试验田生长的突变体及其野生型嘉花1号水稻植株成熟后,分别调查其株高、穗长和千粒重等农艺性状,试验重复3次。
3.4台盼蓝染色法检测突变体叶片的死亡细胞
2010年在上海取水稻拔节期有类病斑表型的突变体叶片以及野生型相应位置的叶片,参照Mou等(Mou et al., 2000)的方法进行叶片台盼蓝染色。具体过程,叶片浸泡在台盼蓝染液(30 ml乙醇,10 g苯酚,10 ml水,10 ml甘油,10 ml乳酸和10 mg台盼蓝)中,沸水浴2-3分钟,室温放置2 h后用2.5 mg/ml的水合氯醛(90 ml水,10 ml甘油,250 mg水合氯醛)中脱色2-3次,放在50%甘油中保存。使用体式镜(Olympus SZ2-1LST)观察突变体和野生型叶片中细胞死亡情况并用佳能数码相机(Canon PC1200 digital camera)拍照。
3.5 定位群体的构建
2009年8月在上海试验田内,分别以突变体lmt为父本和母本,与籼稻9311杂交。同年冬季在海南陵水基地种植F1代,观察表型。获得F2代群体,2010年将F2代群体在上海师范大学植物园中种植,统计其性状分离情况,并选取有突变表型的植株作为定位群体。
3.6 水稻叶片DNA的提取
采用CTAB法(Murray and Thompson, 1980) 提取亲本及F2遗传群体水稻植株的基因组DNA。
3.7 基因定位
以lmt和9311杂交后代F2中突变表型植株作为定位群体,利用Gramene (http://www.gramene.org/)和浙江大学沃森基因组科学研究院(www.dnaresearch.oxfordjournals.org/)公布的SSR引物以及自行设计的 InDel分子标记进行基因定位。引物由上海生工生物工程有限公司合成,PCR 反应体系参照Panaud等(Panaud et al., 1996)的方法,反应条件为:94℃预变性4 min,94℃变性30s,55℃退火30 s,72℃延伸30 s,35个循环;72℃再延伸7 min,反应产物用2.0 %~4.0%琼脂糖凝胶电泳,利用 UVP凝胶成像仪观察电泳结果。
3.8 连锁分析
根据分子标记的电泳结果,利用软件MAPMA KER/ EXP 3. 0 (Lincoln et al., 1992)进行连锁分析和遗传作图。
作者贡献
通讯作者董彦君和滕胜负责本研究的实验设计及安排,第一作者张建辉负责论文整个实验的具体实施及分析,其他作者均参与了本实验的研究工作。
致谢
本研究由国家自然科学基金(30970246, 30971552),上海市科委项目(09DJ1400505, 0939191200和10DZ2271800)以及上海市教委项目(J50401)对本研究的资助。感谢两位匿名的同行评审人的评审意见和修改建议。
参考文献
Badigannavar A., Kale D., Eapen S., and Murty G., 2002, Inheritance of disease lesion mimic leaf trait in groundnut, Journal of Heredity, 93(1): 50-52
http://dx.doi.org/10.1093/jhered/93.1.50
PMid:12011176
Balagué C., Lin B., Alcon C., Flottes G., Malmstr m S., K hler C., Neuhaus G., Pelletier G., Gaymard F., and Roby D., 2003, HLM1, an essential signaling component in the hypersensitive response, is a member of the cyclic nucleotide-gated channel ion channel family, The Plant Cell, 15(2): 365-379
http://dx.doi.org/10.1105/tpc.006999
PMCid:141207
Buschges R., Hollricher K., Panstruga R., Simons G., Wolter M., Frijters A., van Daelen R., van der Lee T., Diergaarde P., and Groenendijk J., 1997, The barley Mlo gene: a novel control element of plant pathogen resistance, Cell, 88(5): 695-705
http://dx.doi.org/10.1016/S0092-8674(00)81912-1
Dietrich R.A., Delaney T.P., Uknes S.J., Ward E.R., Ryals J.A., and Dangl J.L., 1994, Arabidopsis mutants simulating disease resistance response, Cell, 77(4): 565-577
http://dx.doi.org/10.1016/0092-8674(94)90218-6
Dietrich R.A., Richberg M.H., Schmidt R., Dean C., and Dangl J.L., 1997, A novel zinc finger protein is encoded by the Arabidopsis LSD1 gene and functions as a negative regulator of plant cell death, Cell, 88(5): 685-694
http://dx.doi.org/10.1016/S0092-8674(00)81911-X
Gray J., Close P.S., Briggs S.P., and Johal G.S., 1997, A novel suppressor of cell death in plants encoded by the Lls1 gene of maize, Cell, 89(1): 25-31
http://dx.doi.org/10.1016/S0092-8674(00)80179-8
Hu G., Richter T.E., Hulbert S.H., and Pryor T., 1996, Disease lesion mimicry caused by mutations in the rust resistance gene rp1, The Plant Cell, 8(8): 1367-1376
http://dx.doi.org/10.2307/3870307
PMid:12239417 PMCid:161256
http://dx.doi.org/10.1105/tpc.8.8.1367
PMid:12239417
Ideta O., Yoshimura A., Matsumoto T., Tsunematsu H., Satoh H., and Iwata N., 1993, Integration of conventional and RFLP linkage maps in rice. II. Chromosomes 6, 9, 10 and 11, Rice Genet. Newsl, 10: 87-89
Jabs T., Dietrich R.A., and Dangl J.L., 1996, Initiation of runaway cell death in an Arabidopsis mutant by extracellular superoxide, Science, 273(5283): 1853-1856
http://dx.doi.org/10.1126/science.273.5283.1853
PMid:8791589
Jambunathan N., Siani J.M., and McNellis T.W., 2001, A humidity-sensitive Arabidopsis copine mutant exhibits precocious cell death and increased disease resistance, The Plant Cell, 13(10): 2225-2240
http://dx.doi.org/10.2307/3871504
PMid:11595798 PMCid:139155
http://dx.doi.org/10.1105/tpc.13.10.2225
Kosslak R.M., Chamberlin M.A., Palmer R.G., and Bowen B.A., 1997, Programmed cell death in the root cortex of soybean root necrosis mutants, The Plant Journal, 11(4): 729-745
http://dx.doi.org/10.1046/j.1365-313X.1997.11040729.x
PMid:9161033
Li J., Pandeya D., Nath K., Zulfugarov I.S., Yoo S.C., Zhang H., Yoo J.H., Cho S.H., Koh H.J., and Kim D.S., 2010, ZEBRA-NECROSIS, a thylakoid-bound protein, is critical for the photoprotection of developing chloroplasts during early leaf development, The Plant Journal, 62(4): 713-725
http://dx.doi.org/10.1111/j.1365-313X.2010.04183.x
PMid:20202171
Lincoln S., Daly M., and Lander E., 1992, Constructing genetics maps with MAPMAKER/EXP3. 0, Whitehead Institute Technical Report, Cambridge, Massachusetts
Ma J.Y., Chen S.L., Zhang J.H., Dong Y.J., and Teng S., 2011, Identification and genetic mapping of a lesion mimic stripe mutant in rice, Zhongguo Shuidao Kexue (Chinese Journal of Rice Science), 25(2): 150-156 (马健阳, 陈孙禄, 张建辉, 董彦君, 滕胜, 2011, 一个水稻类病条纹斑突变体的鉴定和遗传定位, 中国水稻科学, 25(2): 150-156)
Malamy J., Carr J.P., Klessig D.F., and Raskin I., 1990, Salicylic acid: a likely endogenous signal in the resistance response of tobacco to viral infection, Science, 250(4983): 1002-1004
http://dx.doi.org/10.1126/science.250.4983.1002
PMid:17746925
Mall T.K., Dweikat I., Sato S.J., Neresian N., Xu K., Ge Z., Wang D., Elthon T., and Clemente T., 2011, Expression of the rice CDPK-7 in sorghum: molecular and phenotypic analyses, Plant Molecular Biology: 1-13
Mittler R., and Rizhsky L., 2000, Transgene-induced lesion mimic, Plant Molecular Biology, 44(3): 335-344
http://dx.doi.org/10.1023/A:1026544625898
PMid:11199392
Mizobuchi R., Hirabayashi H., Kaji R., Nishizawa Y., Yoshimura A., Satoh H., Ogawa T., and Okamoto M., 2002, Isolation and characterization of rice lesion-mimic mutants with enhanced resistance to rice blast and bacterial blight, Plant Science, 163(2): 345-353
http://dx.doi.org/10.1016/S0168-9452(02)00134-6
Mori M., Tomita C., Sugimoto K., Hasegawa M., Hayashi N., Dubouzet J.G., Ochiai H., Sekimoto H., Hirochika H., and Kikuchi S., 2007, Isolation and molecular characterization of a Spotted leaf 18 mutant by modified activation-tagging in rice, Plant Molecular Biology, 63(6): 847-860
http://dx.doi.org/10.1007/s11103-006-9130-y
PMid:17273822
Mou Z., He Y., Dai Y., Liu X., and Li J., 2000, Deficiency in fatty acid synthase leads to premature cell death and dramatic alterations in plant morphology, The Plant Cell, 12(3): 405-418
http://dx.doi.org/10.2307/3870945
PMid:10715326 PMCid:139840
http://dx.doi.org/10.1105/tpc.12.3.405
Murray M.G., and Thompson W.F., 1980, Rapid isolation of high molecular weight plant DNA, Nucleic Acids Research, 8(19): 4321-4325
http://dx.doi.org/10.1093/nar/8.19.4321
PMid:7433111 PMCid:324241
Panaud O., Chen X., and McCouch S., 1996, Development of microsatellite markers and characterization of simple sequence length polymorphism (SSLP) in rice (Oryza sativa L.), Molecular and General Genetics MGG, 252(5): 597-607
http://dx.doi.org/10.1007/s004380050267
http://dx.doi.org/10.1007/BF02172406
Qiao Y., Jiang W., Lee J.H., Park B.S., Choi M.S., Piao R., Woo M.O., Roh J.H., Han L., and Paek N.C., 2010, SPL28 encodes a clathrin-associated adaptor protein complex 1, medium subunit μ1 (AP1M1) and is responsible for spotted leaf and early senescence in rice (Oryza sativa), New Phytologist, 185(1): 258-274
http://dx.doi.org/10.1111/j.1469-8137.2009.03047.x
PMid:19825016
Wang J.J., Zhu X.D., Wang L.Y., Zhang L.H., Xue Q.Z., and He Z.H., 2004, Physiological and genetic analysis of lesion resembling disease mutants (lrd) of Oryza sativa L., Zhiwu Shengli Yu Fenzi Shengwuxue Xuebao (Journal of Plant Physiology and Molecular Biology), 30(3): 331-338 (王建军, 朱旭东, 王林东, 张利华, 薛庆中, 何祖华, 2004, 水稻类病斑突变体的生理和遗传分析, 植物生理与分子生物学学报, 30(3): 331-338)
Yamanouchi U., Yano M., Lin H., Ashikari M., and Yamada K., 2002, A rice spotted leaf gene, Spl7, encodes a heat stress transcription factor protein, Proceedings of the National Academy of Sciences, 99(11): 7530-7535
http://dx.doi.org/10.1073/pnas.112209199
PMid:12032317 PMCid:124274
.png)