2仲恺农业工程学院生命科学学院, 广州, 510225;
3华南农业大学生命科学学院, 广州, 510642
 作者
作者  通讯作者
通讯作者
计算分子生物学, 2013 年, 第 2 卷, 第 2 篇
收稿日期: 2013年02月21日 接受日期: 2013年02月21日 发表日期: 2013年02月21日
引用格式(中文):
杨加伟, 周玲艳, 庄楚雄, 2013, 水稻 Osε-cop1 基因的原核表达及多克隆抗体制备, 基因组学与应用生物学, 32(4): 497-502
引用格式(英文):
Yang J.W., Zhou L.Y., and Zhuang C.X., 2013, Prokaryotic Expression and Polyclonal Antibody Preparation of Osε-cop1 in Rice (Oryza sativa L.), Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 32(4): 497-502
ε-COP 蛋白是真核生物分泌途径中 COPⅠ有被小泡的一个亚基。本研究利用 PCR 技术扩增水稻 ε-cop 基因(Osε-cop1)的 ORF(开放阅读框),并克隆到原核表达载体 pET-23d 上,将表达载体 pET-Osε-cop1 转入大肠杆菌 BL21 (DE3),以 1.0 mmol/L 的 IPTG (isopropyl β-D-thiogalactoside)诱导表达重组蛋白,然后以 重组蛋白作为抗原免疫家兔,制备多克隆抗体。SDS-PAGE 电泳分析结果表明,成功诱导表达了分子量约为 35 kD 的重组蛋白,Western blot 检测表明,免疫家兔的抗血清与水稻幼穗总蛋白杂交信号较好。Osε-COP1 抗体的制备有助于研究该基因及 COPI 小泡在水稻中的功能。
膜泡运输是介导真核细胞蛋白质分泌途径的主 要方式(Gerdes, 2008)。到目前为止,已经成功鉴定出三种运输小泡:网格蛋白有被小泡,COPⅠ有被小泡和 COPⅡ有被小泡(Kirchhausen, 2000)。其中,COPⅠ 有被小泡出芽于顺面高尔基体网络结构,主要涉及高尔基体内部以及高尔基体与内质网之间的逆向蛋 白运输,同时还可影响从内质网至高尔基体间的顺 向蛋白运输过程(Hsu and Yang, 2009)。COPⅠ有被小泡的外被含有 8 个亚基,为一个 ARF 和七个 COP 蛋白:α-COP、β-COP、β'-COP、γ-COP、δ-COP、ε-COP 和 ζ-COP (Waters et al., 1991)。七个 COP 蛋白按等分子比例在胞浆中以复合体的形式存在,称为外被体 (coatomer),分子量为 650~700 kD (Waters et al., 1991; Eugster et al., 2000)。
利用脉冲追踪和免疫共沉淀的方法发现体内coatomer的形成是一个有序的过程,ε-COP 是最后一个组装上去的亚基(Lowe and Kreis, 1996; Hara-kuge et al., 1994)。该蛋白有一个保守功能域TPR,典型的结构含有 34 个氨基酸残基,其一致序列为 [WLF]-X(2)- [LIM]-[GAS]-X (2)-[YLF]-X(8)-[ASE]-X (3)-[FYL]-X (2)- [ASL]-X (4)-[PKE]。该结构域广泛存在于细菌、真菌、植物及高等动物中,主要用来与 WD40 重复结构域相互作用(Hsia and Hoelz, 2010)。在酵母中的研究显示,该亚基可与 α-COP 特异性互作,维持α-COP及 coatomer 的稳定。适宜温度条件下(34℃),ε-COP的缺失不会对酵母的生长带来明显的影响。但是,将缺乏ε-COP的酵母转移至 37℃培养时, α-COP 蛋白发生降解,其它六个亚基形成的复合体也发生解聚,酵母无法生长(Duden et al., 1998)。此外, 在中国仓鼠卵巢(CHO)细胞中的研究也发现 α- COP 突变会导致细胞条件性致死(Guo et al., 1996)。由此可见,该基因对细胞的生长发育起着重要的作用。
尽管在酵母和动物细胞中,关于 COPⅠ小泡及其各亚基的结构与功能的研究很多(Spang, 2002; Beck et al., 2009),但是,COPⅠ在植物中的研究却相当少。 而且,关于 ε-COP 在植物中的生物学功能更是未见 报导。本研究利用 PCR 扩增得到水稻 ε-cop 基因的 ORF (开放阅读框),构建该基因的原核表达载体后导入大肠杆菌,表达重组蛋白,纯化重组蛋白后免疫家兔制备了水稻 ε-COP 蛋白的多克隆抗体,为将来研 究水稻 ε-COP 蛋白及 COPⅠ有被小泡的表达特征与功能打下基础。
1 结果与分析
1.1 Osε-COP1 蛋白抗原表位分析
搜索 NCBI 水稻基因数据库,发现一个编码 COP Ⅰ 运 输 小 泡 ε-COP 亚基的基因序列 (NM_ 001060595.1),命名为 Osε-cop1。该基因 ORF 长度为894 bp,编码一个含 297 个氨基酸的蛋白,预测其分子质量为 32 kD。利用 DNAStar 软件对该蛋白序列 进行抗原表位分析,结果显示(图1),Osε-CO P1 蛋 白从 N 端至 C 末端均匀分布着多个潜在的抗原表位位点,可能的抗原表位区很多且很分散,如:36~50 aa、 88~110 aa、156~169 aa 等。因此,本研究下一步将通过原核表达该基因全长作为抗原免疫家兔制备多克隆抗体。
|
图1 Osε-COP1 蛋白抗原表位分析 |
1.2 Osε-cop1 基因扩增与表达载体构建
对 Osε-cop1 基因序列分析发现其 5' 端 GC 含 量较高,直接以水稻幼穗 cDNA 为模板扩增 ORF 未 能得到条带。故先从 5' UTR 和 3' 末端设计引物对 Osε-cop1-1F 和 Osε-cop1-1R,扩增得到 900 bp 左 右的片段(图2A),连接 T 载体,酶切鉴定正确(图2B) 后送 Invitrogen 公司测序。测序正确后,利用引物 Osε-cop1-2F 和 Osε-cop1-2R,以此载体为模板扩增 Osε-cop1 基因 ORF (图3A),将目的片段克隆到原核 表达载体 pET-23d 中,酶切鉴定(图3B)正确后,将重 组质粒转化到表达菌株 BL21 (DE3)中。
|
图2 Osε-cop1 扩增及 pMD-18T-Osε-cop1 重组载体的构建 |
1.3 Osε-COP 重组蛋白的原核表达
取 pET-23d 重组表达菌株划板,挑单菌落摇菌培养至 OD550 为 0.5~0.6,分别在加 IPTG 诱导前和诱导后 1 h、2 h、3 h 时取菌液 1 mL,超声波破碎后进行 SDS-PAGE 电泳检测。结果显示(图4),和诱导前相 比,含有重组质粒的菌株在诱导 1 h 时就能看到明显 的重组蛋白条带,大小为 35 kD 左右,与理论值相符。该蛋白在诱导 3 h 时就能达到很高的表达量,故后续实验均以 IPTG 诱导 3 h 来获得目的蛋白。将 IPTG 诱导 3 h 后表达的重组蛋白使用 Ni-NTA 纯化 备用,纯化方法参见文献(周玲艳等, 2012)。
|
图3表达载体 pET-Osε-cop1 的构建 |
|
图4 Osε-COP 蛋白的原核表达 |
1.4 Osε-COP1 多克隆抗体的制备与 Western blot检测
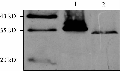
将纯化后的蛋白免疫家兔制备抗体,在第 3 次注射家兔一周后,小量取血并收集抗血清,Western blot 验证抗体是否制备成功。分别将含重组子菌株诱导后的总蛋白和水稻幼穗总蛋白进行 SDS-PAGE 电泳,抗血清按 1:2 000 稀释比例进行 Western-blot 分 析。结果显示(图5),在水稻幼穗蛋白中检测到了约 30 kD 大小的条带。细菌中的重组蛋白由于带有其 N 末端和 C 末端均带有标签,故检测到了约 35 kD 大小的蛋白,这些结果表明抗体制备成功。此外,免疫印迹图片未见明显的杂带,表明抗体特异性较好。
|
图5 Osε-COP1 多克隆抗体的 Western blot 检测 |
2 讨论
随着基因工程技术的发展,利用各种宿主系统来 大量表达重组蛋白已被广泛应用(Frandsen and Ghan-dehari, 2012; Young et al., 2012)。目前,用于表达重组蛋白的外源系统主要有大肠杆菌表达系统、酵母表达系统及动物细胞表达系统(Waegeman et al., 2011; Bo-nander et al., 2012; Chen, 2012; Cox, 2012; Mat-tanovich et al., 2012)。其中,大肠杆菌由于结构简单, 遗传背景清楚,基因表达调控机制明确,以及外源蛋白表达量高等优点,成为现阶段最常用的表达宿主(谢磊等, 2004; Waegeman and Soetaert, 2011; Chen, 2012)。pET 系统是在大肠杆菌中表达重组蛋白的最强大系统。该系统中目标基因被克隆到不为大肠杆菌 RNA 聚合酶识别的 T7 启动子下游,在加入诱导剂前几乎没有表达,而在诱导后几小时目标产物就可超过细胞总蛋白的 50% (Hoffman et al., 1997; Pan and Malcolm, 2000)。同时,本研究选用的 pET-23d 载 体表达的重组蛋白 C 端带有六聚组氨酸标签,由于该标签与 Ni2+ 有很高的亲和性,因此可方便的使用 Ni2+ 亲和层析柱对重组蛋白进行纯化(周玲艳等, 2012)。
在构建原核表达载体时,设计 PCR 引物应注意 表达载体上起始密码子 ATG 的位置,须保证插入的 外源片段 ORF 与载体的编码框架正确对应,否则易 产生移码,表达出错误的蛋白甚至导致翻译提前终 止。本研究用的 pET-23d 载体上的起始密码子 ATG 与所用的 5' 酶切位点 BamH Ⅰ间隔碱基数目并不是 3 的倍数,而是多出了一个碱基“C”,因此设计上游 引物时,去掉了原基因 ORF 的第一个碱基“A”。为利 用 C 端的 His tag 纯化重组蛋白,下游引物序列去掉 了基因的终止密码子。此外,由于 Osε-cop1 ORF 的 5' 端由于 GC 含量较高,设计引物直接从 cDNA 中扩增未能得到目的 ORF 片段(结果未显示),因此,选 择 从 基 因 的 5' UTR 区设计引物扩增后克隆到 pMD-18T 载体上,再以此为模板,获得了完整的 Osε-cop1 ORF 区。
尽管在动物细胞和酵母中,ε-COP 蛋白的结构和 功能已基本了解(Hsu and Yang, 2009; Beck et al., 2009), 但该蛋白在植物中的表达模式及生物学功能未见报导。制备抗体是研究基因在翻译水平的表达特性、蛋白-蛋白互作以及蛋白质功能的基础。利用重组蛋白免疫家兔制备多克隆抗体由于方法成熟、过程简单、制备周期短,因此被广泛应用(谭才邓等, 2009; 赵芹等, 2011; 周玲艳等, 2012)。本研究利用此方法制备的 Osε-COP 多克隆抗体效价为 1:2 000,效价高且特异性强,印迹背景清晰。在本研究室的前期工作中,已经利用 RNA 干涉技术下调表达了水稻中 Osε-cop1 基因的表达,并观察到了一定的表型变化(未发表数据)。因此,Osε-COP 多克隆抗体的制备为进一步研究 Osε-COP 蛋白在水稻中蛋白质运输过程中的作用下了基础。
3 材料与方法
3.1 材料
3.1.1 动物材料
广东省实验动物中心提供普通级雄性新西兰 兔,体重 2 kg 左右。
3.1.2 植物材料
本研究所用的水稻(Oryza sativa L.)品种中花 11由华南农业大学遗传工程实验室保存。
3.1.3 原核表达载体与菌株
表达载体 pET-23d 于 Novagen 公司购买;克隆载 体 pMD-18T 购买于 TaKaRa 公司;大肠杆菌表达菌 株 BL21 (DE3)由华南农业大学遗传工程实验室保存。
3.1.4 引物序列
引物序列见表1。
|
表1引物序列 |
3.2 方法
3.2.1Osε-cop1 生物信息学分析
Osε-cop1 核酸序列 GC 含量分析使用 DNAStar Editseq 软件,Osε-COP1 蛋白抗原表位分析采用软件 DNAStar Protean 软件。
3.2.2 原核表达载体 pET-Osε-cop1 的构建
先从 Osε-cop1 序列的 5' UTR 和 3' 端设计引物 对 Osε-cop1-1F 和 Osε-cop1-1R, 以中花 11 幼穗 cDNA 为模板进行 PCR 扩增得到目的片段,连接 T 载体,送 Invitrogen 公司测序正确后,设计原核表达 的引物 Osε-cop1-2F 和 Osε-cop1-2R,以 T 载体为模板扩增 Osε-cop1 基因 ORF。用 BamH Ⅰ和 Xho Ⅰ 限制性内切酶酶切重组载体,将目的片段克隆到原 核表达载体 pET-23d 中,重组载体构建图示如图6, 提取阳性克隆的质粒转化大肠菌株 BL21(DE3)进行蛋白表达。
|
图6原核表达载体构建示意图 |
3.2.3 Osε-COP1 重组蛋白的原核表达
重组蛋白的诱导方法参见文献(谭才邓等, 2009; 张晓茹等, 2011)并进行适当改进。取 pET-23d 重组表达菌株,于含氨苄青霉素钠(Amp)的 LB 平板划线,37℃ 培养过夜(约 16 h)后挑取单菌落于2 mL LB 液体培养基(100 μg/mL Amp),37℃摇床培养过夜(约 12 h)。取0.4 mL 菌液于 10 mL LB 培养基中(100 μg/mL Amp),37℃,200 r/min 培养至 OD550 为 0.5~0.6 (约 3~4 h)时, 取 1 mL 菌液作为对照备用 。 加 IPTG (isopropyl β-D-thiogalactoside)至终浓度为 1.0 mmol/L,分别在 加入 IPTG 1 h、2 h、3 h 后取菌液 1 mL。离心菌液收集菌体后悬浮于 200 μL ddH2O 中,超声波破碎后,取 20 μL 样品加入 2×SDS (sodium dodecyl sulfate)样品缓冲液,100℃加热 5 min 后,聚丙烯酰胺凝胶电泳检测重组蛋白的表达情况。
3.2.4 Osε-COP1 多克隆抗体制备
利用重组蛋白 C 末端的 His tag 进行重组蛋白的纯化,纯化程序参见文献(周玲艳等, 2012)。取约含 1 mg 左右纯化的重组蛋白溶液加等体积的弗氏完全佐剂进行乳化,乳化好的匀浆于皮下多点注射家兔。 10 d 后,取约 0.5 mg 左右重组蛋白与等体积的弗氏 不完全佐剂乳化进行第二次注射,7 d 后用同样剂量的重组蛋白进行第 3 次注射,间隔 7 d 后小量取血进 行 Western blot 检测,同时进行第 4 次注射,第 4 次 注射 10 d 后大量采血收集抗血清,分装后 -80℃保 存待用。
3.2.5 多克隆抗体的 Western blot 检测
取约 0.3 g 水稻中花 11 幼穗,加入 1 mL 的蛋白提取液研磨后,12 000 r/min 离心 12 min,吸取上清备用。取 30 μL 蛋白与等体积 2×SDS 样品缓冲液混匀,100 ℃处理 5 min,将处理后的蛋白样品点入上样孔,60 V 左右电泳,当样品进入分离胶(约 0.5 h)后将电压调至 10 V 左右,当溴酚蓝跑至胶底部时停止电泳。剪与凝胶大小等同的硝酸纤维膜和 4 块滤纸,在 转移缓冲液中按照从负极到正极的顺序进行以下组装:海绵垫-滤纸-凝胶-硝酸纤维膜-滤纸-海绵垫,注意要赶走气泡,然后夹紧置于电转仪中,添加转移缓冲液,恒流 200 mA 转移 1~2 h。将膜用 TBS 清洗 1 次(5 min),浸入 5%脱脂奶粉(TBS 溶解) 中 37℃封闭 1 h (或 4℃封闭过夜),将膜取出,TBS 清 洗 1 次(5 min);在 5%脱脂奶粉(TBS 溶解)中按照 1: 2 000 的稀释比例加入一抗,放入膜后 37℃缓慢摇动 1 h 后,用 1×TTBS 洗膜 5 次,每次 5 min;在 5% 脱脂奶粉中按照 1:10 000 的稀释比例加入二抗(辣根 过氧化物酶标记的羊抗兔 IgG),放入膜后 37℃缓慢摇动 1 h 后,用 1×TTBS 洗膜 5 次,每次 5 min;最后 用 1×TBS 洗膜 15 min;将洗好的膜加入 CST 化学发光试剂进行发光,在暗室中压胶片,最后将胶片依次置于显影液和定影液中,胶片干燥后照相。
作者贡献
杨加伟为本研究的主要执行人,负责大部分实验内容的操作,数据整理及论文撰写;周玲艳负责重组蛋白纯化及论文修改;庄楚雄为本文通讯作者,负责实验设计和论文审核。
致谢
本研究由广东省自然科学基金项目(S20110400 01653)资助。
Beck R., Rawet M., Wieland F.T., and Cassel D., 2009, The COPⅠ system, molecular mechanisms and function, FEBS Lett., 583 (17): 2701-2709
Bonander N., and Bill R.M., 2012, Optimising yeast as a host for recombinant protein production, Methods Mol. Biol., 866: 1-9
Chen R., 2012, Bacterial expression systems for recombinant pro- tein production: E. coli and beyond, Biotechnol. Adv., 30(5): 1102-1107
Cox M.M., 2012, Recombinant protein vaccines produced in in- sect cells, Vaccine, 30(10): 1759-1766
Duden R., Kajikawa L., Wuestehube L., and Schekman R., 1998, Epsilon-COP is a structural component of coatomer that functions to stabilize α-COP, EMBO J., 17(4): 985-995
Eugster A., Frigerio G., Dale M., and Duden R., 2000, COP Ⅰ do- mains required for coatomer integrity, and novel interactions with ARF and ARF-GAP, EMBO J., 19(15): 3905-3017
Frandsen J.L., and Ghandehari H., 2012, Recombinant pro- tein-based polymers for advanced drug delivery, Chem. Soc. Rev., 41(7): 2696-2706
Gerdes H.H., 2008, Membrane traffic in the secretory pathway, Cell Mol. Life Sci., 65(18): 2779-2780
Guo Q., Penman M., Trigatti B.L., and Krieger M., 1996, A sin- gle point mutation in epsilon-COP results in tempera- ture-sensitive, lethal defects in membrane transport in a Chi- nese hamster ovary cell mutant, J. Biol. Chem., 271 (19): 11191-11196
Hara-Kuge S., Kuge O., Orci L., Amherdt M., Ravazzola M., Wieland F. T., and Rothman J., 1994, En bloc incorporation of coatomer subunits during the assembly of COP-coated vesicles, J. Cell Biol., 124(6): 883-892
Hoffman S.K., Susani M., Ferreira F., Jertschin P., Ahorn H., Steiner R., Kraft D., Scheiner O., and Breiteneder H., 1997, High-level expression and purification of the major birch pollen allergen, Bet v1, Protein Expr. Purif., 9(1): 33-39
Hsia K.C., and Hoelz A., 2010, Crystal structure of α-COP in complex with epsilon-COP provides insight into the archi- tecture of the COP Ⅰ vesicular coat, PNAS, 107 (25): 11271-11276
Hsu V.W., and Yang J.S., 2009, Mechanisms of COPⅠ vesicle formation, FEBS Lett., 583(23): 3758-3763
Kirchhausen T., 2000, Three ways to make a vesicle, Nat. Rev. Mol. Cell Biol., 1(3): 187-198
Lowe M., and Kreis T.E., 1996, In vivo assembly of coatomer, the COP-Ⅰcoat precursor, J. Biol. Chem., 271(48): 30725-30730
Mattanovich D., Branduardi P., Dato L., Gasser B., Sauer M., and Porro D., 2012, Recombinant protein production in yeasts, Methods Mol. Biol., 824: 329-358
Pan S.H. and Malcolm B.A., 2000, Reduced background expres- sion and improved plasmid stability with pET vectors in BL21 (DE3), Biotechniques, 29(6): 1234-1238
Spang A., 2002, ARF1 regulatory factors and COPⅠ vesicle for-mation, Curr. Opin. Cell Biol., 14(4): 423-427
Tan C.D., Li J., Li F., and Zhuang C.X., 2009, Prokaryotic expres- sion and polyclonal antibody preparation of rice PDK2, Jiyin-zuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28 (6): 1039-1042 (谭才邓, 李静, 李峰, 庄楚雄, 2009, 水稻 PDK2 基因原核表达和多克隆抗体制备, 基因 组学与应用生物学, 28(6): 1039-1042)
Waegeman H., and Soetaert W., 2011, Increasing recombinant pro- tein production in E. coli through metabolic and genetic engi- neering, J. Ind. Microbiol. Biotechnol., 38(12): 1891-1910
Waters M.G., Serafini T., and Rothman J.E., 1991,“Coatomer”: A cytosolic protein complex containing subunits of non- clathrin-coated golgi transport vesicles, Nature, 349 (6306): 248-251
Xie L., Sun J.B., Zhang S.Q., and Huang J.S., 2004, Research progress in the E. coli expression system, Huanan Redain- ongyedaxue Xuebao (Journal of South China University of Tropical Agriculture), 10(2): 16-19 (谢磊, 孙建波, 张世清, 黄俊生, 2004, 大肠杆菌表达系统及其研究进展, 华南热带 农业大学学报, 10(2): 16-19)
Young C.L., Britton Z.T., and Robinson A.S., 2012, Recombi- nant protein expression and purification: A comprehensive review of affinity tags and microbial applications, Biotech- nol. J., 7(5): 620-634
Zhang X.R., Kuang W.H., Cheng Y., Du L., Zhang D.L., Hao Y. C., Lei M., Jiao H.W., Liu T., Qi C., and Wang F.Y., 2011, Gene cloning and prokaryotic expression of MyD88 cDNA from buffalo, Jiyinzuxue Yu Yingyong Shengwuxue (Ge-nomics and Applied Biology), 30(2): 190-196 (张晓茹, 匡文华, 成鹰, 杜丽, 张冬琳, 郝永昌, 雷明, 焦寒伟, 刘涛, 祁 超, 王凤阳, 2011, 水牛 MyD88 cDNA 的克隆与原核表达, 基因组学与应用生物学, 30(2): 190-196)
Zhao Q., Li H.P., He Z.F., She X.M., Xie D.S., He X.M., and Peng Q.W., 2011, Prokaryotic expression and antiserum preparation of AC2 gene of tomato yellow leaf curl Guang-dong virus G3 isolate, Huanan Nongyedaxue Xuebao (Jour- nal of South China Agricultural University), 32(4): 53-56 (赵 芹, 李华平, 何自福, 佘小曼, 谢大森, 何晓明, 彭庆务, 2011, 广东番茄黄化曲叶病毒 AC2 基因的原核表达及抗 血清制备, 华南农业大学学报, 32(4): 53-56)
Zhou L.Y., Qin H.M., Zhou H., Yang J.W., and Zhuang C.X., 2012, Prokaryotic expression and polyclonal antibody preparation of wax gene OsCER4 in rice, Zhongkai Nongye Gongcheng Xueyuan Xuebao (Journal of Zhongkai Univer-sity of Agriculture and Engineering), 25(1): 11-15 (周玲艳, 秦华明, 周 海 , 杨 家 伟 , 庄 楚 雄 , 2012, 水 稻 蜡 质 基 因 OsCER4 的原核表达及多克隆抗体制备, 仲恺农业工程学 院学报, 25(1): 11-15)
.gif)
.gif)
.gif)