2高原山地动物遗传育种与繁殖省部共建教育部重点实验室, 贵州大学动物科学学院, 贵阳, 550025
 作者
作者  通讯作者
通讯作者
计算分子生物学, 2013 年, 第 2 卷, 第 4 篇
收稿日期: 2013年04月21日 接受日期: 2013年04月21日 发表日期: 2013年04月21日
引用格式(中文):
李飞, 许厚强, 陈伟, 陈祥, 刘敏, 桓聪聪, 2013, 关岭牛MyoDⅠ基因启动子报告质粒的构建及活性验证, 基因组学与应用生物学, 32(4): 459-466
引用格式(英文):
Li F., Xu H.Q., Chen W., Chen X., Liu M., and Huan C.C., 2013, Verification of Activity and Construction of the Report Plasmid of MyoDⅠGene Promoter in Guanling Cattle, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 32(4): 459-466
为了克隆关岭牛 MyoDⅠ基因启动子并验证其启动活性,根据 GenBank 中牛的 MyoDⅠ基因序列设计 PCR 引物,用 PCR 技术扩增牛 MyoDⅠ基因的启动子,构建重组克隆载体 pUCmT-MyoDⅠ;并通过 PCR 扩增、 限制性酶切、测序及生物信息学分析对阳性克隆进行鉴定;构建报告质粒 pGL3-MyoDⅠ,并将其转染小鼠 C2C12、3T3-L1 细胞系,检测其 24 h 后的双荧光素酶活性。实验结果获得了关岭牛 MyoDⅠ基因启动子,其序列 长度为 993 bp,并成功构建了 MyoDⅠ启动子报告质粒;双荧光素酶活性检测表明 pGL3-MyoDⅠ在小鼠 C2C12 细胞中的表达是 pGL3 空载体 40.65 倍,在小鼠 3T3-L1 细胞中的表达是空载体的 1.13 倍,MyoDⅠ启动子在小 鼠 C2C12 细胞中的表达高于 3T3-L1 细胞(** p<0.01)。结果表明关岭牛 MyoDⅠ基因启动子具有启动活性,在小 鼠骨骼肌细胞中特异性表达。
MRFs 家族由 MRF4、MyF5、MyoG 和 MyoD Ⅰ组成,它们是控制骨骼肌生成的关键调节因子,共同控制肌肉的生成,MyoD Ⅰ (myogenic differentiationⅠ)基因便是其中之一(杨明娟和陈宏, 2010)。研究表明,这些肌肉特异性转录因子与肌肉生长和肉质有着密切的关系。肌分化因子 MyoD 原名为 MyoD Ⅰ,1987 年首次被克隆。MyoD Ⅰ是在骨骼肌生成和再生时表达的一个转化因子,调节肌肉特异基因表达。近年来,它成为动物肉质改良育种的重要研究部分(黄萌等, 2007)。 赵金红等(2008)在我国地方黄牛 MyoD Ⅰ第 1外显子上发现了新的等位基因。目前,在国内外,该基因在小鼠、鸡和猪的肌细胞生成的表达调控机制方面研究较多,在牛上已有一些研究,包括遗传变异及功能研究等,但主要集中在转录后和翻译水平,MyoD Ⅰ基因转录调控的分子机制尚不清楚(李永平和梁炳生, 2007)。 贵州关岭牛,体质结实,肢蹄强健,行动灵活,耐劳、耐 旱、耐粗饲、适应性强等特性显著,是广大农户乐于饲养的地方牛品种,关岭牛是一个适宜山区耕作和放牧,有较好的挽力和产肉性能,数量多,商品率高的地方品种,但是目前存在着繁殖率低、个体小、体重轻等问题(罗启华和王安娜, 2011)。
因此,本研究克隆了关岭牛 MyoD Ⅰ基因启动子区,并对该启动子进行了生物信息学分析,根据分析结果,构建启动子 PGL3-MyoD Ⅰ表达载体,通过瞬时转染小鼠成肌细胞和小鼠胚胎成纤维细胞,检测启动的活性及骨骼肌特异性,以期为牛产肉性状及牛 MyoD Ⅰ基因表达与调控等方面的研究提供理论依据。
1结果与分析
1.1 PCR 扩增关岭牛 MyoDⅠ基因的启动子并对其酶切鉴定
PCR 得到的片段长约 993 bp,与预期扩增片段长度一致,图1;图2所示,扩增到约 993 bp 的片段,表明重组质粒中插入的目的序列正确。酶切后得到了长约为 993 bp 的特异目的条带与大小约 2 773 bp 的载体片段,表明目的序列正确插入载体并且插入方向正确,重组质粒构建成功,见图3。
|
图1 MyoD Ⅰ基因启动子 PCR 扩增产物电泳结果 |
|
图2重组质粒 pUCm-T-MyoD Ⅰ的 PCR 扩增 |
|
图3重组质粒 pUCm-T-MyoD Ⅰ的双酶切鉴定(Kpn Ⅰ; Xho Ⅰ) |
1.2重组克隆载体 pGL3-Basic-MyoDⅠ的构建及鉴定
经 PCR 和双酶切、测序鉴定,成功完成 pGL3-Ba- sic-MyoD Ⅰ重组体的构建。图4结果显示重组真核表达质粒 pGL3-Basic-MyoD Ⅰ大小约 5 811 bp,说明目的片段正确插入真核表达载体 pGL3-Basic 中,提取质粒正确,重组质粒构建成功。图5结果表明,用重组质 粒 pGL3-Basic-MyoD Ⅰ作为模板进行 PCR 后,片段大小约 993 bp 与目的片段大小相符,说明目的片段正确插入真核表达载体 pGL3-Basic 中。图6的结果表 明 , 用酶 Xho Ⅰ 和 Kpn Ⅰ 对重组质粒 pGL3-Ba- sic-MyoD Ⅰ进行酶切后,得到约为 993 bp 目的片段与约 4 818 bp 的载体片段,说明目的片段正确插入真核表达载体 pGL3-Basic 中并且插入方向正确,重组质粒构建成功。
|
图4重组质粒 pGL3-Basic-MyoD Ⅰ |
|
图5重组质粒 pGL3-Basic-MyoD Ⅰ为模板的 PCR 扩增 |
|
图6重组质粒 pGL3-Basic-MyoD Ⅰ的双酶切鉴定(Kpn Ⅰ; Xho Ⅰ) |
1.3重组真核质粒 pGL3-Basic-MyoD Ⅰ转染小鼠 C2C12、3T3-L1 细胞双荧光素酶活性检测结果
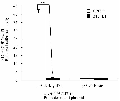
由图7可见,将 pGL3-Basic、PRL-TK 和 pGL-3-MyoD Ⅰ、PRL-TK 分别转入小鼠 C2C12 细胞系,24 h 后裂解细胞液进行双荧光素酶活性检测,pGL3-MyoD Ⅰ 在小鼠 C2C12 细胞系中其 M1/M2 的比值是 pGL3-Basic 空载体的 40.65 倍,说明具有启动活性, 在 小鼠 3T3-L1 细胞系其 M1/M2 的比值 为 pGL3-Basic 空载体的 1.13 倍。方差分析结果显示 pGL3-MyoD Ⅰ小鼠 C2C12 细胞系中表达极显著于在小鼠 3T3-L1 细胞系中的表达(** p<0.01),说明克隆得到的 MyoD Ⅰ启动子片段具有启动活性,并且在骨骼肌中特异性表达。
|
图7 pGL3-Basic, pGL3-MyoDⅠ转染 C2C12 3T3-L1 细胞双荧光素酶活性检测结果柱的高度和钉型标记代 |
1.4 MyoDⅠ启动子测序序列生物学分析
1.4.1测序结果及转录因子结合位点分析
经过验证正确的质粒送往生工生物公司进行测序,测序结果使用 TFSEARCH 程序对转录因子结合位点进行分析,结果显示在转录起始位点上游的-35~-20 bp 处存在顺式作用元件 TATA box,-84~ -71 bp 处存在 GC box。转录起始位点 A 用黑色底纹表示,转录起始位点上游还分别存在 AP1、AP2、AP4、 SP1、HSF、MEF2、NF1、GATA-1、GATA-3、SRF 等转录因子结合位点(图8)。
|
图8 MyoDⅠ启动子序列转录因子结合位点分析 |
1.4.2关岭牛 MyoDⅠ启动子序列的相似性比对及构建分子系统进化树
对关岭牛 MyoDⅠ启动子序列进行 BLAST 分析,发现其(855~993)序列部分与绵羊、野猪、白犀牛和 虎鲸该部分序列的相似性分别为 98%、91%、90%和 89%。表明此序列在不同物种之间具有一定的保守性,见图9。
将上述分析结果用 Clustal X 软件建立系统进化树,可见牛科动物关岭牛首先与牛科羊亚科的绵羊聚 为一类,亲缘关系最近,两者一起再与猪科动物野猪 共同聚在偶蹄目的分支上,三者与奇蹄目白犀牛、鲸 目虎鲸并列成三支,见图10。
|
图9关岭牛 MyoDⅠ启动子序列与绵羊, 野猪, 白犀牛和虎鲸相应序列的 Clustal X 比对结果 |
|
图10关岭牛 MyoDⅠ启动子的系统进化树分析 |
2讨论
脊椎动物肌肉组织中的肌纤维在胚胎期已经形成,出生后数目不再改变。肌肉的生长主要依赖肌卫星细胞的增殖分化而导致肌纤维长度增加和周径增粗。牛的肌纤维数量取决于胚胎发育的 70 d (高琴雪等, 2005; 王珊等, 2006)。在肌肉特异基因转录调控中,MyoDⅠ起着总开关的作用,可以结合到肌细胞生成素(myogenin)、肌酸激酶 CK、肌球蛋白、结蛋白等基因启动子区发挥重要调控作用,促进它们的转录激活。MyoDⅠ缺失可导致成肌细胞的增殖和分化无法进行(Alves et al., 2003)。相反,MyoDⅠ基因的过度表达会抑制成肌细胞的增殖过程,并促进成肌细胞分化形成成熟的肌纤维细胞。此外,MyoDⅠ基因还会通过影响 MyoG 基因的活性来间接影响肌细胞的终端分化过程(Bhuiyan et al., 2009)。MyoDⅠ介导的肌分化机制作为研究细胞分化的最佳模型,已成为当前众多学者研究的焦点,尤为重要(李永平和梁炳生, 2007)。
pGL3-Basic 作为一种常用的报告载体,因其结构中无启动子和增强子,故可通过检测荧光素酶报告基因的表达来定量检测所插入片段的启动活性,并且比较启动子的强弱和骨骼肌特异性(朱丹丹等, 2011)。
本实验成功构建了 pGL3-MyoDⅠ报告基因载体, 转入小鼠 C2C12、3T3-L1 细胞系,双荧光素酶活性检测结果显示 pGL3-MyoDⅠ在小鼠 C2C12 细胞系中表达极显著于在小鼠 3T3-L1 细胞系中的表达(** p<0.01),证明关岭牛 MyoDⅠ启动子为骨骼肌特异性启动子。
很多肌肉特异性基因都由 TEFl、SRF 和 MEF2 等转录因子进行调控(Maeda et al., 2002; 王秋华等, 2012), 使用 TFSEARCH 程序对 MyoDⅠ启动子转录因子结合位点进行分析,显示MyoDⅠ启动子区含有上述这些转录因子的多个调控结合位点,进一步说明关岭牛 MyoDⅠ启动子具有骨骼肌特异性,这一结果与转染小鼠 C2C12、3T3-L1 细胞系进行双荧光素酶报告基因检测得到的结果相符。其中转录因子家族中的肌细胞增强因子 2 (MEF-2)被认为是几乎所有肌肉特异性基因的保守元件(Dodou et al., 2003; Miano, 2003; Hennebry et al., 2009; Jung and Ko, 2010; 王秋华等, 2012; Bryant-sev et al., 2012),血清反应因子(SRF)可独立的或与表达因子结合来调节肌肉特异性基因的表达(Camoret-ti-Mereado et al., 2003; Biressi et al., 2008)。转录因子 NF1 和肌动蛋白参加了由 RNA 聚合酶Ⅱ介导的基因转录活动(赵丽辉等,2006)。可能正是因为存在这些肌肉特异性表达调控因子,关岭牛MyoDⅠ启动子才能在小鼠 C2C12 细胞系中特异表达。关岭牛 MyoDⅠ启动子序列与绵羊、野猪、白犀牛和虎鲸相应序列的Clustal X 比对结果表明该部分序列在这几个物种具有较高的保守性,可能这部分保守序列是 MyoDⅠ启动子的核心启动子区域。对上述的 5 个物种 MyoDⅠ基因启动子以构建系统进化树,结果发现牛科动物关岭牛MyoDⅠ启动子序列与牛科羊亚科的绵羊最为接近,其次是猪科野猪、奇蹄目白犀牛、鲸目虎鲸,整个 MyoDⅠ基因的进化符合物种进化的途径,在进化上并没受自然选择的影响而有较大的变异。
本研究为牛 MyoDⅠ基因的表达调控以及牛产肉性状的研究提供了重要的资料和依据,对通过转基因培育高产优质肉牛有重要意义,为下一步构建 MyoDⅠ基因启动子的亚克隆报告基因载体,在小鼠的 C2C12 细胞系中分不同区段对启动子序列进行活性分析,确定其核心启动子元件奠定了基础。
3材料与方法
3.1材料
3.1.1 血样
本实验室所保存的从贵州省安顺市西秀区幺铺镇屠宰场所采之关岭牛血样。
3.1.2实验中所用试剂
2×Taq PCR MasterMix、Taq DNA Polymerase、限制性内切酶 XhoⅠ、Kpn Ⅰ均购自 TaKaRa 公司;DNA 凝胶纯化试剂从上海物工程有限公司购买;pUCm-T 载 体 、 PGL3-Basic 载 体 、 E. coli DH5α、 T4 DNA 连 接 酶 和 X-gal 购 自 TaKaRa 公 司 ;C2C12、3T3-L1 细胞系购自中科院上海细胞库;其他的试剂均为国产的分析纯。
3.1.3引物
依据 GenBank 中公布的牛 MyoDⅠ基因序列(Genbank 中 ID: 281938),用 FIRSTEF 程序(http://rulai.cshl.org/tools/FirstEF/)进行启动子预测,软件分析显示-798~+121 段含有 SPI 结合位点等许多个重要的 TFBS,可能该区域具有启动活性。因为软件预测是数理统计,而在真核生物中,基因转录调节区可能远离启动子达几百甚至上千 bp,相对较大,因此,最终选定-976~+17 段作为含有最大启动子活性的片段。另外,结合软件相预测的结果,用 Primer 5 软件设计特异性引物,见表1,引物由上海生物工程有限公司合成,预
期扩增长度为 993 bp。
|
表1用于 PCR 扩增的引物信息 |
3.1.4仪器
PCR 仪(BIO-RAD C1000 TouchTM)、凝胶成像系 统(BIO-RAD ChemiDocTM)、细胞培养箱(thermo)、电泳仪(BIO-RAD)、全温震荡培养箱(太华 HZQ-F160)、 显微操作系统(尼康)、-80 超低温冰箱(thermo Ult13 86)、Ultrospec2100Pro 紫外分光光度计(JE healthcare)、 超净工作台(苏州净化设备 SW-CG-1F)、多功能酶标仪(Bio-Tek Synergy HT)、超高速台式落地冷冻离心机(Thermo)。
3.2牛基因组 DNA 的提取
用上海生物工程有限公司的血液基因组 DNA 提 取试剂盒从关岭牛血样中提取基因组 DNA。
3.3牛 MyoDⅠ基因启动子序列 PCR 扩增
反应体系:取 0.5 mL PCR 管,加入基因组 DNA 100 ng,10 pmol/L 的上、下游引物各 1 μL,2×Taq PCR Master Mix 10 μL,灭菌 ddH2O 补至 20 μL。扩增条件: 94℃预变性 5 min,1 个循环;94℃变性 30 s、56℃复性30 s、72℃延伸 60 s,30 个循环;72℃延伸 10 min,1 个循环;4℃保存。反应结束后,用 1.2%琼脂糖凝胶进行电泳分析扩增产物。
3.4构建重组载体 pUCm-T-MyoDⅠ启动子
将 pUCm-T 载体与胶回收试剂盒回收的 PCR 产 物连接,连接体系 10 μL:10×Buffer 1 μL,pUCm-T vector 1 μL,PCR product 3 μL,T4 DNA ligase (3 U/μL) 1 μL,PEG4000 1 μL,灭菌 ddH2O 补足体系。反应条件:16℃连接过夜。取连接产物 5 μL转化 E. coli DH5α 菌株,转化产物在 Amp 和 X-gal、IPTG 的 LB 平板培养基中培养,在 37℃恒温培养箱中培养 12 h 后,挑取白色单菌落于含 Amp 的 LB 液体培养基中培养,以 37℃,200 r/min 摇菌 12 h。使用碱裂解法抽提质粒。
3.5鉴定 pUCm-T-MyoDⅠ-pro 重组子
3.5.1使用 PCR 方式鉴定
阳性 pUCm-T-MyoDⅠ-pro 作模板,引物同表1, PCR 方法同 3.3。用 1.2%琼脂糖凝胶对扩增产物进行 电泳分析。
3.5.2双酶切鉴定
用限制性内切酶 Kpn Ⅰ和 Xho Ⅰ进行双酶切鉴定。 反应体系为 10 μL,包括 pUCm-T-MyoDⅠ-pro 0.5 μg, Kpn Ⅰ 1 μL,10×Buffer 1 μL,Xho Ⅰ 1μL,ddH2O 补足 反应体系。37℃反应 4 h,电泳分析反应液。
3.6对 pUCm-T-MyoDⅠ-pro 进行测序
将 pUCm-T-MyoDⅠ启动子送至上海生物工程公司测序 (测序试剂为 BigDyeterminator v3.1, 测序仪为测序仪器为 ABI-PRISM3730)。
3.7重组克隆载体 pGL3-Basic-MyoDⅠ启动子的构建
(1)用限制性内切酶 Kpn Ⅰ和 Xho Ⅰ将 pUCm- T-MyoDⅠ启动子进行双酶切。方法同 3.5.2,1.2%琼脂糖凝胶电泳回收 MyoDⅠ启动子目的条带。
(2)用限制性内切酶 Kpn Ⅰ和 Xho Ⅰ将载体 pGL 3-Basic 进行酶切。方法同(1),使用胶回收试剂盒回 收载体 pGL3-Basic。
(3)重组子 pGL3-Basic-MyoDⅠ启动子的构建 连接方法同 3.4,取连接产物 5 μL 转化 E. coli DH5α 菌株,转化产物在含 Amp 和 IPTG 的 LB 平板 培养基中培养。12 h 后,挑取白色单菌落于含 Amp 的 LB 液体培养基中,37℃,以 200 r/min 摇菌 12 h 进 行培养。用碱裂解法提取质粒。
3.8鉴定重组克隆载体 pGL3-Basic-MyoDⅠ-pro
3.8.1根据 PCR 技术鉴定
模板 DNA 为阳性 pGL3-Basic-MyoDⅠ-pro,引 物为扩增序列时所用引物,PCR 反应方法同 3.3。扩增 产物用 1.2%琼脂糖凝胶进行电泳分析。
3.8.2双酶切鉴定
用限制性内切酶 Kpn Ⅰ和 Xho Ⅰ进行双酶切鉴 定,方法同 3.5.2,并对酶切产物进行 1.2%琼脂糖凝胶 电泳分析。
3.8.3测序鉴定
取阳性重组克隆 pGL3-Basic-MyoDⅠ启动子送 上海生物工程公司测序(测序仪为测序仪器为 ABI-P RISM3730, 测序试剂为 BigDyeterminator v3.1)。
3.9双荧光素酶报告基因检测报告质粒 pGL3-Ba-sic-MyoDⅠ的启动活性
使用胰蛋白酶液消化对数生长期的细胞,按 5× 104/ 孔的密度接种 48 孔板,在 5% CO2 培养箱中 37℃ 环境培养,细胞生长至 80%融合时即可转染。转染前, 弃原培养基,用无血清 1 640 培养基洗涤细胞 1 次,轻轻加入 OPTI-MEM 250 μL/ 孔,再逐滴加入 50 μL 的 DNA-LF2000 复合物,轻摇使混合物与细胞充分的接 触。37℃、5% CO2 培养箱内培养 6 h 后,用含双抗和 20%胎牛血清的 DMEM 培养基替换掉原来培养基,培 养 24 h 后,收集细胞检测双荧光素酶活性,萤火虫荧光素酶激发底物释放的荧光所测值记为 Ml,海肾荧光素 酶激发底物释放的荧光所测值记为 M2,M1 与 M2 的比值即为目的片段的荧光素酶相对活性,对每种质粒设2个重复孔,同一转染实验做 3 次重复(刘凤鸣, 2010)。
3.10对测序结果进行生物信息学分析
将测序结果在 NCBI 数据库中进行 BLAST 分 析,并使用 Clustal X 软件比对关岭牛 MyoDⅠ启动子 与所 BLAST 出物种的相似性,并构建分子系统进化 树,分析物种间的亲缘关系。
作者贡献
李飞、刘敏和桓聪聪负责整个实验实施过程及数据处理;通讯作者许厚强负责文章整体构思和实验设计;陈伟和陈祥对实验实施过程进行指导并整理实验相关的研究资料;全体作者参加了实验样品的采集。
致谢
本研究获得国家转基因生物新品种培育科技重大专项课题《牛组织特异性调控元件克隆和功能验证》 (2011ZX08009-004)、贵州省科技厅农业攻关计划《影响牛脂肪沉积组织特异性调控元件克隆和功能验证》 (黔科 NY 字[2012]3008 号)和贵州大学研究生创新基金(校农科 2012007)项目资助。特此致谢。
Alves H.J., Alvares L.E., Gabriel J.E., and Coutinho L.L., 2003, Influence of the neural tube/notochord complex on MyoD expression and cellular proliferation in chicken embryos, Brazilian Journal of Medical and Biological Research, 36 (2): 191-197
Bhuiyan M.S.A., Kim N.K., Cho Y.M., Yoon D., Kim K.S., Jeon J.T., and Lee J.H., 2009, Identification of SNPs in MyoD gene family and their associations with carcass traits in cat- tle, Livestock Science, 126(3): 292-297
Bryantsev A.L., Baker P.W., Lovato T.L., Jaramillo M.S., and Cripps R.M., 2012, Differential requirements for myocyte enhancer Factor-2 during adult myogenesis in Drosophila, Dev. Biol., 361(2): 191- 207
Biressi S., Messina G., Collombat P., Tagliafico E., Monteverde S., Benedetti L., Cusella-De-Angelis M.G., Mansouri A., Ferrari S., Tajbakhsh S., Broccoli V., and Cossu G., 2008, The homeobox gene Arx is a novel positive regulator of em- bryonic myogenesis, Cell Death and Differentiation, 15: 94-104
Camoretti-Mereado B., Dulin N.O., and Solway J., 2003, Serum response factor function and dysfunction in smooth muscle, Respir. Physiol. Neumbiol., 137(2-3): 223-235
Dodou E., Xu S.M., and Black B.L., 2003, mef2c is activated di-rectly by myogenic basic helix-loop-helix proteins during skeletal muscle development in vivo, Mechanisms of Devel- opment, 120(9): 1021-1032
Gao Q.X., Liu M., Yang Y.Q., and Wang L.Y., 2005, Polymorphism analysis of porcine MyoG gene by PCR-RFLP and its associa- tion with growth traits and fiber number, Zhongguo Shouyi Xuebao (Chinese Journal of Veterinary Science), 25(3): 330-332 (高勤学, 刘梅, 杨月琴, 王林云, 2005, 猪 MyoG 基因的PCR-RFLP 分型及其与生长性能和肌纤维数目的相关性分 析, 中国兽医学报, 25(3): 330-332)
Huang M., Xu S.Z., Zan L.S., Gao X., and Chen J.B., 2007, Poly- morphism with exon 3 of the cattle MyoD Ⅰgene and their frequencies in carcass traits, Zhongguo Xumu Shouyi (China Animal Husbandry and Veterinary), 34(9): 40-43 (黄萌, 许尚忠, 昝林森, 高雪, 陈金宝, 2007, 牛 MyoDⅠ基因遗传变 异及其对胴体性状的影响, 中国畜牧兽医, 34(9): 40- 43)
Hennebry A., Berry C., Siriett V., O'Callaghan P., Chau L., Wat- son T., Sharma M., and Kambadur R., 2009, Myostatin reg- ulates fibertype composition of skeletal muscle by regulating MEF2 and MyoD gene expression, Am. J. Physiol. Cell Physiol., 296(3): C525-C534
Jung S.Y., and Ko Y.G., 2010, TRIM72, a novel negative feedback regulator of myogenesis, is transcriptionally activated by the synergism of MyoD (or myogenin) and MEF2, Bioch em. Bio- phys. Res. Commun., 396(2): 238-245
Li Y.P., and Liang B.S., 2007, The research progress of MyoD muscle formation mechanism, Guoji Gukexue Zazhi (Inter- national Journal of Orthopaedics), 28(1): 37-40 (李永平, 梁炳生, 2007, MyoD 肌形成作用机制研究进展, 国际骨科学 杂志, 28(1): 37-40)
Liu F.M., 2010, Identification of human PDCD4 promoter and the early analysis of its transcription regulation, Thesis for M.S., Shandong University, Supervisor: Zhang L.N., pp.34(刘凤鸣, 2010, 人 PDCD4 启动子的确定及其转录调控的初步研究, 硕士学位论文, 山东大学, 导师: 张利宁, pp.34) Luo Q.H., and Wang A.N., Guizhou Guanling cattle development status and thinking, Caoshi Jiachu (Grass-Feeding Livestock), (4): 15-16 (罗启华, 王安娜, 2011, 贵州关岭牛发展现状与思考, 草食家畜, (4): 15-16)
Maeda T., Gupta M.P., and Stewart A.F., 2002, TEF-1 and MEF2 transcription factors interact to regulate muscle spe- cific promoters, Biochemical and Biophysical Research Communications, 294(4): 791-797
Miano J.M., 2003, Serum response factor: Toggling between dis- parate programs of gene expression, J. Mol. Cell Cardiol., 35(6): 577-593
Wang S., Chen H., and Cai X., Cloning and analysis of the promoter sequence of bovine MyoG gene, Xibei Nonglin Keji Daxue Xuebao (Ziran Kexueban) (Journal of Northwest Sci-Tech U-niversity of Agriculture and Forest (Nature Science Edition)), 34 (8): 12-16 (王珊, 陈宏, 蔡欣, 2006, 牛 MyoG 基因启动子的克隆与序列分析, 西北农林科技大学学报 (自然科学版), 34(8): 12-16)
Wang Q.H., Cao Y.K., Li S.F., Tong H.L., Xing X.Y., Li G.P., and Yan Y.Q., 2012, Cloning and preliminary functional analysis of bovine MyoG promoter, Xumu Shouyi Xuebao (Acta Veterinaria et Zootechnica Sinica), 43(1): 37-43 (王秋 华, 曹允考, 李树峰, 佟慧丽, 兴孝友, 李光鹏, 严云勤, 2012, 牛 MyoG 基因启动子的克隆及功能的初步分析, 畜 牧兽医学报, 43(1): 37-43)
Yang M.J., and Chen H., 2010, Research progress of MRFs gene family in bovine, Zhongguo Nongye Kexue (China Cattle Sci- ence), 36(6): 51-55 (杨明娟, 陈宏, 2010, 牛 MRFs 基因家族研究进展, 中国农业科学, 36(6): 51-55)
Zhao J.H., Huang Y.F., Peng X.W., Wang G.F., Jiang A., and Gao L.F., 2008, PCR-SSCP analysis on partial coding sequence of the MyoD gene in southwestern cattle, Zhongguo Xumu Zazhi (Chinese Journal of Animal Science), 44(23): 1-4 (赵金红, 黄勇富, 彭祥伟, 王高富, 蒋安, 高立芳, 2008, 西南地方品种黄牛 MyoD 基因部分编码序列 PCR-SSCP 分析, 中国畜牧杂志, 44(23): 1-4)
Zhu D.D., Gao X.J., Yan Y.Q., Liu X.F., and Lu L.M., 2011, Screening of bovine skeletal muscle-specific promoter, Zhongguo Xumu Shouyi (China Animal Husbandry and Vet- erinary), 38(3): 95-99 (朱丹丹, 高学军, 严云勤, 刘晓飞, 陆黎敏, 2011, 牛骨骼肌特异性启动子的筛选, 中国畜牧兽医, 38(3): 95-99)
Zhao L.H., Jiang G.Q., Deng G.Z., and Wang L., 2006, Relation of actin with chromosome remodeling complex BAF and tran- scription factor NFl/CTF, Dongbei Shida Xuebao (Ziran Kexue Bao) (Journal of Northeast Normal University (Natu- ral Science Edition), 38(4): 100-105 (赵丽辉, 姜革强, 邓国 忠, 王丽, 2006, 肌动蛋白与染色体改构复合物 BAF 和转 录因子 NF1/CTF 之间的联系, 东北师大学报(自然科学版), 38(4): 100-105)
.gif)
.gif)
.gif)
.gif)
.gif)
.gif)

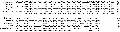
.gif)
.gif)