2杭州师范大学, 医药卫生管理学院, 杭州, 310036;
3新疆地方病与民族高发病省部共建教育部重点实验室, 新疆石河子大学生命科学学院, 石河子, 832002
 作者
作者  通讯作者
通讯作者
癌症与分子诊断研究, 2012 年, 第 1 卷, 第 2 篇 doi: 10.5376/cmdr.cn.2012.01.0002
收稿日期: 2012年04月09日 接受日期: 2012年06月08日 发表日期: 2012年06月18日
引用格式(中文):
尹小菲等, 2012, vMIP-I激活Jurkat细胞抗-HIV基因表达的研究, 癌症与分子诊断研究(online) Vol.1 No.2 pp.7-11 (doi: 10.5376/cmdr.cn.2012.01.0002)
引用格式(英文):
Yi et al., 2012, Study on up-regulated Expressions of Anti-HIV Genes by vMIP-I in Jurkat Cell, Aizheng Yu Fenzi Zhenduan Yanjiu (online) (Cancer and Molecular Diagnosis Research) Vol.1 No.2 pp.7-11(doi: 10.5376/cmdrcn.2012.01.0002)
本研究通过构建真核表达载体pEGFP-N3-vMIP-I,电穿孔法将其转染至Jurkat细胞,荧光定量PCR检测vMIP-I基因对Jurkat细胞内CCL5、APOBEC3G、APOBEC3F、等抗-HIV基因表达水平的影响,从而探讨vMIP-I抗HIV感染的机制。结果显示:成功构建了pEGFP-N3-vMIP-I载体,电穿孔转染效率达到40%左右,与转染空载体组相比,vMIP-I转染组的Jurkat细胞内CCL5、A3G、A3F和MX1分别上调7.37倍、1.58倍、2.42倍和2.06倍。研究结果表明:vMIP-I基因可激活Jurkat细胞内一些抗HIV相关基因的表达,这可能是vMIP-I基因抗HIV感染的机制之一。
获得性免疫缺陷病毒(HIV)和艾滋病(AIDS)的流行已经成为严重威胁人类健康的全球性公共卫生问题。相关研究发现,人体内存在着一系列抗HIV基因,主要包括 APOBEC3G (apolipoprotein B mRNA-editing catalytic polypeptide-3G)、APOBEC3F (apolipoprotein B mRNA-editing catalytic polypeptide-3F)、CCL5 (regulated upon activation, normal T cell expressed and secreted)、MX1 (myxovirus-resistant 1)、MX2 (myxovirus-resistant 2)。这些基因产物能在多个环节抑制HIV-1复制。若能激活宿主体内这些自身免疫基因的表达,将为HIV/AIDS防治提供一种全新的思路。
1卡波氏肉瘤(Kaposi's sarcoma, KS)是艾滋病最常见的并发症之一,卡波氏肉瘤相关疱疹病毒(Kaposi's sarcoma-associated herpesvirus, KSHV)是KS的病因。本课题组前期从事KS的病因学研究,在前期的基因芯片结果中发现KS组织中A3G和CCL5等基因表达上调,提示KSHV感染以及KSHV的某些基因产物可以上调体内这些抗HIV基因的表达。KSHV共有84个ORFs,vMIP-I是由其K6基因编码的一种CC类趋化因子(郑红和朱锡华, 2000, 免疫学杂志, 16(4): 24-27),共编码95个氨基酸,全长288 bp。研究证实vMIP-I具有一定的抑制HIV-1复制的功能(Chang et al., 2005; Chandriani and Ganem, 2007; Cherqui et al., 2007),Moore等(1996)研究认为vMIP-I的瞬时表达能阻断HIV的感染。但Boshoff等(1997)人的研究进一步证实vMIP-I通过阻断HIV与趋化因子受体CCR3、CCR5、CXCR4结合在抗HIV方面的作用不大。Michael等发现vMIP-I可以通过宿主免疫应答来调解Th1/Th2细胞的平衡,它主要能与趋化因子受体CCR8结合发挥受体阻断效应,并指出vMIP-I不能阻断由CCR5介导的HIV感染来发挥抗HIV的作用(Lu et al., 2004)。vMIP-I抑制HIV感染的作用机制尚无定论。vMIP-I是否有可能通过激活宿主抗HIV-1基因表达来抑制HIV感染值得进一步深入研究。
本研究通过构建真核表达载体pEGFP-N3-vMIP-I,电穿孔法将其转染至Jurkat细胞,荧光定量PCR检测vMIP-I基因对Jurkat细胞内CCL5、APOBEC3G、APOBEC3F等抗HIV基因表达水平的影响,从而探讨vMIP-I抗HIV感染的机制。
1结果与分析
1.1目的基因的PCR扩增以及TA克隆
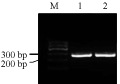
以Cosmid Z6为模板进行PCR扩增,以2.5%琼脂糖凝胶电泳检测PCR产物,结果显示在目的基因片段大小位置出现了特异性的扩增(图1)。XhoⅠ和BamHⅠ双酶切,回收vMIP-I基因全长片段,并将其克隆在pGEM-T easy载体上,从而构建出重组载体pGEM-T easy-vMIP-I,经XhoⅠ和BamHⅠ双酶切电泳鉴定后,出现与预期大小一致的vMIP-I基因片段(图2)。
1.2真核表达载体的双酶切鉴定
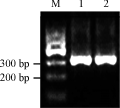
重组质粒pEGFP-N3-vMIP-I经XhoⅠ/BamHⅠ双酶切后,2.5%琼脂糖凝胶跑电泳,可见与预期大小一致的酶切片段(图3)。将该重组质粒送往上海生物工程公司测序,结果显示所克隆的vMIP-I基因序列准确无误,无任何点突变,表明pEGFP-N3-vMIP I真核表达质粒构建成功,可用于下一步的实验。
|
|
1.3转染后的Jurkat细胞荧光蛋白表达观察
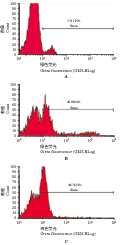
重组质粒pEGFP-N3-vMIP-I 和阴性对照质粒pEGFP-N3转染24 h后在荧光显微镜下观察已有大量的绿色荧光蛋白的表达(图4),经流式细胞仪测定其转染效率均达到40%左右,满足实验要求(图5)。
|
图4 重组质粒转染Jurkat细胞后的荧光显微镜检测图
Figure 4 The fluorescent microscopy diagrams in Jurkat cells transfected with recombinant Plasmids
|
1.4实时定量PCR检测抗HIV基因的表达
重组质粒pEGFP-N3-vMIP-I转染Jurkat细胞后使细胞内抗HIV相关基因的表达有不同程度的上调,其中CCL5、A3G、A3F和MX1分别上调7.37倍、1.58倍、2.42倍和2.06倍,以CCL5的表达上调水平最为明显(图6)。
|
图6 转染vMIP-I后Jurkat细胞中后A3G, A3F, CCL5, MX1和MX2基因的表达水平
Figure 6 Expression levels of A3G, A3F, CCL5, MX1 and MX2 genes in Jurkat cells transfected by vMIP-I
|
2讨论
早期流行病学研究发现并发卡波氏肉瘤的艾滋病患者相对于并发其他疾病的存活时间更长(Dawson and Hardy, 1989)。后来相关研究表明,在KSHV感染的细胞中以及转染KSHV某些基因的细胞中均发现一些ARGs表达的上调:Ganem的研究小组发现KSHV裂解感染期使端粒酶永生化的微血管内皮细胞(telomerase-immortalized microvascular endothelial, TIME)中ISG15,ISG20等多条ARGs表达上调(Chandriani and Ganem, 2007);Yao等(2007)人研究发现KSHV的K15基因使Hela细胞中ISG20等基因表达上调;Cherqui 等(2007)人发现KSHV vMIP-II基因使HUVEC细胞内CCL5、APOBEC3G、ISG-15和OAS-1等多条抗HIV基因表达明显上调。以上均提示KSHV的某些基因能以上调宿主抗HIV 基因表达的方式来抑制HIV的感染。
vMIP-I与vMIP-II同属于CC类趋化因子,它们的氨基酸序列有较高的同源性,与人CC类趋化因子MIP-1α、MIP-1β具有相似结构。趋化因子是一系列结构相似的具有趋化功能的细胞因子,通常为70~90个氨基酸组成的小分子量(8~12 KD)蛋白质,其通过与靶细胞膜上相应的受体结合而发挥其生理功能(Wang and Sun, 2007)。实验研究表明:趋化因子受体作为协同受体,是大多数HIV-1病毒株进入细胞所必须利用的辅助受体,一些共受体或其趋化因子的改变可明显的阻止和延缓HIV的感染或发病(Ye, 2003; 罗燕等, 2010)。Chang 等(1994)人的研究发现KSHV的病毒蛋白vMIP-I和vMIP-II等均有较强的抑制HIV-1复制的功能,但其机制尚不完全清楚。本研究发现,与vMIP-II上调HUVEC细胞中一些抗HIV-1感染基因表达类似,在转染vMIP-I基因36 h后Jurkat细胞内多条抗-HIV基因表达上调,其中以CCL5基因的上调最为明显。
本研究结果提示vMIP-I的抗HIV-1感染除了与已报道的与趋化因子受体结合发挥受体阻断效应来抑制HIV感染的功能外,还能以上调宿主自身抗-HIV基因的表达这条途径来发挥其抑制HIV感染的作用。这将为vMIP-I基因的功能研究和其抑制HIV感染的机制研究提供新的思路。此外,vMIP-I基因能激活宿主体内自身免疫基因的表达,在多个环节抑制HIV-1复制,可能为HIV/AIDS防治提供一种全新的思路。
3材料与方法
3.1菌种、质粒和细胞株
菌株E. coli DH5a、真核表达载体PEGFP-N3、Jurkat细胞均为本实验室保存;含有vMIP-I基因的Cosmid Z6为美国匹兹堡大学的Chang Y教授惠赠。
3.2工具酶及试剂
T4 DNA连接酶,Taq DNA聚合酶为Biolabs公司产品;限制性内切酶限Xho I 和BamH I 为Fermentas公司产品;无内毒素质粒大提试剂盒,总RNA抽提试剂盒及DNA Mark购于北京天根生化科技有限公司;DNA凝胶回收试剂盒购于广州东盛生物有限公司;逆转录试剂盒、实时定量试剂盒购于TaKaRa公司;RPMI-1640培养液购于HyClone公司;胎牛血清购于Gibco公司;引物由上海生物工程有限公司合成,其余常规试剂均为进口或国产分析纯。
3.3目的基因的PCR扩增
根据KSHV K6基因序列设计引物,于引物的5′端分别引入BamH I 及Xho I 限制性内切酶位点。上游引物P1序列:5’-CATCTCGAGATGGCCCCCGTCCACGT-3’ (下划线为Xho I 酶切位点);下游引物P2序列:5’-CATGGATCCCTAAGCTATGGCAGGC-3’ (下划线为BamH I 酶切位点)。扩增产物预期长度为297 bp。
以Cosmid Z6为模板,以P1和P2引物进行扩增。PCR反应总体积为25 μL:2.5 mmol/L dNTPs 2 μL,10×Buffer with MgSO4 2.5 μL,10 μmol/L引物P1,P2各1 μL,Z6模板3 μL,Taq DNA聚合酶0.25 μL,ddH2O 15.25 μL。反应条件:94℃预变性8 min,94℃变性30 s,59℃退火30 s,72℃延伸30 s,热循环35 cycles,最后72℃延伸10 min。2.5%琼脂糖凝胶电泳,电泳条带为扩增目的片段长度,根据DNA凝胶回收试剂盒操作步骤切胶回收PCR产物。
3.4真核表达质粒pEGFP-N3-vMIP-I的构建及鉴定
将上述切胶回收产物与载体pGEM-T easy在T4连接酶的作用下于4℃连接过夜,将连接产物转化大肠杆菌DH5α感受态细胞,并在含有100 μg/mL氨苄青霉素的T-A克隆平板上进行蓝白斑筛选,挑取白色阳性菌落摇菌并抽取质粒,BamH I 和Xho I 双酶切鉴定,将初步鉴定为阳性的质粒送上海生工测序。再用BamH I和Xho I双酶切pGEM-T easy-vMIP-I及pEGFP-N3质粒,回收目的片段并与现行载体连接过夜,构建重组载体pEGFP-N3-vMIP-I。经BamH I 和Xho I 双酶切鉴定后将该质粒送至上海生工测序。
3.5细胞培养
Jurkat细胞复苏后,以含10% FBS的RPMI-1640培养基在37℃、5% CO2及饱和湿度下培养,收集连续培养三代后的细胞用于电穿孔。
3.6电穿孔转染细胞
取对数生长期中期或末期且状态良好的Jurkat细胞,1 000 r/min离心5 min收集细胞,用无血清无抗生素的RPMI-1640培养基重悬细胞至密度为每100 μL 约3×106~4×106个细胞。分别以20 μg重组质粒PEGFP-N3-vMIP-I和20 μg空质粒PEGFP-N3作为实验组和对照组与100 μL细胞悬液混合,各自转移至冰浴的电穿孔杯中,在150 V、22 ms的条件下进行穿孔。电穿孔后立即加入500~900 μL完全培养基,并将电穿孔过的细胞转移到合适的培养器皿中(如6孔板),加入培养基维持细胞继续生长。
3.7荧光显微镜观察和细胞收集
转染后的细胞培养24 h时,在荧光显微镜下大致估计其转染效果,然后取样200 μL以流式细胞仪精确测定其转染效率。转染后培养36 h时,1 000 r/min离心5 min收集细胞用于提取总RNA。
3.8转染后细胞总RNA提取与逆转录PCR
按照细胞总RNA抽提试剂盒的说明进行操作,核酸蛋白仪测定提取到的RNA纯度和浓度。按照反转录试剂盒的说明进行RNA的逆转录,反应条件为:Template RNA 1.0 Ul (≤500 ng),100 μmol/L Random 6mers 0.5 μL,Primerscript RT Enzyme Mix 1 0.5 μL,5×Primerscript buffer 2.0 μL,50 μmol/L Oligo dT Primer 0.5 μL,RNase Free water 5.5 μL,置于37℃ 15 min,85℃ 5 s。逆转录产物可长期保存于-80℃。
3.9实时定量PCR检测抗-HIV相关基因的表达
以实验组和对照组总CDNA为模板,按照实时定量试剂盒的说明进行,反应体积总共为20 μL:cDNA 2 μL,2×SYBR Premix Ex Taq 10 μL,50×ROX Reference Dye 0.4 uL,10 μmol/L Forward Primer (10 μmol/L) 0.4 μL,Reverse Primer (10 μmol/L) 0.4 μL,ddH2O 6.8 μL。样本CDNA依次稀释10倍作为标准品,共6个梯度制作标准曲线。反应条件为:95℃预变性30 s,95℃变性5 s,60℃退火31 s,热循环40 cycles,最95℃ 15 s,60℃ 1 min,95℃ 15 s。用2-△△Ct法,计算基因的相对表达量。每个样本做4个重复,求平均值。待检测基因的引物序列如表1。
|
表1 实时定量PCR的引物
Table 1 Primers of QRT-PCR
|
作者贡献
参考文献
Boshoff C., Endo Y., Collins P.D., Takeuchi Y., Reeves J.D., Schweickart V.L., Siani M.A., Sasaki T., Williams T.J., Gray P.W., Moore P.S., Chang Y., and Weiss R.A., 1997, Angiogenic and HIV-inhibitory functions of KSHV-encoded chemokines, Science, 278(5336):290294
http://dx.doi.org/10.1126/science.278.5336.290 PMid:9323208
Chandriani S., and Ganem D., 2007, Host transcript accumulation during lytic KSHV infection reveals several classes of host responses, PLoS One 2(8): e811
http://dx.doi.org/10.1371/journal.pone.0000811 PMid:17726541 PMCid:1950738
Chang H., Gwack Y., Kingston D., Souvlis J., Liang X., Means R.E., Cesarman E., Hutt-Fletcher L., and Jung J.U., 2005, Activation of CD21 and CD23 gene expression by Kaposi's sarcoma-associated herpesvirus RTA, J Virol, 79(8): 4651-4663 http://dx.doi.org/10.1128/JVI.79.8.4651-4663.2005 PMid:15795251 PMCid:1069543
Chang Y., Cesarman E., Pessin M.S., Lee F., Culpepper J., Knowles D.M., and Moore P.S., 1994, Identification of herpesvirus-like DNA sequences in AIDS-associated Kaposi's sarcoma, Science, 266(5192) 1865-1869
http://dx.doi.org/10.1126/science.7997879 PMid:7997879
Chen B., Tan X.H., Wang X.B., Yin X.F., and Yan L., 2010, Expression of anti-HIV gene in Jurkat cell with Kaposi's sarcoma-associated herpes virus infection, Xiandai Shengwuyixue Jinzhan (Progress in Modern Biomedicine), 10(5): 828-831(陈彬, 谭晓华, 王小波, 尹小菲, 杨磊, 2010, 卡波氏肉瘤相关病毒感染激活Jurkat细胞抗-HIV基因表达的研究, 现代生物医学进展, 10(5): 828-831)
Cherqui S., Kingdon K.M., Thorpe C., Kurian S.M., and Salomon D.R., 2007, Lentiviral gene delivery of vMIP-II to transplanted endothelial cells and endothelial progenitors is proangiogenic in vivo, Mol Ther, 15(7): 12641272
http://dx.doi.org/10.1038/sj.mt.6300183 PMid:17505479
Dawson, D.A., and Hardy A.M., 1989, AIDS knowledge and attitudes of Hispanic Americans: Provisional data from the 1988 National Health Interview Survey, Adv Data, (166): 1-22
Lu M., Suen J., Frias C., Pfeiffer R., Tsai M.H., Chuang E., and Zeichner S.L., 2004, Dissection of the Kaposi's sarcoma-associated herpesvirus gene expression program by using the viral DNA replication inhibitor cidofovir, J Virol, 78(24): 13637-13652
http://dx.doi.org/10.1128/JVI.78.24.13637-13652.2004 PMid:15564474 PMCid:533899
Luo Y., Tan X.H., Di C.H., Cheng J.B., Chen J.H., and Yang L., 2010, The fusion expression and purification on cell permeable peptide pep-1 and viral macrophage inflammatory protein-II, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 29(6): 1026-1032 (罗燕,谭晓华, 狄春红, 程建兵, 陈佳红, 杨磊, 2010, 细胞穿膜肽pep-1与vMIP-II的融合表达与纯化, 基因组学与应用生物学, 29(6): 1026-1032)
Moore P.S., Boshoff C., Weiss R.A., and Chang Y., 1996, Molecular mimicry of human cytokine and cytokine response pathway genes by KSHV, Science, 274(5293): 1739-1744
http://dx.doi.org/10.1126/science.274.5293.1739 PMid:8939871
Wang F., and Sun H.X., 2007, Advances in chemok ines and chemokine receptors about AIDS, Chinese Journal of New Drugs, 16(16): 1243-1246
Yao S., Tang Q., Cheng L., Zeng Y., Chen X., Qin D., Lv Z., and Lu C., 2007, Identification of B cell epitopes at the C-terminus of latency-associated nuclear protein of the kaposi's sarcoma-associated herpesvirus, Acta Virol, 51(2): 109118 PMid: 17 900217
Ye J.T., L.D., 2003, Role of chemokines and their receptors in HIV infection, Journal of Chinese Medicinal Materials, 26(2): 130-134 PMid:12964558
.png)