2海南省热带农业资源研究所, 三亚, 572025
 作者
作者  通讯作者
通讯作者
昆虫分子生物学研究, 2012 年, 第 1 卷, 第 2 篇 doi: 10.5376/imbr.cn.2012.01.0002
收稿日期: 2012年04月26日 接受日期: 2012年07月26日 发表日期: 2012年08月02日
引用格式(中文):
梁照东等, 2012, 对鳞翅目昆虫小菜蛾高毒力的苏云金芽孢杆菌的鉴定, 昆虫分子生物学研究(online) Vol.1 No.2 pp.8-15 (doi: 10.5376/imbr.cn.2012.01.0002)
引用格式(英文):
Liang et al., 2012, Identification of Bacillus thuringiensis Isolates Highly Toxic to Plutella xylostella, Kunchong Fenzi Shengwuxue Yanjiu (online) Vol.1 No.2 pp.8-15 (doi: 10.5376/imbr.cn.2012.01.0002)
本研究利用从黑龙江凉水国家自然保护区的土壤中分离出来的31株Bt野生菌株作为研究菌株,对重要的鳞翅目农业害虫小菜蛾进行高毒力菌株的筛选。经生物活性定性测定,筛选出对小菜蛾活性较高的10株Bt菌株。镜鉴观察表明,这些野生菌株在芽孢形成期均产生对鳞翅目小菜蛾有毒性的菱形晶体伴孢蛋白。cry基因型鉴定表明,这10株菌株均含有cry1类基因。进一步SDS-PAGE分析表明,这10株菌株表达约130 kD的蛋白。对菌株的生长曲线进行分析,发现2~14 h时Bt菌株处于对数生长期,16~30 h时Bt菌株处于稳定期,32 h时Bt菌株进入衰亡期。其中,菌株S2685-1和S2737-3产生大约130 kD的晶体蛋白起始时间分别为培养22小时及20小时,前者到培养26 h时蛋白表达量基本稳定,后者其表达量随时间而逐步增加,到22 h时蛋白的表达量趋于稳定状态。对小菜蛾的半致死浓度(LC50)和半致死时间(LT50)测定显示,S2685-1对小菜蛾的LC50为17.113 ng/mL,LT50为37.343 h;S2737-3对小菜蛾的LC50为25.782 ng/mL,LT50为36.825 h。而标准菌株HD-73对小菜蛾的LC50为15.414 ng/mL,LT50为35.917 h。菌株S2685-1和S2737-3具有较突出的半致死浓度以及半致死时间,两者对小菜蛾有很明显的杀虫活性。从本研究的结果我们认为,Bt菌株S2685-1和S2737-3是两株杀虫活性较为突出,具有一定应用潜力的野生Bt菌株,可望作为标准菌株HD-73的替换菌株,用于作为生产防治鳞翅目害虫的Bt生物农药的出发菌株。
苏云金芽孢杆菌(Bacillus thuringiensis, 简称Bt),是一种应用最广泛的微生物杀虫剂,对许多种类的昆虫都具有毒性活性,其杀虫原理是BT伴孢晶体蛋白(ICPs)经昆虫肠液酶消化成毒素之后引起昆虫死亡(Marco and Porcar, 2012)。由于Bt对环境友好和对人畜等哺乳动物安全,一直受到公众的的关注。
由于Bt菌对昆虫的特异性,因此Bt菌生物杀虫剂存在抗虫谱窄、药效持续性差等,尤其是BT菌株单一的在某些区域长期使用,已经使得某些农业害虫对Bt菌产生了抗性。如已有报道认为小菜蛾对Bt菌产生了抗性(Ferre et al, 1991)。显然,多样化的使用Bt菌株是延缓昆虫抗性的重要方法。因此,从自然界中寻找对靶标昆虫有高毒力的Bt菌株是Bt研究领域的热点。
Bt HD-73是众所周知的对鳞翅目害虫有很高毒杀作用的Bt 模式菌株之一。1985年,Adang等(1985)报道库斯塔克亚种HD-73中发现了一种杀虫晶体蛋白基因cry1Ac,编码蛋白分子量为133 kD。由于cry1Ac编码的杀虫晶体蛋白对鳞翅目农业害虫具有很高的杀虫活性,HD-73菌株成为较为广泛的微生物农药制剂的Bt菌株之一,很多相应的研究也围绕HD-73展开(Wu et al, 2007; Chen et al, 1999)。毫无疑问,菌株单一的长期使用必定会使昆虫对其产生抗性,或者抗性逐渐累积,寻找可替代的菌株或者多样化的菌株联合使用,是避免抗性产生或者延缓抗性累积的重要途径。因此HD-73的对鳞翅目害虫具有高毒力的Bt菌株的工作势在必行。
本研究以黑龙江凉水国家自然保护区分离的31株Bt野生菌株为供试菌株,通过形态观察、生物活性测定、生长曲线分析、SDS-PAGE分析、基因型分析以及生物测定分析,试图鉴定对鳞翅目昆虫具有毒性的Bt菌株,以期提供对鳞翅目昆虫有毒杀作用的多样性替换菌株。
1结果与分析
1.1供试Bt菌株对小菜蛾的生物活性测定
提取供试的31株Bt菌株的菌体蛋白粗提液对小菜蛾进行生物活性测定,删除48 h校正死亡率均低于50%的菌株21株,获得了48 h校正死亡率均在70%~100%之间的10株对小菜蛾活性比较高的菌株,菌株编号分别是S2685-1、S2737-3、S2796-2、S2809-1、S2852-1、S2852-2、S2852-3、S2852-4、S2852-5以及S2853-1 (表1)。初步选定上述10株Bt菌株为后续实验的候选菌株,进行更进一步的生物学特性研究以及生物测定(半致死浓度测定和半致死时间测定)。
|
|
1.2获选Bt菌株的伴胞晶体蛋白观察
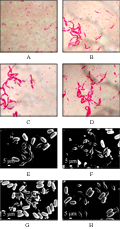
活化10株候选Bt菌株,在1/2LB培养基,30℃,220 r/min的条件下培养,在Bt菌株芽孢形成期,挑取少量菌体,用石碳酸复红染液染色,先在光学显微镜(油镜)下进行观察,在扫描电子显微镜下对菌株进行观察。文中仅列举部分Bt菌株的镜鉴形态。如图1所示,在油镜下观察,获选Bt菌株S2796-2,S2809-1,S2852-2,S2852-3均有白色芽孢及红色的伴孢晶体产生。在电镜下观察,获选Bt菌株S2796-2,S2809-1,S2852-2,S2852-3均有菱形的伴孢晶体产生。
|
|
1.3获选Bt菌株的生长曲线分析
对小菜蛾有杀虫活性的10株获选Bt菌株进行了菌株生长曲线分析(图2)。通过比较,发现10株获选菌株的和标准菌株HD-73在LB培养基中的生长状况基本相似。获选Bt菌株的迟缓期呈现不明显的状态,4~20 h时,Bt菌株快速的生长,进入对数生长期,20~30 h时,Bt菌株进入稳定期,这时的菌液的OD600值约为5.0左右,32 h后进入衰亡期。
|
|
1.4获选的10株Bt菌株晶体蛋白的SDS-PAGE分析
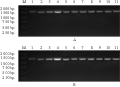
对小菜蛾有杀虫活性的10株Bt菌株,G-Tris培养基,220 r/min,30℃培养4 d后,提取菌株的伴胞晶体蛋白并做SDS-PAGE分析,它们在芽孢形成期产生约为130 kD的杀虫晶体蛋白(图3)。
.png) 图3 10株Bt菌株的伴胞晶体SDS-PAGE电泳图 Figure 3 SDS-PAGE profiles of parasporal crystal proteins of 10 Bt strains during sporulation |
1.5获选Bt菌株的cry基因型分析
10株对小菜蛾有杀虫活性的Bt菌株均表达约130 kD的晶体蛋白,因此,我们推测这些菌株可能含有cry1类晶体蛋白基因型。我们选用两对cry1基因型鉴定通用引物5Kun2/5Kun2和5Kun3/5Kun3,PCR扩增出预期大小的PCR片段,分别为1.6 kb和1.45 kb (图4)。结果证实获选的10株Bt菌株均为cry1基因型。
|
|
1.6获选的10株Bt菌株的半致死浓度和半致死时间的生物测定
我们将已标定浓度的各杀虫蛋白溶液按一定比例进行稀释,分别用无菌水和HD-73蛋白作阴性对照和阳性对照,72 h后统计小菜蛾的死亡情况。利用统计学软件SPSS.19.0进行半致死浓度(LC50)和半致死时间(LT50)分析(表2; 表3)。分析数据发现Bt菌株S2685-1和S2737-3与标准菌株HD-73在杀虫活性上比较接近。
|
表2 10株Bt菌株对小菜蛾幼虫的半致死浓度(LC50)生物测定 Table 2 The probit analysis of LC50 of 10 Bt strains’ toxicity against susceptible Plutella xylostella (Lepidopter) |
|
表3 10株Bt菌株对小菜蛾幼虫的半致死时间(LT50)生物测定 Table 3 The probit analysis of LT50 of 10 Bt strains’ toxicity against susceptible Plutella xylostella (Lepidoptera) |
对半致死浓度(LC50)进行分析:标准菌株HD-73的半致死浓度(LC50)为15.414 ng/mL。S2685-1、S2737-3和HD-73的半致死浓度(LC50)相近。S2685-1对小菜蛾的半致死浓度(LC50)为17.113 ng/mL;S2737-3对小菜蛾的半致死浓度(LC50)为25.782 ng/mL。可见S2685-1和S2737-3在杀虫毒力上比较突出,值得关注与进一步研究。
对半致死时间(LT50)进行分析:标准菌株HD-73的半致死时间(LT50)为35.917 h。S2737-3、S2685-1和标准菌株HD-73的半致死时间(LT50)相近。S2685-1对小菜蛾的半致死时间(LT50)为37.343 h,S2737-3对小菜蛾的半致死时间(LT50)为36.825 h。可见S2685-1和S2737-3在杀虫时间上与HD-73十分接近。
1.7 Bt菌株S2685-1与S2737-3的ICPs随培养时间增长的变化
对Bt菌株S2685-1与S2737-3进行SDS-PAGE分析,观察这两株菌株的ICPs随培养时间的延长而发生的变化(图5)。
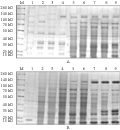 图5 Bt菌株S2685-1和S2737-3的伴孢晶体的SDS-PAGE分析 Figure 5 SDS-PAGE profiles of parasporal crystal proteins of Bt strain S2685-1 and S2737-3 |
如图5A所示,Bt菌株S2685-1从培养后的4 h产生约20 kD的晶体蛋白,其表达量随时间而增加,到22 h后蛋白表达量逐渐稳定;约35 kD的杀虫晶体蛋白从12 h时产生,其表达量随时间而增加,到18 h后基本稳定;约37 kD的杀虫蛋白在28 h时产生,其表达量随时间逐渐增加,直到48 h仍然稳定表达;到22 h后产生约130 kD的晶体蛋白,其表达量随时间而增加,到26 h后基本稳定。如图5B所示,Bt菌株S2737-3从培养后的20 h产生约130 kD的晶体蛋白,其表达量随时间而增加,到22 h后表达量趋于稳定。
2讨论
小菜蛾是一种世界性的蔬菜害虫,其危害广泛。在我国,小菜蛾也属于农田多发性害虫。利用苏云金芽孢杆菌进行小菜蛾的生物防治,由于对人畜安全、对环境友好,深受消费者欢迎,具有广阔的应用前景(Abdel-Razek et al, 2006)。
但是,由于小菜蛾对Bt抗性的累积以及对其高效的Bt生物农药的菌株的单一性,导致小菜蛾对Bt生物农药越来越不敏感,一些高毒力菌株的杀虫活性在逐渐下降(左雅慧等, 2002)。缺少高效有毒菌株仍然是Bt制剂广泛运用于小菜蛾生物防治的制约因素(谭芙蓉等, 2006)。定期轮换使用不同类型的可替代菌株,可以造成选择压力上的不连续性,这将有利于延缓害虫抗性的形成,这对延长苏云金杆菌制剂的使用寿命以及害虫的抗性管理等将是一种行之有效的途径。
本研究初步鉴定出Bt菌株S2685-1和S2737-3对鳞翅目昆虫具有较高杀虫活性的野生菌株,我们认为可以作为生产对鳞翅目昆虫有毒杀作用的生物农药的替换菌株。
3材料与方法
3.1菌株及培养基
本实验利用31株筛选自黑龙江凉水国家自然保护区土壤中的Bt野生型菌株,编号为:S2331-1、S2343-2、S2384-1、S2386-4、S2404-3、S2412-2、S2472-3、S2480-1、S2490-1、S2540-1、S2663-2、S2685-1、S2689-1、S2718-3、S2734-1、S2737-3、S2790-2、S2796-2、S2809-1、S2850-1、S2852-1、S2852-2、S2852-3、S2852-4、S2852-5、S2853-1、S2886-2、S2944-3、S2966-1、S2966-2、S2968-1。实验中LB培养基用于Bt菌株的活化培养,G-Tris培养基用于促进Bt菌株芽孢及伴胞晶体的产生(Aronson and Thompson, 1971)。BP培养基在分析菌株的ICPs随时间的变化时使用(谢柳等, 2009)。Bt菌株在30℃下进行恒温培养。
3.2伴胞晶体显微镜观察
按照Xie等(2010)和Liu等(2011)的实验方法对Bt菌株进行伴胞晶体观察。该实验方法利用石碳酸能够对正处在芽孢期的Bt的细胞进行染色,在光学显微镜(Nikon YS100)的油镜下就可以进行相应的形态观察。
3.3伴胞晶体扫描电镜观察
按照Zhang等(2010)的方法,取部分已经产生了芽孢的Bt菌液,置于EP管中,反复洗涤,悬浮,取2 μL的悬浮液涂抹在干净的载玻片上,锇酸熏蒸,固定到扫描电镜(HITACHI S-3400N)的载物台上,抽真空,重金属染色,观察、拍照。
3.4菌株生长曲线的测定
按照zhang等(2010)的方法菌株活化接种。30℃,230 r/min摇菌,按1%转接LB培养基,30℃,230 r/min振荡培养,每过2 h就取1 mL菌液到离心管中,对照为HD-73,空白对照为LB培养基,测定OD 600 nm的吸光值,当OD值大于0.8时,进行一次稀释。
3.5菌株蛋白的提取以及SDS-PAGE分析
按照Jiang等(2008)的方法,Bt菌株在200 mL的G-Tris培养基中培养96 h,然后8 000 r/min,4℃,离心15 min,再使用1 mol/L Nacl溶液洗涤,洗涤后12 000 r/min,4℃离心10 min,弃上清,收集沉淀,溶于30 mL磷酸缓冲液中,超声波(85 w) (model VC-130, Sonics and Materials Inc, USA)破胞处理30 min,再次12 000 r/min,4℃离心10 min,收集沉淀,再使用1 mol/L Nacl溶液进行洗涤,洗涤后再次12 000 r/min,4℃离心10 min,弃上清,收集沉淀,溶于30 mL磷酸缓冲液中,进行超声波(85 w)破胞处理30 min,收集沉淀,溶于无菌水中,置于-20℃冰箱中保存。SDS- PAGE的具体实验步骤按照Liu等(2010)的方法进行。
3.6伴孢晶体含量测定
杀虫蛋白浓度的测定按照Bradford (1976)所记录的方法进行。
3.7小菜蛾的人工饲养
本实验所使用的敏感种群小菜蛾是由海南省热带农业资源研究所的养虫室提供的。小菜蛾使用自然饲料饲喂的方法进行人工饲养。所使用的小菜蛾种群已经连续饲喂30多个世代,所提供试虫能够保证虫龄一致,生长状态良好,已达到生物测定实验试虫的标准。
3.8 SDS-PAGE分析ICPs随时间的变化
活化Bt菌株,转接BP培养基,30℃,230 r/min摇菌进行培养,每2小时取样一次,SDS-PAGE分析ICPs随时间产生的情况(谢柳等, 2009; Liu et al, 2010)。
3.9 Bt菌株的Cry基因型的鉴定
PCR模板制备参照Yu等(2006)的方法。PCR反应体系,包括2 μL质粒DNA模板,上下游引物使用1 μL,加入Dntp至浓度250 μmmol/L,5 μL的10×PCR buffer,0.5 μL Taq酶(4 U/μL),补双蒸水至50 μL。扩增反应:94℃预变性5 min。然后30个循环反应,每个循环为:94℃变性1 min;53℃退火1 min;72℃延伸3 min,72℃延伸10 min。最后取PCR产物5 μL,1%琼脂糖凝胶检测扩增产物。引物使用K5un2/K3un2和K5un3/K3un3,这两对引物可用于鉴定cry1基因(Kuo and Chak, 1996)。
3.10生物活性测定
按照Crespo等(2008)的方法,活化供试菌株,在30℃、220 r/min的培养条件下用1/2LB培养基对其进行震荡摇菌3 d,然后12 000 r/min、4℃离心10 min,取上清,用1 mol/L Nacl洗涤,12 000 r/min、4℃,离心10 min,弃上清,回收沉淀,加蒸馏水,制成供试菌株的菌体蛋白提取液。对小菜蛾进行生物活性测定(张文飞等, 2009)。利用实验室种植的白菜,挑选其中鲜嫩的、叶片大小基本一致的白菜叶,洗净晾干,浸入制备好的菌体蛋白提取液中20 s左右,注意需将叶片正反两面都均匀的浸入菌体蛋白提取液中10 s,然后将叶片放在生测室中阴干,再放入生测培养皿中,每个生测培养皿放30只小菜蛾,无菌水作为空白对照,控制生测室的温度25±1℃,光照周期为14 h光照/10 h黑暗,相对湿度控制为60%左右,72 h后,观察幼虫的生长情况,计算出最终的校正死亡率。
3.11生物测定半致死浓度(LC50)的分析
采用浸叶法对小菜蛾进行半致死浓度(LC50)测定(谢柳等, 2009; 张文飞等, 2009; Crespo et al, 2008),需把供试菌株的蛋白溶液浓度分别稀释到几个浓度,起始浓度的标定需要做几次尝试,待发现某一浓度下试虫死亡率较高时,则可用作起始浓度,然后把该浓度的蛋白稀释到5个浓度,每个浓度设置3个平行实验组,每一组放置30只小菜蛾。以这6个浓度的伴胞晶体溶液进行小菜蛾的半致死浓度测定,分别用无菌水和HD-73蛋白作为阴性对照和阳性对照,72 h后记录试虫的死亡数,计算出校正死亡率,然后使用SPSS 19.0 for Window软件中的Probit模块(概率单位回归)求出各个供试菌株的半致死浓度(LC50)。
3.12生物测定半致死时间(LT50)的测定
杀虫活性的半致死时间(LT50)的测定按照Yang等(2007)的方法进行,以致死浓度(LC98)的数值作为处理剂量对小菜蛾进行处理, 每隔8个小时记录一次小菜蛾死亡的幼虫数,每个处理设3个平行实验组,记录到72 h为止,分别用无菌水和HD-73蛋白作为阴性对照和阳性对照。计算不同处理时间段内的小菜蛾幼虫的校正死亡率,使用SPSS 19.0 for Window软件中的Probit模块(概率单位回归)求出各个供试菌株的半致死时间(LT50)。
作者贡献
梁照东是本研究的实验研究执行人;周燕、钟昊参与了试验结果分析、论文的修改;李有志指导实验设计,数据分析,论文修改和写作。全体作者阅读并同意最终的文本。
致谢
本研究受本研究受中国Bt 收集与鉴定项目的资助。作者感谢方宣钧老师给予本研究的指导以及对文章修改时所提出的宝贵意见;感谢海南省热带农业资源研究所的黎仲刚为小菜蛾人工养殖提供的帮助;部分研究工作是在广西大学李有志教授实验室完成;感谢匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关试剂仪器供应商,这并非我们为这些试剂仪器供应商的产品和服务提供推荐或背书。
参考文献
Abdel-Razek A.S., Abbas M.H., Ei-Khouly M., Abdel-Rahman A., 2006, Potential of microbial control of diamondback motn, Plutella xylostella (Linneaus), (Lepidoptera: Plutelldae) on two cabbage cultivars under diffferent fertilization treament., J. Appl. Sci. Res., 2: 942-948.
Adang M.J., Staver M.J., Rocheleau T.A., Leighton J., Barker R.F., and Thompson D.V.,1985, Characterized full length and truncated plasmid clones of the crystal protein of (Bacillus thuringiensis) subsp. Kurstaki HD-73 and their toxicity to Manduca sexta, Gene, 36(3): 289-300
http://dx.doi.org/10.1016/0378-1119(85)90184-2
Aronson J.N., Thompson F.M., 1971, Bacillus thuringiensis sporulation at suboptimal temperature, J. Bacteriol., 105: 445-448
PMid:4322350 PMCid:248373
Bradford M.M., 1976, A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding, Analyt. Biochem, 72: 248-254.
http://dx.doi.org/10.1016/0003-2697(76)90527-3
Chen S., Wu J.Y., Shen X. L., Zhang R., Huang J. Q., 1999, Purificat ion of the insecticidal toxin from Bacillus thuringiens is HD-73 and preparation of Its polyclonal antibody, Jiang su J. of Agr. Sci., 15(4): 203-205 (陈松, 吴敬音, 沈新莲, 张荣铣, 黄骏麒, 1999, 苏云金杆菌HD -73杀虫蛋白的纯化及其多克隆抗体的制备, 江苏农业学报, 15(4): 203-205)
Crespo A.L.B., Spencer T.A., Nekl E., Pusztai-Carey M., Moar W.J., and Siegfried B.D., 2008, Comparison and validation of methods to quantify Cry1Ab toxin from Bacillus thuringiensis for insect bioassays, Appl. Environ. Microbiol., 74(1): 130-135
http://dx.doi.org/10.1128/AEM.01855-07 PMid:17981939 PMCid:2223200
Ferre J., Real M. D., Van R. J., 1991, Resistance to the Bacillus thuringiensis to bioinsecticide in field populat ion of Plutella xylostella is due to a change in a midgut membrane receptor, Pro Nat 1 Acad Sci US A, 88: 5119-5123.
Jiang C., Li H.M., Gong A.J., Qiu Li.N., 2008, Studies on the purification methods for parasporal crystal of Bacillus thuringiensis, Huaxue Yu Shengwugongcheng (Chemistry & Bioengineering), 25(6):10-12 (蒋辰, 李红梅, 弓爱君, 邱丽娜, 2008, 苏云金芽孢杆菌伴孢晶体纯化方法研究, 化学与生物工程, 25(6):10-12)
Kuo W.S., and Chak K.F., 1996, Identification of novel cry-type genes from Bacillus thuringiensis strains on the basis of restriction fragment length polymorphism of the PCR amplified DNA, Applied And Environmental Microbiology, 62: 1369-1377
PMid:8919799 PMCid:167904
Liu S.K., Liu Z.M., Li Y.Z., Fang X.J., 2010, Expression and localization of Cry1Ac22 crystal protein from Bacillus thuringiensis W015-1 in yeast (Saccharomyces cerevisiae), Bt Research (online), 1(2): 11-15 (DOI: 10.5376/bt.2010.01.0002)
http://dx.doi.org/10.5376/bt.2010.01.0002
Liu Z.M., Liu S.K., Li Y.Z., and Fang X.J., 2010, Heterologous expression and purification of Cry1Ac22 toxin from Bacillus thuringiensis W015-1, Bioscience Methods (online), 1(2): 9-14 (DOI:10.5376/bm.2010.01.0002)
http://dx.doi.org/10.5376/bm.2010.01.0002
Liu Z.M., Zhou Y., Li Y.Z., Liu S.K., Fang X.J., 2011, Construction of plant expression constructs harboring full-length Bt Cry1Ac22 toxin gene and truncated functional domains of Bt Cry1Ac22 toxin and arabidopsis transformation, Bioscience Methods, 2(2): 15-20 (doi: 10.5376/bm.2011.02.0003)
http://dx.doi.org/10.5376/bm.2011.02.0003
Marco G., and Porcar M., 2012, Ecological mysteries: Is Bacillus thuringiensis a real insect pathogen? Bt Research, 3(1):1-2 (doi: 10.5376/bt.2012.03.0001)
http://dx.doi.org/10.5376/bt.2012.03.0001
Tan F.R., Zheng A.p., Zhou H.Q., Zheng X.L., Li Ping., 2006, Isolation and identification of one Bacillus thuringiensis subsp. Highly toxic to lepidoptera, Journal of Sichuan Agricultural University, 24(6):152-155. (谭芙蓉, 郑爱萍, 周华强, 郑秀丽, 李平, 2006, 一株对鳞翅目高毒力的苏云金芽孢杆菌亚种的分离与鉴定, 四川农业大学学报, 24(6):152-155)
Wu Y.Y., Sun C.P., Gao J.G., Zhang J., 2007, Huang D.F., Song F.P., Germination condition optimization of Bacillus thuringiensis HD-73 and effect of plasmid pHT73 on germination, Journal of Agricultural Science and Technology, 9(3):98-103.(吴艳艳, 孙长坡, 高继国, 张杰, 黄大昉, 宋福平, 2007, 苏云金芽孢杆菌HD-73菌株芽孢萌发条件的优化及质粒pHT73对芽孢萌发的影响, 中国农业科技导报, 9(3): 98-103.)
Xie L., Zhang W.F., Liu Z.M., Cai Y.G., Li Y.Z., and Fang X.J.,2010, Characterization of a new highly toxic isolate of Bacillus thuringiensis from the diapausing iarvae of silkworm and identification of cry1A 22 gene, Bt Research(online), 1(1) (DOI: 10.5376/bt.2010.01.0001)
http://dx.doi.org/10.5376/bt.2010.01.0001
Xie L., Zhang W.F., Quan J.X., Liu Z.M., Ye D.W., Li Y.Z., and Fang X.J., Bacillus thuringiensis collection and isolates identification from Damingshan and Dawangling Natural Reserves in Guangxi Province, 2009, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(1): 62-68 (谢柳, 张文飞, 全嘉新, 刘卓明, 叶大维, 李有志, 方宣钧, 2009, 广西大王岭和大明山自然保护区苏云金芽孢杆菌收集与鉴定, 基因组学与应用生物学, 28(1): 62-68)
Yang Y.K.,Cai Q.X., CAI Y.J., Yan J. P., Yuan Z. M., 2007, The synergism between Mtx1 from Bacillus sphaericus and Cyt1Aa from Bacillus thuringiensis to culex quinquefasciatus, Acta Microbiologica Sinica. 47(3): 456-460. (杨艳坤, 蔡全信, 蔡亚君, 闫建平, 袁志明, 2007, 微生物学报, 球形芽孢杆菌Mtx1蛋白和苏云金杆菌Cyt1Aa晶体蛋白的协同作用, 47(3): 456-460)
Yu H., Zhang J., Huang D., Gao J., and Song F., 2006, Characterization of Bacillus thuringiensis strain Bt185 toxic to the Asian cockchafer: Holotrichia parallela, Plasmid, 53: 13-17
Zhang W.F., Quan J.X., Xie L., Wang X., Yi Y.T., Feng M.M., Zhu L., Wang R.P., Fang X.J., 2009, Collection of Bacillus and identification of Bacillus thuringiensis isolates from tropical rain forest reserves of Hainan island, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(2): 265-274 (张文飞, 全嘉新, 谢柳, 王茜, 易艳桃, 丰玫玫, 朱麟, 王锐萍, 方宣钧, 2009, 海南岛热带雨林区芽孢杆菌收集及Bt菌鉴定, 基因组学与应用生物学, 28(2):265-274)
Zhang W.F., Xie L., Zhao L.S., Fang X.J., Liu S.K., 2009, Identification and collection of Bacillus thuringiensis from Liangshui Natural Reserves in Heilongjiang Province of Northeast China, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 28(4): 685-690 (张文飞, 谢柳, 赵立仕, 方宣钧, 柳参奎, 2009, 黑龙江凉水自然保护区苏云金芽孢杆菌的收集与鉴定, 基因组学与应用生物学, 28(4): 685-690)
Zuo Y.H., Xu H.Y., 2002, Isolation of high toxin Bacillus thuringiensis against Plutella xylostella and its properties, Journal of Microbiology, 22(4): 40-41 (左雅慧, 徐宏英, 2002, 一株对小菜蛾高毒力的苏云金杆菌的选育及研究, 微生物学杂志, 22(4): 40-41)