2 诸暨市翠溪生物技术研究院, 诸暨, 311800
 作者
作者  通讯作者
通讯作者
植物药与药理学杂志, 2020 年, 第 9 卷, 第 1 篇
收稿日期: 2020年02月10日 接受日期: 2020年02月12日 发表日期: 2020年02月13日
马兜铃酸是一类毒和效并存的化学成分,存在于马兜铃科的传统草药植物中。含马兜铃酸的传统草药被应用于多种常见疾病的治疗,但由于致癌作用及马兜铃酸肾病等毒副作用,其应用一直以来备受争议。近来,马兜铃酸被认为是肝癌高发的重要影响因素。为了了解马兜铃酸的药理毒理作用,本综述从马兜铃酸理化特性、毒副作用、药理作用、致癌机制及含马兜铃酸药物的国内外监管等方面的研究现状进行综述,为进一步开展马兜铃酸药理毒理研究及含马兜铃酸药物安全应用提供系统的药理知识和和临床效应。
Physicochemical Properties of Aristolochic Acid and Clinical Efficacy and Safety of Traditional Herbal Medicine Containing Aristolochic Acid
Xuanjun Fang 1,2*
1 Institute of Life Science, Jiyang College of Zhejiang A&F University, Zhuji, 311800; 2 Cuixi Academy of Biotechnology, Zhuji, 311800
* Corresponding author, jim.xj.fang@cuixi.org
Abstract Aristolochic acid is a group of chemical constituents with are both toxicity and efficacy found in traditional herbal plants in the family of Aristolochaceae. Traditional herbal medicines containing aristolochic acid has been widely used in the treatment of many common diseases, but there has been a lot of controversy in clinical application because of its carcinogenic effect and toxic side-effects such as aristolochic acid nephropathy. Recently, aristolochic acid has been considered as an important factor in the high incidence of liver cancer. In order to understand the pharmacology and toxicology effect of aristolochic acid, this review summarized research status on the physical and chemical properties, toxic side-effects, pharmacological effects, and carcinogenic mechanism as well as in aspects of regulation of traditional herbal medicines containing aristolochic acid at home and abroad, which would provide the pharmacological knowledge and Clinical effect for further researches on pharmacology and toxicology of aristolochic acid and its safe application.
Keywords Aristolochic acid, Aristolochic acid nephropathy, Traditional Herbal Medicinal, Clinical efficacy
马兜铃酸(aristolochic acids, AAs)也被称为马兜铃总酸、增噬力酸或木通甲素,是一类硝基菲类有机酸类化合物。马兜铃酸天然存在于诸如马兜铃属(Aristolochia)及细辛属(Asarum)等马兜铃科植物中,而这些植物曾被广泛的用作传统草药,且历史悠久,但与肾病、肝脏疾病和尿路上皮癌等的发生有着广泛的联系(Heinrich et al., 2009; Wu et al., 2015)。
在2000年前后,中国发生了著名的“龙胆泻肝丸”事件,据统计在1999-2001年间,仅中日友好医院就有超过100名患者因尿毒症就诊,最终所有的矛头都指向了马兜铃酸这个传统草药成分。在2002年,国际癌症研究机构就曾对传统草药进行致癌风险评估,将马兜铃酸列为Ⅰ类致癌物,即已确认其不但可以导致尿毒症,而且还会导致肾癌、膀胱癌和尿道上皮肿瘤等一系列肿瘤(Nolin and Himmelfarb, 2010)。随后,世界卫生组织提出了对马兜铃酸药物的药物警报,欧洲、美国、中国台湾和香港地区纷纷禁止了含马兜铃酸的传统草药的使用,2003年,中国国家食品药品监督总局取消关木通的药物标准;2004年国家食品药品监督总局取消了广防己和青木香药物标准。同时《中国药典》从2005年开始取消了记录中含有马兜铃酸的中草药。
2017年10月,一篇马兜铃酸的重磅论文,登上权威医学期刊《Science Translation Medicine》封面,该研究显示,在传统草药里广泛存在的马兜铃酸成分与肝癌的发生有关,是导致亚洲肝癌的重要原因之一。结论一出,随即引发了舆论对传统草药安全性的担忧,并又一次将马兜铃酸推向“限用还是禁用”的争论焦点(Ng et al., 2017)。
本研究介绍了马兜铃酸的一般的理化特性,总结了人类使用含马兜铃酸传统草药药物产生的临床毒性反应、重要的临床案例以及国际上对使用含马兜铃酸药物的态度,以期为传统草药医生及接受治疗者的用药提供系统的药理知识和和临床效应。
1马兜铃酸的理化特性及生物合成
1.1马兜铃酸的理化特性
马兜铃酸种类很多,各种马兜铃酸均具有基本相同的结构,它们的种类则取决于结构上的三个取代基——氢原子(即无取代)、羟基或甲氧基,其中最重要及最常见的一种是马兜铃酸Ⅰ (马兜铃酸A) (图1; 表1)。
.png) 图1 马兜铃酸分子结构式 Figure 1 The molecular structure of Aristolochic acid |
 表1 马兜铃酸的分类及其特征 Table 1 Classification and characteristics of aristolochic acid |
利用热二甲基甲酰胺水溶液中萃取获得的马兜铃酸为有光泽的褐色片状结晶,利用甲醇萃取获得的马兜铃酸则为橘黄色棒状结晶。马兜铃酸类化合物味微苦(Schütte et al., 1967),可溶于乙醇、氯仿、乙醚、丙酮、冰醋酸、苯胺或碱液,微溶于水,几乎不溶于苯或二硫化碳(Hoover et al., 1991),熔点介于281℃~286℃之间(约于286℃分解)。
1.2马兜铃酸的生物合成
马兜铃酸属于一组取代的10-硝基-1-苯甲酸,生物遗传来源于苄基异喹啉前体,后者又来自酪氨酸(Schütte et al., 1967)。因此,马兜铃酸的生物合成(图2)始于酪氨酸(2),其转化为L-DOPA (3);随后将DOPA转化为多巴胺(4),并进一步将多巴胺转化为3,4-二羟基苯乙醛(5) (或4-羟基苯乙醛以产生网状番荔枝碱),通过自发的Pictet-Spengler缩合形成去甲肾上腺素(6)。两个分子通过14C实验证实了这些前体的证据,其中将标记的化合物施用于马兜铃(Aristolochia sipho)并成功提取马兜铃酸(aristolochic acid) (Hoover et al., 1991)。通过两个醇基团的甲基化继续对去甲肾上腺素的修饰,得到东罂粟灵(orientaline) (7)。东罂粟灵(orientaline)经历环化事件以将五元环添加到东莨菪碱(scopolamine) (8)中,随后经历甲基转移和芳构化事件(9)以产生甲基苯丙胺(10)。最后的步骤是形成千金藤碱(stephanine) (11)和加入羧酸盐以产生马兜铃酸(12)。
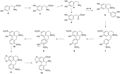 图2 兜铃酸的生物合成 Figure 2 Biosynthesis of aristolochic acid |
Comer等(1969)最初提出了一种假定的途径,从1968年的全去甲劳丹碱(norlaudanosoline)到马兜铃酸非常类似于描述的途径。但Sharma等(1982)通过DL-[3-14C]酪氨酸捕获实验证实了中间化合物的存在,并在合成马兜铃酸的一般骨架后,进行了后合成修饰,例如其中一个环的芳构化产生马兜铃酸I。
2马兜铃酸的生化毒性
马兜铃酸被认为是多瑙河地区性家族性肾病(DEFN)和类似的疾病——“中草药肾病”(Chinese herbs nephropathy)的致病原(Ronco and Bellomo, 2008; Lai et al., 2009; Chen et al., 2018),其表现为肾脏进行性快速纤维化并伴随肾萎缩。现已证实,暴露于高马兜铃酸环境与尿路上皮癌变的高发病率相关,马兜铃酸的接触也与肝癌有关(Gökmen et al., 2013; Poon et al., 2013; Schmeiser et al., 2014)。
1964年常州市第一人民医院吴松寒医生在《江苏中医》上发表论文《木通所致急性肾功能衰竭二例报告》,首次报告了两例因服用大剂量关木通(含马兜铃酸)导致急性肾功能衰竭。
1990年,含有马兜铃酸成分的传统草药肾毒性事件时有发生;1993年,比利时发生妇女服用香港进口含防己和厚朴的减肥传统草药,发生肾衰竭,105名女患者中有70个病人需要肾移植或透析治疗,引起医学界注意,同时国际著名《Lancet》杂志对相关的肾衰竭案例进行的报道。从1998年起,北京中日友好医院在1999-2001年间共收治了近100例服用含马兜铃酸的传统草药制剂引起的急慢性肾功能衰竭患者。医学界称此类肾病为中草药肾病(chinese herb nephropathy, CHN),中草药肾病在一些资料中也称马兜铃酸肾病(aristolochic acid nephropathy, AAN)。此后,澳大利亚、德国、埃及、委内瑞拉、英国、日本等许多国家和地区相继出现相关报道。同时也有研究表明,马兜铃酸还可导致输尿管癌、肾盂癌、膀胱癌等,具有较强的致癌作用。
由于陆续报到的马兜铃酸致肾病性以及致癌性,2003年,中国国家食品药品监督总局取消关木通的药物标准;2004年,又取消了广防己和青木香的药物标准。这意味着,中国内地宣布禁用了这三种含马兜铃酸的药材。国际癌症研究机构于2008年把利用马兜铃属植物制作的草药列为1类致癌物,并将马兜铃酸类物质的天然混合物列入2A类致癌物,这从最高层面将马兜铃酸能够致癌确定为事实。
2013年8月,两项研究确定了来自台湾的上尿路癌症患者的马兜铃酸突变特征,证实马兜铃酸对上尿路癌症的诱导作用是迄今为止发现的最有效的,超过吸烟诱导的肺癌和紫外线暴露的黑素瘤的突变量(Hoang et al., 2013; Poon et al., 2013)。
马兜铃酸除了能够致肾癌外,陆续也发现对肝癌的发生也有关键作用。2017年10月,权威医学期刊《Science Translation Medicine》发表了来自台湾研究者的《马兜铃酸及其衍生物与台湾和亚洲其他地区肝癌相关》的论文,并登上该杂志的封面。该研究从台湾两家医院抽查了98个肝细胞癌的样本,发现其中有78%的特殊基因突变可能与马兜铃酸有关,这也说明这些肝癌患者的发病与马兜铃酸有关。随后他们扩大了研究范围,发现东南亚有29%的肝癌样本与马兜铃酸有关,日本为2.7%,韩国为13%,欧洲和北美分别为1.7%和4.8%,而在中国地区却高达47%,这从另一方面证实了马兜铃酸对中国人群肝组织长期的危害作用(Ng et al., 2017)。也有研究表明接触马兜铃酸也可能导致某些类型的肝癌(Poon et al., 2013)。
马兜铃酸类化合物中,主要的毒性成分为马兜铃酸Ⅰ和马兜铃酸Ⅱ,其在硝基还原酶的催化下,一部分被还原为马兜铃内酰胺,另一部分在还原过程中进一步与DNA作用,形成加合物。在马兜铃酸类衍生物对猪肾小管上皮细胞的毒性研究中发现,各衍生物毒性的强弱与其化学结构有关。硝基是马兜铃酸类衍生物中最主要的毒性基团,此外甲氧基和羟基的存在可以使马兜铃酸的毒性进一步加强。另有研究发现,不但马兜铃酸具有很强的肾毒性,其代谢产物马兜铃内酰胺同样具有肾毒性。
3马兜铃酸的药理学及致癌机制
作为头号致癌物质,马兜铃酸一旦经人体口服摄入,马兜铃酸I就会通过胃肠道吸收进入血液,它通过血液分布到全身。马兜铃酸通过氧化和还原途径或I期代谢,减少马兜铃酸I的产生,通过O-去甲基化进一步加工马兜铃内酰胺I (Aristolactam I)产生马兜铃内酰胺Ia (aristolactam Ia),即主要代谢产物。此外,硝化还原产生N-酰基硝基鎓离子,它可以形成DNA碱加合物,从而使马兜铃酸I具有诱变特性(Arlt et al., 2002)。马兜铃酸I与DNA结合的加合物非常稳定,在接触含有马兜铃酸的植物20年后,在患者活检样本中检测到它们。马兜铃酸及其代谢产物的排泄是通过尿液排出的。
但是,马兜铃酸的确切作用机制尚不清楚,特别是在肾病方面。通过对马兜铃酸代谢过程及代谢酶的研究证实,马兜铃酸致突变和致癌毒性是由其代谢的中间产物马兜铃内酰胺氮离子引起的,因为它具有很强的亲电能力,能与DNA碱基环外氨基亲电结合,生成相应的加合产物,使RAS基因和P53基因发生突变,进而诱发肿瘤的发生,这似乎是马兜铃酸相关致癌作用所独有的(Gökmen et al., 2013)。马兜铃酸消耗引起的肾病在机理上尚无法理解,但在AAN患者的肾脏中发现了马兜铃酸诱导突变特征的DNA加合物,表明它们可能起作用。
科学家根据马兜铃酸在生物体内与DNA形成加合物,进而导致癌症发生的机制做了大量的研究。结果发现,马兜铃酸在体内经简单代谢过程,其胺离子将被硝基还原酶还原为环内酰胺离子(cyclic N-acylnitrenium ion) (Hoang et al., 2013),代谢产物的一部分被还原为马兜铃内酰胺,进入肾小管上皮细胞、蓄积于细胞质内发挥毒性作用;而另一部分则与DNA中嘌呤核苷酸的环外氨基共价结合形成特异性的AA-DNA加合物,进而使RAS基因和p53基因发生突变。有实验表明,在使用具有细胞毒性的马兜铃酸处理肾小管细胞后,DNA链断裂频率增加,细胞对DNA损伤的相应、DNA修复基因的调节、细胞凋亡以及细胞周期的调控都将出现显著变化,此外,诸如超氧化物歧化酶、谷胱甘肽还原酶和谷胱甘肽过氧化物酶等抗氧化酶的基因表达皆被下调。而相关研究表明,因服用马兜铃酸成分传统草药而导致上尿路上皮癌细胞发生的基因突变很特殊,发现在一小段特定的序列上引起了碱基A变成碱基T的突变,而这一突变目前还没有发现其他的诱导因素,所有可以怀疑这种突变是有马兜铃酸的诱导作用所引发。
4国内外对含马兜铃酸的药物的监管法规
2001年4月,美国食品药品监督管理局(FDA)发布了一份消费者安全警报,用以提醒使用含有马兜铃酸的“传统药方”或膳食补充剂等植物提取物产品对健康造成的危害。该机构警示称使用含马兜铃酸的产品“可能导致永久性的肾损害,并可能引发需要通过透析或肾移植方能治疗的肾衰竭”。此外,FDA还提到某些病人因服用此类产品罹患癌症,尤其是发生在尿路的癌症。台湾卫生署要求加注警语,但未禁用相关药材。
中国直到2002年,国家药品监督管理局发布的内部通知“药品不良反应信息通报”中才提及马兜铃酸,但并未禁止和通报,有关药品继续流通。
台湾自2003年因马兜铃酸事件,引发中西医论战。卫生署中医药委员会于11月正式禁用关木通、广防己、青木香、天仙藤、马兜铃等五种含马兜铃酸传统草药材,并注销含有马兜铃酸传统草药制剂的五十张药证,包括补肺阿胶散、治嗽散、运功散等。
2003年,中国新华社系列报道了大量服用龙胆泻肝丸导致肾脏损害的病例(李庆等, 2003, 中国中西医结合急救杂志, 10(6): 383-383),之后中国国家药监局发出正式通知,取消了关木通、青木香、广防己等6种药材的用药标准,但是还有多种含马兜铃酸的药物依然在使用。
香港卫生署在2004年,宣布停止进口及销售含有马兜铃酸的传统草药材及制剂,同时停止销售喊马兜铃酸的中成药。
《中国药典》2005年版起,已不再收录关木通、广防己、青木香等含有马兜铃的传统草药方,并使用其他品种替代。此外,对于其他含马兜铃酸生药的药用部位也进行了更改。如在2000年版以前的《中国药典》中细辛的药用部位均为“全草”,但后来考虑到细辛地上部分马兜铃酸含量较高,且古代中医一直仅使用根部,及《日本药局方》也仅用“根和根茎”,所以2005年起《中国药典》亦将药用部位修订为根和根茎。
国际癌症研究机构于2008年利用马兜铃属植物制作的草药列为1类致癌物,并将马兜铃酸类物质的天然混合物列入2A类致癌物。
《中国药典》2010年版进一步规定,依照高效液相色谱法测定,按干燥品计算细辛中马兜铃酸Ⅰ的含量不得过0.001%。
到了2012年,更是因为马兜铃酸的毒性强烈得到越来越多事实的报道,将所有的马兜铃酸类物质(马兜铃酸、含有马兜铃酸的化合物及植物)升级成为1类致癌物。
2017年,国际著名期刊《科学》旗下的《转化医学》子刊发表题为“马兜铃酸及其衍生物与台湾和整个亚洲的肝癌广泛相关”的封面文章。文章称,研究人员通过对全世界共计一千四百多个肝癌样本的测序分析,发现中国样本的马兜铃酸暴露印记明显高于北美和欧洲的样本,进而得出了亚洲肝癌的发生与马兜铃酸暴露存在相关性的结论。至此,马兜铃酸再一次站在了医药界的风口浪尖上,引起了更为广泛的关注。
5结束语
马兜铃酸成为传统草药始载秦汉《神农本草经》,《神农本草经》将其列为上品,已有两千多年的应用历史。随着科学技术的发展,马兜铃酸更多的一面逐渐展现在世人面前,曾经的神药逐渐走下了神坛,这对于马兜铃酸本身,以及中国传统草药业的发展具有深远的意义。
很久以前,马兜铃酸被认为有抗癌、抗感染的功效,但自1990年起,马兜铃酸及其衍生物的毒性反应及其带给人体的危害不断被报导出来。2015年中国新增肝癌病人超过40万,占到全世界的一半以上。而中国平均肝癌发病风险,更是欧美的3~4倍之多。
但是,药物原本就是一把“双刃剑”,无论是传统草药还是西药,均存在不良反应和毒副作用,这是不可回避的问题。“是药三分毒,无毒不入药”,《神农本草经》就将传统草药分为上、中、下品。在《中国药典》2010版收录常用传统草药材和饮片中,包括有毒传统草药73种,大毒性10种。传统草药含有毒性成分,但未必有害,我们需要要辨证看待传统草药毒性。
含马兜铃酸的药材在中国已有上千年的使用历史。目前,收载于中国药典、部颁标准和地方药材标准的马兜铃科药材有24种,含马兜铃属药材的传统草药成药口服制剂有47种,均可在食药监总局政府网站查询。不过,提醒患者,药品要严格按照医生处方和医嘱使用,注意含马兜铃属药品的肾毒性、致癌性的风险。任何药品都不能大剂量、长时间服用。
中国自2003年以来,也已对含马兜铃酸药材及传统草药成药采取了一系列风险控制措施,包括禁止使用马兜铃酸含量高的关木通、广防己和青木香;调整药材使用部位,将马兜铃科植物细辛的药用部位由全草改为根和根茎,根和根茎几乎不含马兜铃酸;明确安全警示,对含马兜铃属药材的口服传统草药成药品种严格按处方药管理;制定《含毒性药材及其他安全性问题传统草药品种的处理原则》。采取上述措施后,马兜铃酸肾损害病例数量大幅下降,也未收到直接引发肾癌报告。
所以,在国家尚未出台更严格的马兜铃酸药物管理条例之前,我们每个人能做的,是避免国家已经明确列举的那些含马兜铃药物的使用。同时,尽量让更多人知道有关马兜铃酸遗传毒性的相关知识,促进国家对马兜铃酸类药物的更严格的管理。这些不仅是为了我们自己,更是为了下一代做的事情。我们值得有更安全的用药环境。
作者贡献
方宣钧进行论文构思、文献收集和初稿写作、修改和最终定稿作者都阅读并同意最终的文本。
致谢
本研究由诸暨市翠溪生物技术研究院《翠溪创新研发项目基金》资助。李慧霞、吴仲琦、黄妍参与了前期的文献收集、稿件修改和补充;作者在此深表感谢。
参考文献
Arlt V.M., Stiborova M., and Schmeiser H.H., 2002, Aristolochic acid as a probable human cancer hazard in herbal remedies: a review, Mutagenesis, 17(4): 265-277
https://doi.org/10.1093/mutage/17.4.265
Chen C.H., Dickman K.G., Moriya M., Zavadil J., Sidorenko V.S., Edwards K.L., Gnatenko D.V., Wu L., Turesky R.J., Wu X.R., Pu Y.S., and Grollman A.P., 2012, Aristolochic acid-associated urothelial cancer in Taiwan, Proceedings of the National Academy of Sciences, 109(21): 8241-8246
https://doi.org/10.1073/pnas.1119920109
Gökmen M.R., Cosyns J.P., Arlt V.M., Stiborová M., Phillips D.H., Schmeiser H.H., Simmonds M.S., Cook H.T., Vanherweghem J.L., Nortier J.L., and Lord G.M., 2013, The epidemiology, diagnosis, and management of aristolochic acid nephropathy: a narrative review, Annals of Internal Medicine, 158(6): 469-477
https://doi.org/10.7326/0003-4819-158-6-201303190-00006
Hoang M.L., Chen C.H., Sidorenko V.S., He J., Dickman K.G., Yun B.H., and Moriya M., 2013, Mutational signature of aristolochic acid exposure as revealed by whole-exome sequencing, Science Translational Medicine, 5(197):197ra102-197ra102
https://doi.org/10.1126/scitranslmed.3006200
Hoover L.K., Moo-Young M., and Legge R.L., 1991, Biotransformation of dopamine to norlaudanosoline by Aspergillus niger, Biotechnology & Bioengineering, 38(9): 1029-1033
https://doi.org/10.1002/bit.260380911
Lai M.N., Wang S.M., Chen P.C., Li T.C., and Lee S.M., 2009, Population-based case-control study of chinese herbal products containing aristolochic acid and urinary tract cancer risk, Journal of the National Cancer Institute, 102(3): 179-186
https://doi.org/10.1093/jnci/djp467
Ng A.W.T., Poon S.L., Huang M.N., Lim J.Q., Boot A., Yu W., Suzuki Y., Thangaraju S., Ng C.C.Y., Tan P., Pang S.T., Huang H.Y., Yu M.C., Lee P.H., Hsieh S.Y., Chang A.Y., Teh B.T., and Rozen S.G., 2017, Author information Aristolochic acids and their derivatives are widely implicated in liver cancers in Taiwan and throughout Asia, Science Translational Medicine, 9(412): eaan6446
https://doi.org/10.1126/scitranslmed.aan6446
Nolin T.D., and Himmelfarb J., 2010, Mechanisms of drug-induced nephrotoxicity, Handbook of Experimental Pharmacology, 196(196): 111-130
https://doi.org/10.1007/978-3-642-00663-0_5
Poon S.L., Pang S.T., Mcpherson J.R., Yu W., Huang K.K., Guan P., Weng W.H., Siew E.Y., Liu Y., Heng H.L., and Chong S.C., 2013, Genome-wide mutational signatures of aristolochic acid and its application as a screening tool, Science Translational Medicine, 5(197): 197ra101-197ra101
https://doi.org/10.1126/scitranslmed.3006086
Ronco C., and Bellomo R., 2008, Critical care nephrology, Critical Care Nephrology, 1-3
Schmeiser H.H., Nortier J.L., Singh R., Gamboa da Costa G., Sennesael J., Cassuto-Viguier E., Ambrosetti D., Rorive S., Pozdzik A., Phillips D.H., Stiborova M., and Arlt V.M., 2014, Exceptionally long-term persistence of DNA adducts formed by carcinogenic aristolochic acid I in renal tissue from patients with aristolochic acid nephropathy, International Journal of Cancer, 135(2): 502-507
https://doi.org/10.1002/ijc.28681
Schütte H.R., Orban U., and Mothes K., 1967, Biosynthesis of aristolochic acid, Eur J Biochem., 1(1): 70-72
https://doi.org/10.1111/j.1432-1033.1967.tb00045.x
Sharma V., Jain S., Bhakuni D.S., and Kapil R.S., 1982, Biosynthesis of aristolochic acid, Journal of the Chemical Society, Perkin Transactions 1