2 广东高校特色调味品工程技术开发中心, 广州, 510300
 作者
作者  通讯作者
通讯作者
植物药与药理学杂志, 2013 年, 第 2 卷, 第 6 篇
收稿日期: 2013年06月05日 接受日期: 2013年06月18日 发表日期: 2013年06月28日
以神秘果果实为材料,以获得高质量RNA为目的,以针对性地去除多糖、酚类物质为出发点,比较了TRIzol法、CTAB法,并相应加以改良。结果显示:CTAB粗提法方便快捷,CTAB精提法提取的总RNA完整性好、纯度高,RT-PCR反应表明提取的总RNA都能满足分子生物学实验的要求。
神秘果(Synsepalum dulcificum)属于山榄科神秘果属,原产西非,自20世纪60年代引入中国,在海南、广东、广西等省区种植。神秘果果肉中含有一种特异的糖蛋白——神秘果素(miraculin),能够改变人的味觉,食用酸味食物但感觉是甜味。近年来,科学工作者开始对其作用机理进行研究。
分子生物学研究中,基因的克隆、Northern杂交、cNDA文库构建等实验都以获得高质量RNA为基础,而从果实中提取高质量的RNA往往十分困难。神秘果素只在果实中表达(Hiwasa-Tanase et al., 2012),而神秘果果实中含有丰富的酚类物质、色素及多糖,这些物质往往对RNA的提取有很大的影响。本试验以神秘果成熟果实为材料,参考TRIzol试剂法与CTAB提取法并加以改进,以探索出一个快捷有效并能满足分子生物研究的总RNA提取方法,为对神秘果素的进一步研究提供参考。
1结果与分析
1.1 RNA样品浓度与纯度分析
采用4种方法提取神秘果果肉总RNA,所得样品在220~320 nm紫外波长范围内进行扫描以检测其浓度与纯度(图1; 表1)。
.png) 图 1 220~320 nm紫外波长范围内总RNA样品扫描曲线 注: Ⅰ-TRIzol提取法; Ⅱ-TRIzol改良法; Ⅲ-CTAB粗提法; Ⅳ-CTAB精提法 |
 表 1 不同方法提取神秘果果实总RNA的浓度和吸光度比值 |
由图1与表1可看出,TRIzol提取法及其改良法提取得到的RNA样品质量低,OD260/OD280均小于1.2,远远达不到1.8~2.0的标准,而且浓度很低,小于40 μg/mL,另外OD230值相对很高,表示多糖等杂质含量相对较多。而CTAB法得到的RNA样品质量较好,其中粗提法的总RNA浓度为192.5 μg/mL,OD260/OD280为1.93, OD260/OD230为2.51,表示总RNA样品纯度高,但有部分被降解;精提法的总RNA浓度为304.5 μg/mL,OD260/OD280为1.94,纯度高,OD260/OD230为2.12,表示总RNA样品纯度高,降解度小。
1.2 RNA完整性分析
为了检测提取所得的总RNA完整性,进行了变性琼脂糖凝胶电泳,结果如下图:
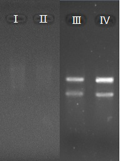 图 2 神秘果果肉总RNA电泳图 注: Ⅰ-TRIzol提取法; Ⅱ-TRIzol改良法; Ⅲ - CTAB粗提法; Ⅳ-CTAB精提法 |
由图2可知,TRIzol提取法与TRIzol改良法所得的RNA样品没有明显带条,表示含量非常低,可能是提取过程中无法有效防止酚类物质的氧化,导致此氧化物结合上RNA从而形成沉淀被除去。CTAB法的RNA样品带条明显,并且无DNA污染,其中精提法的28S rRNA 带条亮度是18S rRNA的2倍,说明总RNA完整性好。
1.3 RT-PCR验证
为了检测总RNA能否满足分子生物学实验,我们进行了RT-PCR验证实验。神秘果素存在于果肉中,在果实成熟的过程中大量表达,我们根据其序列设计引物进行RT-PCR反应,PCR产物进行琼脂糖凝胶电泳,结果见图3。
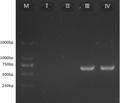 图 3 神秘果素基因片段RT-PCR产物电泳图 注: M: Marker DS2000; Ⅰ-TRIzol提取法; Ⅱ-TRIzol改良法; Ⅲ - CTAB粗提法; Ⅳ-CTAB精提法 |
由上图可知,TRIzol提取法与TRIzol改良法得到的总RNA均得不到RT-PCR产物,因此不适合用于神秘果果实总RNA的提取。CTAB粗提法与CTAB精提法均得到RT-PCR产物,并且产物分子量正确,约670 bp。由此可得出,CTAB法适合神秘果果实总RNA的提取,能满足分子生物学实验的要求,并且CTAB粗提法所需时间约4 h,方便快捷。
2讨论
得到高质量的RNA是进行分子生物学研究的最基础的一步,不同的组织往往需要不同的提取方法。对于植物果实总RNA的提取,影响RNA质量最大的因素是多糖与酚类物质。多糖的性质与RNA相似,在提取过程中易与RNA一起沉淀,在后继实验中易与酶结合使酶失活,严重干扰实验的进行;而酚类物质在细胞破碎时被释放出来且易被氧化,此氧化物易与RNA不可逆地结合而形成不溶物,使RNA丧失生物活性(李宏, 1999)。因此,怎样有效去除多糖与酚类物质显得十分重要。
在现有的总RNA提取方法当中,TRIzol提取法是非常简捷的方法,操作简单且快速,但本实验证明,TRIzol法并不适合神秘果果实RNA的提取,就算在TRIzol改良法中针对性地加入2步,丙酮去除色素类与乙二醇丁醚去除多糖类,但提取产物中总RNA含量非常低,得不到RT-PCR产物。
CTAB法能有效的提取神秘果果实总RNA。提取液中加入高浓度(2%)的β-巯基乙醇可有效防止多酚类物质被氧化,PVP能有效结合酚类从而除去;LiCl能有效地沉淀RNA而使多糖留在上清液从而去除多糖。经过粗提法得到的总RNA已可满足RT-PCR反应,所用时间约为4 h,且操作方便快捷。在CTAB精提法中,用KAc沉淀多糖,使RNA留在上清而进一步除去多糖,得到较纯的RNA样品。
另外本实验还发现,RNA沉淀步骤中,-20℃沉淀过夜的效果优于-70℃沉淀1~2 h,可能是温度太低使得某些物质形成沉淀从而影响RNA的质量。
3材料与方法
3.1材料
试验材料为神秘果成熟果实,采收后液氨速冻,于-70℃贮藏备用。
3.2主要试剂
CTAB提取液:30 g/L CTAB,20 g/L PVP-40,0.5 g/L亚精胺,0.02 mol/L EDTA,0.1 mol/L Tris,2 mol/L NaCl,用盐酸调至Ph 8.0。
配制10 mol/L LiCl,2 mol/L LiCl,10 mmol/L Tris-HCl (Ph 7.5),3 mol/L KAc (pH 5.5)。另外,TRIzol试剂、β-巯基乙醇、氯仿、异戊醇、无水乙醇、DEPC处理水备用。吸咀及塑料离心管用0.1% DEPC水处理12 h后高压灭菌,烘干备用。
3.3总RNA提取
方法一:TRIzol提取法,0.2 g材料用1 mL TRIzol提取液按照操作说明书进行提取。
方法二:TRIzol改良法(周波等, 2004)。在加入提取液TRIzol试剂前,0.2 g材料先用1 mL丙醇、20 μL β-巯基乙醇在室温下处理20 min,4℃ 8 000 r/min离心10 min,去上清。另外在加入异丙醇沉淀RNA前,加入1/2体积的乙二醇丁醚,冰上放置30 min,4℃ 8 000 r/min离心10 min,取上清。其它步骤按操作说明书进行。
方法三:CTAB粗提法(何健行等, 2010; 裴嘉博等, 2012; 张玲等, 2012):材料去核,液氮快速研磨成粉末,取0.2 g材料于2 mL塑料离心管中,加入1 mL CTAB提取液和20 μL β-巯基乙醇,充分混匀,65℃处理30 min,15℃ 8 000 r/min离心10 min,取上清液,加入等体积的氯仿:异戊醇(24:1),4℃ 12 000r/min离心10 min,取上清,加入1/3体积10 mol/L LiCl,混匀后于-70℃沉淀RNA 1~2 h(或-20℃沉淀过夜),4℃ 13 000 r/min离心15 min,吸去上清,沉淀用200 μL 2 mol/L LiCl悬浮,4℃ 13 000 r/min离心5 min,沉淀用75%乙醇洗涤2次,4℃ 13 000 r/min离心5 min,小心吸去上清,沉淀在超净工作台中吹干,最后用20 μL DEPC水溶解RNA,-70℃保存备用。
方法四:CTAB精提法(何健行等, 2010; 裴嘉博等, 2012; 张玲等, 2012):方法三得到的RNA沉淀用200 μL 10 mmol/L Tris-HCl (pH 7.5)溶解,加入等体积的氯仿:异戊醇(24:1),冰上放置10 min,4℃ 12 000 r/min离心10 min,取上清,加入1/10体积3 mol/L KAc (pH 5.5),冰浴30 min,4℃ 12 000 r/min离心15 min,取上清,加入2倍体积的-20℃预冷无水乙醇,混匀后于-70℃沉淀RNA 1~2 h (或-20℃沉淀过夜),4℃ 13 000 r/min离心15 min,RNA沉淀用75%乙醇洗涤2次,4℃ 13 000 r/min离心5 min,小心吸去上清,RNA沉淀在超净工作台中吹干,最后用20 μL DEPC水溶解,-70℃保存备用。
3.4 RNA检测
浓度测定:总RNA样品用紫外分光光度计在220~320 nm波长范围进行扫描,检测其浓度与纯度。
电泳检测:总RNA样品用甲醛变性琼脂糖凝胶电泳,检测其完整性。
3.5 RT-PCR验证
以Oligo(dT)为引物,1 μg总RNA,用TaKaRa公司的Reverse Transcriptase XL (AMV)反转录酶进行反转录,得到cDNA第一链。根据神秘果素序列(GenBank accession number AB512278)设计引物(上游引物FP: 5’-CTCTGCATTGTTGGCAGCAG-3’; 下游引物RP: 5’- GGAGCTGATCATACATGAGATG-3’)进行PCR反应,反应体系为:1 μg DNA模板,各1 μL FP/RP (10 mmol/L),2 μL dNTP mix (2.5 mmol/L),2.5 μL 10×Buffer,1U KOD-Plus,ddH2O 补充至总体积25 μL。PCR扩增程序为:94℃预变性4 min;94℃变性30 s,56℃退火30 s,68℃延伸1 min,35个循环;68℃终延伸10 min。扩增产物进行1.2%琼脂糖凝胶电泳检测。
作者贡献
谭才邓主要负责实验的完成及论文写作;李静和邓毛程参与部分实验并提出部分建议。
致谢
本研究获得广东高校特色调味品工程技术开发中心开放课题项目(编号: GCZX-B1103)资助。
He J.X., Chen L., Guo X.L., Yu Y.J., and Yang L., 2010, An improved method for extraction RNA from tomato fruit, Shenwu Jishu Tongbao (Biotechnology Bulletin), 8: 150-152 (何健行, 陈乐, 郭新伦, 余有见, 杨玲, 2010, 番茄果实总RNA提取方法的优化, 生物技术通报, 8: 150-152)
Hiwasa-Tanase K., Hirai T., Kato K., Narendra D., and Ezura H., 2012, From miracle fruit to transgenic tomato: Mass production of the taste-modifying protein miraculin in transgenic plants, Plant Cell Rep., 31(3): 513-525
Li H., 1999, The difficulties in the isolation of RNA from plant tissues and their resolving strategies, Shenwu Jishu Tongbao (Biotechnology Information), 1: 38-41 (李宏, 1999, 植物组织RNA提取的难点及对策, 生物技术通报, 1: 38-41)
Pei J.B., Li X.Y., and Li Y.D., 2012, Study on total RNA isolation from blueberry (Vaccinium corymbosum L.) fruit, Dongbei Nongye Daxue Xuebao (Journal of Northeast Agricultural University), 43(10): 30-34 (裴嘉博, 李晓艳, 李亚东, 2012, 越橘果实总RNA提取方法比较研究, 东北农业大学学报, 43(10): 30-34)
Zhang L., Lin S.Q., and Yang X.H., 2012, Extraction of total RNA from loquat fruit and cloning of phytoene synthase gene fragment, Guoshu Xuebao (Journal of Fruit Science), 29(4): 577-582 (张玲, 林顺权, 杨向晖, 2012, 枇杷果实总RNA的提取及八氢番茄红素合成酶基因(PSY)片段的克隆, 果树学报, 29(4): 577-582)
Zhou B., Zhang Y., and Li Y.H., 2004, Improvement of extraction method of total RNA from strawberry fruit with abundant polymeric carbohydrates, Shengwu Jishu Tongxun (Letters in Biotechnology), 15(1): 48-50 (周波, 张旸, 李玉花, 2004, 富含多糖草莓果实总RNA提取方法的改进, 生物技术通讯, 15(1): 48-50)