河北联合大学生命科学学院, 唐山, 063000
 作者
作者  通讯作者
通讯作者
植物药与药理学杂志, 2015 年, 第 4 卷, 第 4 篇 doi: 10.13417/j.gab.034.000560
收稿日期: 2015年03月28日 接受日期: 2015年03月30日 发表日期: 2015年03月07日
 作者
作者  通讯作者
通讯作者
植物药与药理学杂志, 2015 年, 第 4 卷, 第 4 篇 doi: 10.13417/j.gab.034.000560
收稿日期: 2015年03月28日 接受日期: 2015年03月30日 发表日期: 2015年03月07日
© 2015 BioPublisher 生命科学中文期刊出版平台
本文首次发表在 《基因组学与应用生物学》上。现依据版权所有人授权的许可协议,采用 Creative Commons Attribution License,协议对其进行授权,再次发表与传播。只要对原作有恰当的引用, 版权所有人允许并同意第三方无条件的使用与传播。
推荐引用:
引用格式(中文):
李非非等, 2015, 刺五加HMGR基因的表达及其对皂苷合成的影响, 植物药与药理学杂志(online) Vol.4 No.4 pp.1-5 (doi: 10.13417/j.gab.034.000560)
引用格式(英文):
Li F.F. et al., 2015, Expression of 3-Hydroxy-3-Methylglutaryl coenzyme A gene in Eleutherococcus senticosus and its influence on saponins synthesis, Zhiwuyao Yu Yaolixue Zazhi (online) Vol.4 No.4 pp.1-5 (doi: 10.13417/j.gab.034.000560)
摘要
以actin为内参基因,采用Real time PCR法分析产地、发育时期、器官以及茉莉酸甲酯(MeJA)对刺五加HMGR基因表达的影响,并采用分光光度法测定皂苷含量,利用SPSS 17.0软件分析两者的相关性。结果表明:HMGR基因在各器官中均有表达,相对表达量间差异较明显(p<0.05)。刺五加HMGR基因在盛花期表达量最大,叶片衰老期表达量最低。MeJA处理后显著提升了萌芽期至盛花期HMGR的表达量,而对果实快速生长期之后的影响较小。不同产地刺五加的HMGR基因表达量和总皂苷含量差异显著,而HMGR基因的表达量与总皂苷含量同升同降,存在极显著的正相关关系(p<0.01)。
关键词
刺五加;3-羟基-3-甲基戊二酰辅酶A;表达;皂苷
刺五加(Eleutherococcus senticosus (Rupr.et Maxim) Maxim)同人参为五加科植物,是我国珍贵药材,具有益气健脾、抗衰老、抗肿瘤、抗疲劳等功效(涂正伟等, 2011)。目前,以刺五加为材料的中成药种类颇多,如刺五加注射液等;加之以刺五加为材料的中医处方需求量也较大,导致刺五加供不应求(赵敏等, 2001)。本从调控刺五加苷生物合成途径的关键酶表达入手,深入揭示刺五加的主要药用成分的生物合成机理,从而为获得大量的刺五加药用成分奠定基础。
萜类化合物在植物生命过程中起着重要作用,其基本结构单元是类异戊二烯(郝金凤等, 2010)。在高等植物中,类异戊二烯代谢至少存在2条途径,其一为丙酮酸/磷酸甘油醛途径,其二为以甲羟戊酸(MVA)为前体的甲羟戊酸途径(Lichtenthaler et al., 1997),但三萜类化合物主要以甲羟戊酸途径合成(郝金凤等, 2010)。在三萜类化合物的MVA生物合成途径中,3-hydroxy-3-methylglutaryl coenzyme A (HMGR, 3-羟基-3-甲基戊二酰辅酶A还原酶)是MVA中最先起作用的关键酶,是植物代谢过程中重要的调控位点(Aquil et al., 2009)。刺五加HMGR基因cDNA全长序列已被克隆(邢朝斌等, 2012),但尚未有对刺五加HMGR基因的表达及其对皂苷合成的影响报道,因此本研究以actin为内参基因,利用Real time PCR技术,分析产地、生长发育时期、器官以及茉莉酸甲酯(methyl jasmonate, MeJA)对刺五加HMGR基因表达的影响及其与皂苷合成的相关关系,为通过基因工程手段提高刺五加中的三萜皂苷含量奠定基础。
1结果与分析
1.1 Real time PCR扩增效果的检测
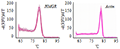
刺五加的HMGR和actin基因在Real time PCR扩增前期,基线平整,扩增区和指数区明显,Ct值介于23~33之间,无引物二聚体或非特异性引物等引起的杂峰,为理想的扩增曲线。在扩增后期,溶解曲线中出现单一的特异峰,说明产物单一,扩增特异性好(图1)。
|
图 1 HMGR和actin溶解曲线
Figure 1 Dissociation curve of HMGR and actin
|
1.2 HMGR在不同产地刺五加中的表达
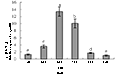
Real time PCR的结果显示,HMGR基因在不同产地刺五加中均有表达(图2),但表达量间的差异极其明显(p<0.05)。7个产地刺五加的HMGR相对表达量由高到低依次为穆棱>鸡西>本溪>伊通>梅河口>珲春>雾灵山,其中最大表达量(穆棱)是最小表达量(雾灵山)的19.05倍。
|
图 2 各产地来源刺五加的HMGR相对表达量
注: 不同小写字母表示差异显著, p<0.05, 下同
Figure 2 Relative expression of HMGR in different origin in E. Senticosus
Note: Different small letters represent significant difference, p<0.05, the same as blow
|
1.3 HMGR在刺五加各生长发育时期的表达
在萌芽期(4月26日)至盛花期(6月26日),刺五加HMGR的表达量显著升高,此后,直至叶片衰老期(9月26日),又显著降低,且各期的表达量间存在显著性差异(p<0.05, 图3),其中盛花期的表达量最高,叶片衰老期的表达量最低,两者相差13.4倍。
|
图 3 图 3 HMGR在不同发育时期刺五加中相对表达量
Figure 3 Relative expression of HMGR in different growth periods in E. senticosus
|
1.4 MeJA处理刺五加后HMGR的表达分析
MeJA处理后,自萌芽期到叶片衰老期HMGR基因相对表达量呈先升后降趋势(图4)。果实快速生长期(7月26日)、果实成熟期(8月26日)和叶片衰老期,MeJA处理与否差异不明显。在萌芽期、叶片完全展开期(5月26日)、盛花期,MeJA处理后HMGR基因的相对表达量显著提高。其提升的最大值出现在叶片完全展开期,两者相差176.3倍。
|
图 4 MeJA处理刺五加后HMGR的相对表达量
Figure 4 The relative expression of HMGR treated by MeJA in E. Senticosus
|
1.5 HMGR在刺五加不同器官中的表达
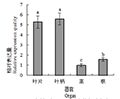
刺五加的叶片、叶柄、茎和根中均有HMGR的表达,但各器官中的表达量差异显著(p<0.05)。不同器官中刺五加HMGR基因的相对表达量由高到低依次为:叶柄>叶片>根>茎,其中最大表达量(叶柄)是最低表达量(茎)的5.27倍(图5)。
|
图 5 HMGR在刺五加不同器官中的相对表达量
Figure 5 In different organ of E. Senticosus the relative expression of HMGR
|
1.6 HMGR基因表达对刺五加总皂苷含量的影响
所测不同产地刺五加样本的总皂苷含量依次为:穆棱(4.80 g/100 g)>鸡西(4.74 g/100 g)>本溪(3.25 g/100 g)>伊通(3.12 g/100 g)>珲春(2.40 g/100 g)>雾灵山(1.89 g/100 g)>梅河口(1.69 g/100 g)。其中皂苷含量最大值(穆棱)为最小值(梅河口)2.84倍。各产地刺五加的皂苷含量与其对应的HMGR基因表达量间同升同降,相关系数为r=0.941,SPSS 17.0软件分析的结果显示,两者具有极显著的正相关关系(P<0.01)。以X为刺五加HMGR的表达量,Y为刺五加的皂苷含量建立的两者间的回归方程为:Y=0.182 6X+1.680 1。
2讨论
调控萜类化合物生成、功能和结构的酶在生物合成途径中存在很多,但关键酶是决定下游萜类化合物的组成和含量的主导因子(Cao et al., 2010)。HMGR被认为是甲羟戊酸途径中第一个限速酶,是萜类化合物代谢活动中重要的调控位点,其决定“碳流”的方向(Aquil et al., 2009)。已在马铃薯中发现该基因的1个cDNA片段,命名为HMGR-c2,此基因在马铃薯的根、茎、叶中均表达,其叶片的表达量最高,根和茎次之(陈大华等, 2000);刺五加的HMGR基因在根、幼茎、叶片和叶柄中也均有表达,其叶柄、叶片表达量较高,根和茎次之,与马铃薯HMGR-c2基因的表达特点基本相同。
一般认为,MeJA被植物吸收后,可提高特定功能基因的表达量,进而影响植物的代谢(Vom Endt et al, 2007)。如喷施MeJA后,可以激活稠李(Padus racemosa Gilib.)植物体内的三萜皂苷的关键酶——β-香树素合成酶基因。刺五加的实验结果与此相似,即,MeJA可显著提高刺五加HMGR基因表达量。所不同的是,MeJA处理后仅在处理前期(萌芽期, 叶片展开期, 盛花期)显著提高了HMGR的表达水平,而此后与对照组间差异不显著。
已有实验证实,番茄在早期的果实发育中HMGR表达量较高,在成熟期番茄的果实HMGR表达量性表达较低,而甜瓜果实的HMGR表达量与其大小密切相关(郝金凤等, 2010)。HMGR基因在不同生长发育时期中呈现“低-高-低-高”变化趋势,在盛花期HMGR表达量最高,但与刺五加总皂苷含量的变化趋势基本吻合(邢朝斌等, 2012)。同时,表达量分析和含量测定的结果表明,虽然两者在刺五加各样本间显著不同,但HMGR的表达量始终与对应样本的皂苷含量始终同升同降,具有极显著的正相关关系(p<0.01),相关系数达r=0.941。这表明,HMGR是催化刺五加中皂苷生物合成的关键酶之一。
3材料与方法
3.1材料
为了便于对结果进行比较,参照文献(邢朝斌等, 2012; 修乐山等, 2014)中的材料,以采自穆棱、珲春、梅河口、伊通,本溪、鸡西和雾灵山的刺五加作为试材。分别于2013年4~9月的26日采集各样本的叶片,同时在7月26日收集伊通产地刺五加的根、茎和叶柄作为实验材料。
3.2 MeJA处理
自刺五加萌芽(4月15日)后,以产地穆棱的刺五加为试材,对全株的叶片喷施5 mmol/L MeJA,共计喷洒3次,间隔5 d,并以dd H2O进行平行处理,作为对照。
3.3 cDNA的获得与引物
根据已克隆的刺五加HMGR基因(GenBank登录号: JQ905593, 邢朝斌等, 2012)、actin基因(GenBank登录号: KC469585)的序列,设计特异性引物。扩增刺五加HMGR的上下游引物分别为5'- GGATTGAAGGGCGAGGAAA-3'、5'-GCAACAGCAGAACCAGCAAG-3',扩增长度为136 bp。扩增刺五加actin基因的上下游引物分别为5'-GCAAGAGCTTGAAACAGCAAAG-3'、5'- TCAAAGATGGCTGGAAAAGGA-3',预计扩增长度为128 bp (吴鹏等, 2014)。将 3' RACE 和 5' RACE 扩增产物测序后拼接获得完整的 SAD 基因序列,根据 NCBI 分析所得 ORF设计 SAD 基因全长引物(上游引物: 5'-ATGGGGATTGTTCAACTCACTTT-3'; 下游引物: 5'-TTAAAGCTGTACTTGTCTGTCGAAA-3'),以黄连木种子 c DNA 为模板进行 PCR 扩增。引物合成和测序分别由上海生工和金唯智生物科技(北京)有限公司完成。
3.4 Real time PCR与含量分析
以刺五加的cDNA为模板,分别利用HMGR和actin的特异性引物进行PCR扩增,回收、纯化后得到含高浓度HMGR和actin DNA的溶液。将其以1×、10×、100×、1 000×和10 000×共5个浓度进行稀释,用于标准曲线的制作。按照TaKaRa公司SYBR® Premix Ex Taq™ II的说明,利用ABI 7900 HT进行real time PCR反应,扩增各样本刺五加的HMGR和actin基因。反应体系共10 μL,其中cDNA模板为0.5 μL、上下游引物各0.2 μL、SYBR® Premix Ex Taq™ II 5 μL、ROX reference dye 0.2 μL、dd H2O 3.9 μL。反应条件为:94 ℃ 30 s,之后95 ℃ 5 s、58 ℃ 30 s、72 ℃ 15 s,循环40次。参照文献的方法(吴鹏等, 2014; 修乐山等, 2014),计算各样本刺五加中HMGR基因的相对表达量。
作者贡献
HMGR和actin基因的real time PCR和论文初稿主要由第一作者李非非完成;实验的总体设计与论文的修改由通讯作者邢朝斌负责;杨果和吴鹏参与了皂苷含量测定和数据分析的工作。
致谢
本研究由河北省大学生创新创业训练计划(201410081064)、河北联合大学大学生创新性实验计划(X2014036)、河北省自然科学基金-石药集团医药联合研究基金(H2012401006)、河北省教育厅资助科研项目(QN2014102)和河北联合大学培育基金(GP201306)共同资助。感谢河北联合大学生科院实验室的龙月红实验师及生物技术专业2014级尤鹏生和李志栋同学在实验过程中给予的无私帮助。
Aquil S., Husaini A.M., Abdin M.Z., and Rather G.M., 2009, Over expression of the HMG-CoA reductase gene leads to enhanced artemisinin biosynthesis in transgenic Artemisia annua plants, Planta Med., 75(13): 1453-1458
Cao X.Y., Zong Z.M., Ju X.Y., Sun Y., Dai C.C., Liu Q., and Jiang J.H., 2010, Molecular cloning, characterization and function analysis of the gene encoding HMG-CoA reductase from Euphorbia pekinensis Rupr., Mol. Biol. Rep., 37(3): 1559-1567
Chen D.H., Ye H.C., Li G.F., and Liu Y., 2000, Cloning and sequencing of HMGR gene of Solanum tuberosum and its expression pattern, Zhiwu Xuebao (Acta Botanica Sinica), 42(7): 724-727 (陈大华, 叶和春, 李国凤, 刘彦, 2000, 马铃薯HMGR基因的克隆、序列分析及其表达特征, 植物学报, 42(7): 724-727)
Hao J.F., Li T.T., Guo Y.Q., Gao F., and Hasi A.G.L., 2010, Cloning and sequence analysis of the 3-hydroxy-3-methylglutaryl coenzyme-A reductase gene cDNA from melon cultivar hetao (Cucumis melo L.), Shengwu Jishu Tongbao (Biotechnology Bulletin), (8): 106-109, 115 (郝金凤, 李彤彤, 郭艳琼, 高峰, 哈斯阿古拉, 2010, 甜瓜HMGR基因全长cDNA的克隆及序列分析, 生物技术通报, (8): 106-109, 115)
Lichtenthaler H.K., Schwender J., Disch A., and Rohmer M., 1997, Biosynthesis of isoprenoids in higher plant chloroplasts proceeds via a mevalonate-independent pathway, FEBS Lett., 400(3): 271-274
Tu Z.W., Zhou W.W., Shan Q., Xin N., and Hou W.B., 2011, Advances in studies on chemical constituents of Acanthopanax senticosus and their pharmacological effects, Yaowu Pingjia Yanjiu (Drug Evaluation Research), 34(3): 213-216 (涂正伟, 周渭渭, 单淇, 辛宁, 侯文彬, 2011, 刺五加的研究进展, 药物评价研究, 34(3): 213-216)
Vom Endt D., Soares e Silva M., Kijne J.W., Pasquali G., and Memelink J., 2007, Identification of a bipartite jasmonate-responsive promoter element in the Catharanthus roseus ORCA3 transcription factor gene that interacts specifically with AT-hook DNA-binding proteins, Plant Physiol., 144(3): 1680-1689
Wu P., Gu J.T., Xiu L.S., and Xing Z.B., 2014, Differential expression of Eleutherococcus senticosus P450 gene in time and space and the correlation analysis between expression level of E. senticosus P450 gene and saponins content, Hebei Nongye Daxue Xuebao (Journal of Agricultural University of Hebei), 37(3): 29-33 (吴鹏, 谷俊涛, 修乐山, 邢朝斌, 2014, 刺五加P450基因时空表达差异及与皂苷含量的相关性分析, 河北农业大学学报, 37(3): 29-33)
Xing Z.B., Wu P., Long Y.H., He S., and Xiu L.S., 2012, Cloning and expression analysis of 3-hydroxy-3-methylglutaryl coenzyme A reductase in Eleutherococcus senticosus, Jiangsu Nongye Xuebao (Jiangsu Journal of Agricultural Sciences), 28(6): 1258-1262 (邢朝斌, 吴鹏, 龙月红, 何闪, 修乐山, 2012, 刺五加HMGR基因的克隆与表达分析, 江苏农业学报, 28(6): 1258-1262)
Xiu L.S., Li F.F., Zhou M., and Xing Z.B., 2014, Expression of glycosyltransferase gene in Eleutherococcus senticosus and its influence on saponins content, Jiyinzuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 33(1): 128-132 (修乐山, 李非非, 周秘, 邢朝斌, 2014, 刺五加糖基转移酶基因的表达及其对皂苷含量的影响, 基因组学与应用生物学, 33(1): 128-132)
Zhao M., Wang Y., and Kang L., 2001, Study on activity of inner inhibitory substances of Acanthopanax senticosus (Rupr.et Maxim) Harms fruits and seeds, Zhongguo Zhongyao Zazhi (China Journal of Chinese Materia Medica), 26(8): 534-538 (赵敏, 王炎, 康莉, 2001, 刺五加果实及种子内源萌发抑制物质活性的研究, 中国中药杂志, 26(8): 534-538)
植物药与药理学杂志
• 第 4 卷