2 仲恺农业工程学院生命科学学院, 广州 510225;
3广东省农科院科技情报研究所, 广州, 510640
 作者
作者  通讯作者
通讯作者
植物药与药理学杂志, 2012 年, 第 1 卷, 第 2 篇
收稿日期: 2012年10月05日 接受日期: 2012年10月16日 发表日期: 2012年10月28日
引用格式(中文):
林春华等, 2012, SRAP分子标记分析体系的建立及白簕资源亲缘关系分析, 基因组学与应用生物学, 31(5): 498-504 (doi: 10.3969/gab.031.000498)
引用格式(英文):
Lin et al., 2012, Optimization of SRAP-PCR System for Phylogenetic Analysis of Acanthopanax trifoliatus Species, Genomics and Applied Biology, 31(5): 498-504(doi: 10.3969/gab.031.000498)
本实验对影响SRAP-PCR体系中的Mg2+、dNTPs和引物浓度等因子进行了体系优化,建立了一套适合白簕SRAP检测的25μl反应体系:1.5 mmol/l Mg2+,1.5 mmol/L dNTPs,1 µmol/L引物,10 ng模板DNA,1.5 U Taq DNA聚合酶;进一步以白梗簕菜为模板,利用优化的体系进行多态性标记引物组合分析,共筛选出17对引物;利用这些引物对7个白簕品种进行SRAP遗传多样性分析,共扩增出461条谱带。其中多态性谱带155条,多态性谱带比率为33.6%,白簕品种间的相似系数为0.7077~0.9474。经UPGMA聚类分析结果显示,所检测的7个白簕品种分为二大类,其中亲缘关系较近的青梗簕菜和细叶密刺簕菜聚成了一组;而其余的四个种,包括白梗簕菜、细叶小刺簕菜、紫柄簕菜、大叶大刺簕菜和红梗簕菜,聚成另一组。
菊白簕(Acanthopanax trifoliatus (Linn.) Merr.),别名鹅掌簕、禾掌簕,三加皮,三叶五加。为五加科(Araliaceae)攀援状灌木。广泛分布于我国中部及南部,生于村落、山坡路旁、林缘和灌丛中,垂直分布于海平面以上至3200米。簕菜在印度、越南、菲律宾也有分布(中国植物志, 1978)。白簕为民间常用草药,有舒筋活络、祛风除湿、理气、止咳之效(林春华等, 2009)。白簕也是一种营养和保健价值都很高的野生蔬菜,在广东恩平等地人们习惯将其叶和嫩茎炒食,或煮鲫鱼汤,做消除暑气的食疗汤水,还被加工成簕菜干和簕菜茶,颇受人民的喜爱。目前,国内外对白簕的研究重点在其化学成分分析和活性研究(倪娜等, 2006; 张秋燕等, 2004; 杜江等, 1992; 蔡凌云等, 2009; Phan Van et al, 2003; 蔡凌云等, 2009; 倪娜等, 2009; Kang et al, 1998; Park et al, 2004; Cai et al, 2003; 刘红波等, 2007; 中华人民共和国药典, 2005; 明·李时珍; 安士影等; 2009)。在白簕种质资源收集、引种、利用等研究鲜有报导,白簕人工栽培尚处于起步阶段,但生产上已出现品种混杂、优良资源逐渐贫乏的现状,这在很大程度上制约了白簕产业的发展。
本研究通过优化SRAP分子标记,建立了适合白簕资源的SRAP分析体系,开展了白簕植物的遗传多样性及亲缘关系研究,以期对白簕种质资源的保存、优良品种纯化以及杂交育种等工作提供参考依据;同时为有效鉴定白簕的种类、构建白簕资源的遗传图谱,及重要性状的标记定位等奠定基础。
1结果与分析
1.1 DNA提取与检测
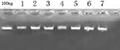 图1 DNA电泳检测图 |
由图1可见,利用改良CTAB法对簕菜资源进行基因组DNA提取,获得的条带清晰,杂质较少。完全可以满足进一步分子标记和PCR扩增的需要。
1.2均匀设计结果分析
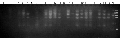 图2 应用均匀设计方案得到的各处理扩增结果 |
由图2可见,在25个处理中,各处理Taq酶、模板DNA、dNTPs、引物、Mg2+浓度的组成不同,扩增结果表现出显著差异。其中1、2、4、8、10、15、21组合基本上扩增不出谱带。其它组合有扩增结果,从2次的重复结果来看,以11、12、13、20、21号处理的扩增结果相对较好,亮度和重复性好,其中以11号组合的带型清晰且稳定。11号组合的浓度为1.5 mmol/l Mg2+,1.5 mmol/L dNTPs,1 µmol/L引物,10 ng模板DNA,1.5 U Taq DNA聚合酶。利用该优化体系可进一步做分子标记分析。
1.3 SRAP引物筛选与分析
从99组SRAP引物组合中筛选出17个多态性较好的组合对7份材料进行分析,共扩增到461条谱带,其中多态性谱带155条,多态性谱带比率为33.6%,不同引物的扩增条带为7~12条,每个引物平均10条。
 图3 部分引物组合垂直电泳图 |
1.4白簕相关系数分析
分析结果表明:各材料之间的相关系数在0.7077~0.9474之间,其中材料4、5之间相似系数最高(0.9474),亲缘关系最近;材料3和7的相似系数最小(0.7077),亲缘关系最远。
.png) 表1 7份白簕材料之间的相似系数 |
1.5聚类分析
利用NTSYS2.1软件进行UPGMA法的聚类分析结果表明:7份供试材料分为2大类群,第一类群又分为2个亚类,第一亚类为白梗簕菜和细叶小刺簕菜,第二亚类为紫柄簕菜、大叶大刺簕菜和红梗簕菜;第二大类为青梗簕菜和细叶密刺簕菜。
 图4 7份白簕材料间的亲缘关系聚类分析 |
2讨论
利用SRAP分子标记对白簕资源进行遗传多样性分析,相比AFLP、SSR等分子标记更易于操作,引物利用率较高,且经济有效。本试验最终确定的白簕25 μL反应体系包括1.5 mmol/l Mg2+,1.5 mmol/L dNTPs,1 µmol/L引物,10 ng模板DNA,1.5 U Taq DNA聚合酶。优化后的体系能获得较清晰的扩增结果,每对引物扩增总数在10条左右,平均多态率为33.6%。文雁成等(2006)利用SRAP分析了中国甘蓝型油菜品种的遗传多样性,多态性比例平均为24%,王华忠等(2008)利用SRAP标记分析不同类型甜菜的遗传多样性,多态性带的比率平均为43.7%,任羽等(2008)利用SRAP分析了石解属植物亲缘关系,多态性比率平均为84.07%,可见本研究获得的多态性结果更接近于品种间SRAP分析的结果,将研究材料定位于栽培品种更合适。
本实验聚类分析表明,7份白簕资源共分为两大类,其中白梗与细叶小刺种、紫柄与大叶大刺及红梗种、青梗与细叶密刺种之间相关系数均较大,亲缘关系较近,这与其嫩芽分别为浅绿、红绿和绿色的形态学相一致;紫柄与青梗种、白梗和青梗种、红梗与白梗种、红梗与青梗种、细叶小刺与细叶密刺种之间的相关系数较小,亲缘关系较远,这与其嫩芽颜色差异悬殊也一致。说明白簕嫩芽颜色可作为白簕品种资源形态学分类的主要衡量指标之一。这为生产上单一从形态学进行分类和筛选优良品种提供理论指导,同时为杂交育种和制定形态学分类指标奠定基础。白簕是药食两用植物,不仅能用作蔬菜鲜食,对于医学和药学产业都有重要的作用(Phan et al, 2003)。因此,加强白簕的药食兼用产品研究和开发将成为重要课题。
3材料与方法
3.1实验材料
试验所用7份材料均于2010年春季采自广州市农科院恩平白簕基地,表2列出了七份材料的品种名及生物学性状。
.png) 表2 白簕材料 |
.png) 表3 白簕SRAP反应体系的优化 |
3.2实验方法
3.2.1 DNA提取与检测
从各组材料中挑选其幼嫩叶片,参照王丽等(2006)改良CTAB法提取白簕基因组DNA;再用0.8%的琼脂糖凝胶电泳检测DNA的浓度及纯度,检测后将每个样品浓度调至50ng/μL。
3.2.2 SRAP反应体系建立
本试验为均匀设计SRAP反应体系,参考郭凌飞等(2008)所用的方法,以1号白簕样品为模板,针对25 μL反应体系中5个因素(Taq DNA聚合酶、模板DNA、dNTPs、引物、Mg2+)各设定5个水平,建立U25(55)均匀设计表,各因素水平详见表3(表中所选用引物为me5em5)。
以上所有PCR扩增反应在MasterCycler Gradient梯度PCR仪(Eppendorf)上完成。SRAP扩增程序参照乔燕春等(2008)在枇杷上确定的PCR反应程序并略为优化,优化的扩增程序为:94℃ 5min,一个循环;94℃ 1min, 35℃ 1min, 72℃ 1.5min,5个循环;94℃ 1min, 50℃ 1min, 72℃ 1.5min, 35个循环;72℃延伸10 min。扩增结束后,抽取10 μL的PCR产物,加入2 μL上样缓冲液,用2%琼脂糖凝胶(含GoldView)在0.5×TBE中以120V电压下电泳2 h。然后在凝胶成像系统上检测并拍照。
3.2.3引物筛选
供试引物为9条正向引物和11条反向引物(序列见表4),每条正向引物都与11条反向引物配对,组成99组引物组合,以1号样品DNA为模板,分别对99个引物组合进行PCR扩增反应,筛选出扩增清晰的引物组合,然后用选出的7组DNA样品进一步检验这些标记是否有多态性。
.png) 表4 应用引物序列 |
3.2.4 遗传多样性分析
用筛选出的引物对7份白簕材料进行扩增及4%聚丙烯酰胺凝胶电泳分析,拍照并统计结果。采用NTSYS2.1 软件进行UPGMA法的聚类分析,并得出7份材料的遗传距离。
作者贡献
林春华为本研究的主要执行人,负责实验设计、数据整理及撰写论文;林伟君为本论文的通讯作者,负责论文的修改和审核;李兆龙和乔燕春两位作者负责大部分实验内容的操作;刘自珠和谭雪两位作者为本研究的各项实验提供协助及建议。
致谢
本研究由广东省科技攻关项目(2008B021500011)、广东省教育部产学研结合项目(2010B090400492)共同资助。感谢贺立红副教授对本研究的帮助;感谢恩平白簕基地多年的业务合作和技术支持。
参考文献
An S., Qian S., Jiang J., and Wang K.. 2009. Chemical constituents in leaves of Acanthopanax gracilistylus.Chinese Traditional and Herbal Drugs, 10(40), 1529(安士影, 钱士辉, 蒋建勤. 2009.细柱五加叶的化学成分. 中草药, 10(40), 1529)
Cai L., Li Y., Chen J, Tian M., and Du W.. 2009. Polysaccharide extraction technology and content of Acanthopanan trifoliatus. Chinese Journal of Spectroscopy Laboratory, 2: 79-80(蔡凌云,黎云祥, 陈蕉,田茂洁,杜武庭. 2009.白簕多糖的提取工艺和含量比较.光谱实验室,2:79-80)
Cai Ling-yun, Li Run-xiang. Microwaveassisted technology of total flavonoids from root bark of Acanthopanax trifoliatus. Food Science, 2009, 30(4): 44(蔡凌云, 黎云祥. 2009. 白簕根皮总黄酮提取工艺研究. 食品科学, 30(4): 44)
Cai X., Shen G., Nguyen T.. 2003. Inhibitory effect of kaurane type diterpenoids from Acanthopanax koreanum on TNF-α secretion from trypsin-stimulated HMC-1 cells. Archives of Pharmacal Research, 26(9): 731-734
Chinese Academy of Sciences, China Flora Editorial Committee. 1978. Flora of China (Vol. 54). Beijing: Science Press, 112-113(中国科学院中国植物志编辑委员会. 1978. 中国植物志(第五十四卷). 北京: 科学出版社, 112-113)
Du J and Gao L. 1992. Chemical constituents of the leaves of Acanthopanax trifoliatus (Linn) Merr.. China Journal of Chinese Materia Medica, 17(6):356-357(杜江, 高林.1992.白簕叶的化学成分研究. 中国中医药杂志, 17(6):356-357)
Guo L., Zou M., Du L., Zeng H and Lu C.. 2008. Optimization of the sequence-related amplified polymorphism(SRAP)reaction system for macadamia by uniform design. Journal of Fruit Science, 25(2): 250-253(郭凌飞, 邹明宏, 杜丽清, 曾辉, 陆超忠. 2008. 均匀设计优化澳洲坚果SRAP反应体系. 果树学报, 25(2): 250-253)
Kang H., Song H., Lee J.. 1998. Effects of acanthoic acid on TNF-alpha gene expression and haptoglobin synthesis. Mediators Inflamm, 7(6): 257-259
Lin C., Lin W., Tan X , Li X and Qiu J. 2009. Quality and acute toxication test of a wild vegetable acanthopanax trifoliatus. Modern Food Science and Technology, 2 (25):201-202,171 (林春华, 林伟君, 谭雪, 李雪壮, 仇洁. 2009. 野生蔬菜簕菜品质及急性毒性试验研究. 现代食品科技, 2 (25):201-202转171)
Liu H.. 2007. Studies on the function of mediators of inflammation HMGB1 in advanced stage of fulminant hepatic failure and screening for anti-HMGB1 drugs. Changsha: Xiangya School of Medicine, Central South University(刘红波. 2007. 晚期炎症介质HMGB1在暴发性肝衰竭发展中的作用及抗HMGB1药物的初步筛选. 长沙: 中南大学湘雅医学院)
Ni N. and Liu X.. 2006. Advances in studies on plants of Acanthopanax Miq. in Araliaceae . Chinese Traditional and Herbal Drugs, 37(12): 1895, 1897(倪娜, 刘向前. 2006. 五加科五加属植物的研究进展. 中草药, 37(12): 1895, 1897)
Ni N., Liu X and Zhang X.. 2009. Determination of acanthoic acid and kaurenoic acid from root barks of eight kinds of Acanthopanax Miq. Plants by RP-HPLC Journal of Central South University (Science and Technology), 5 (40): 1216(倪娜, 刘向前, 张晓丹. 2009. 8种五加属植物根皮中五加酸和贝壳烯酸的RP-HPLC法定量分析. 中南大学学报(自然科学版), 5 (40): 1216)
Park E., Zhao Y. and Kim Y.. 2004. Acanthoic acid from acanthopanax koreanum protects against liver injury induced by tert-butyl hydroperoxide or carbon tetrachloride in vitro and in vivo. Planta Medica, 70(5): 321-327
Phan V. and Chau V.. 2003. Two new phenylpropanoid glycosides from the stem bark of Acanthopanax trifoliatus. Archibes of Pharmacal Research, 26(12): 1014
Phan V. ,Chau V., Cai X.. 2003. A New 24-Nor-Lupane-Glycoside of Acanthopanax trifoliatus. Arch Pharm Res, 26(9):706-708
Prepared by Chinese pharmacopoeia commission. 2005. Pharmacopoeia of the People’s Republic of China (first volume). Beijing: Chemical Industry Press, 44(国家药典委员会编. 2005. 中华人民共和国药典(一部). 北京: 化学工业出版社, 44)
QiaoY., Lin S., Liu C.,Yang X..2008. Optimization of SRAP analysis and its application in germplasm research of Loquat (Eriobotrya japonica). Journal of Fruit Science, 25(3): 348-352 (乔燕春, 林顺权, 刘成明, 杨向晖. 2008. SRAP分析体系的优化及在枇杷种质资源研究上的应用. 果树学报, 25(3): 348-352.)
Ren Y, Yin J., Yang G.. 2008. Analysis of genetic relationship of dendrobium in hainan by SRAP Makers. Chinese Journal of Tropical Crops, 29(6):767-770 (任羽, 尹俊梅, 杨光穗. 2008. 海南石解属植物亲缘关系的SRAP分析. 热带作物学报. 29(6):767-770)
The Ming Dynasty· Li S., Compendium of materia medica (last volume). Huaxia Publishing House: 1413-1414(明·李时珍. 本草纲目(下册). 华夏出版社: 1413-1414)
Wang H., Wu Z., Wang X., Fang Z.. 2008. Analysis of the genetic diversity in different types of sugar beets by SRAP and SSR markers. Acta Agronoomica Sinica. 34(1): 37-46(王华忠, 吴则东, 王晓武, 方智远. 利用SRAP与SSR标记分析不同类型甜菜的遗传多样性. 作物学报, 2008, 34(1): 37-46)
Wang L. Qiao A., SunY.. Sun M. 2006. Extraction of Genomic DNA from flowering Chinese cabbage and optimization of RAPD reaction system. Journal of Southwest China Normal University(Natural Science), 31(2): 124-128(王丽, 乔爱民, 孙一铭, 孙明. 2006. 菜心基因组DNA提取及RAPD反应体系的优化. 西南师范大学学报, 31(2): 124-128)
Wen Y., Wang H., Shen J., Liu G., Zhang S.. 2006. Analysis of genetic diversity and genetic basis of Chinese rapeseed cultivars (Brassica napus L.) by sequence-related amplified polymorphism markers. Scientia Agrcultura Sinica, 39(2): 246-256(文雁成, 王汉中, 沈金雄,刘贵华,张书芬. 2006. 用SRAP标记分析中国甘蓝型油菜品种的遗传多样性和遗传基础. 中国农业科学, 39(2): 246-256)
Zhang Q., Zhang F.. 2003. Analyzing on the health protection function of wild vegetable of Acanthopanax trifoliatus(L)Merr. Food Research and Development, 24(3): 66-67(张秋燕, 张福平. 2003. 野生保健蔬菜—白簕. 食品研究与开发, 24(3): 66-67)