 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2010 年, 第 8 卷, 第 11 篇 doi: 10.5376/mpb.cn.2010.08.0011
收稿日期: 2010年09月21日 接受日期: 2010年10月27日 发表日期: 2010年11月06日
胡春华等, 2010, rolC基因植物表达载体构建及其对野生蕉的转化, 分子植物育种 Vol.8 No.11 (doi: 10.5376/mpb.cn.2010.08.0011)
本研究利用Hind Ⅲ 和EcoRⅠ从植物表达载体 pBI121 中将 “35S-GUS-NOSt”片段切下并克隆到植物表达载体 pCAMBIA1301 上,构建成植物表达载体 pCB121。在此基础上,根据GenBank公布的rolC序列设计引物,采用PCR方法从Ri质粒中克隆获得rolC基因并将其插入到植物表达载体pCB121的XbaⅠ和SacⅠ位点。利用根癌农杆菌介导,将rolC基因转化野生蕉(Musa itinerans Cheesm.)胚性细胞悬浮系。通过GUS组织染色检测、PCR和RT-PCR方法对再生苗鉴定,结果表明rolC基因已经成功转入到野生蕉中并获得表达,转rolC基因生根能力有所提高。试验结果为下一步将该基因转化香蕉其它栽培品种提供了技术参考。
香蕉(Musa spp.)属大型草本果树,是一种重要的热带水果和粮食作物。香蕉根系着生浅,叶柄、假茎无木质化,叶大易折、果穗长重,很易遭受强风、台风的危害。我国香蕉产区主要分布在沿海地区,台风频繁且又主要集中在香蕉迅速生长发育期,风害威胁着我国的香蕉产业的发展。因此,选育出矮杆抗风,根系发达的香蕉新品系是香蕉的育种目标之一。由于大多数香蕉栽培品种不育性和多倍性,难以通过常规育种方式进行种质改良,基因工程技术为香蕉育种提供了新的途径。
诱根质粒(Root inducing plasmid, Ri)来源于发根农杆菌(Agrobacterium rhizogenes),其中农杆碱型Ri质粒的TL-DNA上至少含有4个与毛根诱导有关的基因位点即rol (root loci) A、B、C 和D(White et al., 1985)。其中rolC基因是改良植物性状的重要基因,在园艺植物品种改良中有很大的应用价值。该基因转化烟草(章镇等,2001),猕猴桃(Rugini et al., 1991)、苹果(丛郁等,2006)、枳橙(胡春华等,2006)中,转基因植株均表现顶端优势减弱、分枝增多,节间缩短,树冠矮化紧凑,同时,转基因植株生根能力大大提高,根系活力增强。
本试验拟将Ri质粒上决定植物毛根形成并影响植株形态的rolC基因进行克隆并将其转入到野生蕉胚性细胞悬浮系(embryogenic cell suspensions, ECS)中,通过对转基因香蕉的分子鉴定和外源基因表达分析以及形态学等方面的观测,探求rolC基因对野生蕉生物学特性的影响,以期为下一阶段利用该基因转化香蕉栽培品种,为筛选出矮化、根系发达的香蕉新种质提供技术参考。
1 结果与分析
1.1植物表达载体pCB121的构建
将植物表达载体pBI121用Hind Ⅲ和EcoRⅠ双酶切回收后的小片段(35S-GUS-NOSt)与经过相同双酶切的pCAMBIA1301大片段进行连接,转化大肠杆菌感受态DH5α,在附加50 mg/L卡那霉素的LB琼脂平板上长出了阳性菌落,挑单菌落摇菌,少量提取重组质粒并用Hind Ⅲ和EcoRⅠ双酶切,可以切下约3 kb的与预期大小相符的片段(图1),表明植物表达载体pBI121上的双酶切小片段(35S-GUS-NOSt)成功插入到pCAMBIA1301的预期位点。重组植物表达载体命名为pCB121。
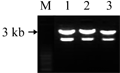 图1 pCB121质粒双酶切鉴定 Figure 1 Identification of recombinant plasmid pCB121 with digestion |
1.2 rolC基因的克隆及植物表达载体构建
以Ri质粒为模板,以rolC特异引物进行PCR扩增,PCR扩增产物经电泳获得1条约550 bp的条带(图2),与预期大小一致。回收并将其克隆到pGEM-T载体中获得重组质粒pGEM-rolC。测序结果表明,获得了rolC基因包含起始密码子和终止密码子在内的完整的编码区,序列与GenBank公布的rolC基因(GenBank accession No. X64255)序列完全一致。
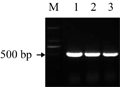 图2 rolC基因PCR扩增图 Figure 2 PCR amplification of the rolC gene |
将rolC基因用XbaⅠ和SacⅠ双酶切从pGEM-rolC质粒中切下,与经过相同双酶切的植物表达载体pCB121连接,转化大肠杆菌感受态DH5α,挑阳性菌落摇菌提取质粒,用Xba Ⅰ和SacⅠ双酶切,可以释放出1条约550 bp的条带(图3),结果表明,该重组质粒即为所需阳性克隆,并将其命名为pCB121-rolC。
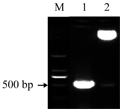 图3 重组质粒pCB121-rolC双酶切鉴定 Figure 3 Identification of pCB121-rolC plasmid with digestion |
采用农杆菌介导法进行rolC基因转化野生蕉。野生蕉悬浮系与含rolC基因的农杆菌共培4 d后,经过GUS基因检测即可检测到GUS基因的表达。将共培后的ECS转接到的液体筛选培养基(含有潮霉素5 mg/L)进行抗性筛选,每10 d继代1次,经过3代筛选后的培养物用GUS组织染色。结果表明,获得的潮霉素抗性悬浮系几乎均能染上蓝色(图4-A),即经过抗性筛选获得了野生蕉转rolC基因的胚性细胞悬浮系。将转化胚性细胞悬浮系转入到胚诱导培养基上,诱导培养约60 d获得成熟体细胞胚(图4-B)。体胚经萌发,1个月后获得了生长正常的再生芽。
 图4 转rolC基因ECS GUS染色及抗性胚诱导 Figure 4 Transient GUS expression of the ECS with rolC gene and inducement of embryos |
取健壮的再生潮霉素抗性芽及对照芽转接到不含激素的MS基本培养基进行生根培养,期间观测其生根情况。30 d后将苗小心从瓶中取出,彻底洗净根上培养基,移栽至人工气候箱继续生长。
1.4 转rolC基因野生蕉PCR分子鉴定、GUS和rolC基因表达分析
取再生转化苗的根部和叶片进行GUS基因表达分析,GUS基因在转rolC基因再生苗的根和叶片部位均能检测到GUS基因的表达(图5),说明GUS基因已经整合到野生蕉的基因组中并能够成功表达。同时,以具有GUS活性的转化野蕉总DNA为模板,以未经转化的材料和质粒pCB121-rolC作为对照,用rolC基因特异引物进行了PCR分子检测,从PCR扩增产物电泳结果可知(图6),转化野蕉总DNA均可获得大小约为550bp的的特异性条带,而对照则无,说明rolC基因已整合到野生蕉基因组中。
 图5 转rolC基因再生苗 GUS染色 Figure 5 Transient GUS expression of the wild banana with rolC gene |
图6 转rolC基因再生苗PCR检测 Figure 6 Detection of regenerated plants by PCR |
剪取6株GUS基因检测和PCR检测为阳性的转基因及1株对照野生蕉的新鲜叶片,提取总RNA, RT-PCR检测rolC的表达情况,发现6株GUS基因阳性植株均能获得550 bp的特异性条带(图7),与预期结果相符,进一步证明外源基因rolC已经整合到野生蕉的基因组中,并可以在转基因野生蕉中正常表达。
图7 转rolC基因再生苗 RT-PCR检测 Figure 7 RT-PCR analysis of the transgenic banana |
1.5 转rolC基因野生蕉根系与野生型植株根系的生根能力的比较
再生潮霉素抗性芽及对照芽转入到无激素生根培养基7-10 d左右,即可见到有根产生,转基因与对照根的出现时间差不多,但是,转rolC基因野生蕉在无激素的生根培养基中,根生长非常迅速,每株发根数在6-8条,色白,根长达到12 cm以上;而对照野生蕉根系生长缓慢,颜色由白变褐,每株根数在3-4条左右,最长根长不超过5 cm (图8)。该试验结果表明,转rolC基因野生蕉在无激素培养基上与对照相比,具有较强的发根能力。30 d 将再生苗移栽至人工气候箱,目前,已有20株转rolC基因野生蕉移栽成活,长势正常,拟作进一步的形态学观测和分子检测。
 图8 转rolC基因再生苗与对照根系比较 Figure 8 Root system of the rolC transgenic wild banana comparison with wild type |
2 讨论
成功的香蕉遗传转化体系依赖于高效的筛选体系,已有的试验表明,潮霉素最适合于用来做香蕉遗传转化的筛选抗生素(Sreeramanan et al., 2006),本试验将植物表达载体pBI121用Hind Ⅲ和EcoRⅠ双酶切得到的小片段(35S-GUS-NOSt)插入到植物表达载体pCAMBIA1301,改造构建了植物表达载体pCB121,该载体不仅利用了原载体pCAMBIA1301的潮霉素抗性基因,而且也利用了原载体pBI121的多克隆位点,可以方便地插入目的基因。同时,pCB121质粒含有两个GUS基因,该报告基因能够利用方便的GUS组织染色法进行检测转化植物的效果。但是,原pCAMBIA1301中的GUS基因含有两个exon,而原pBI121中GUS基因不含exon,由于后者能够在农杆菌中表达,在对转基因材料GUS染色时,会产生假阳性。因此,在插入目的基因的时候,一般把后者切去。本试验将rolC基因克隆到pCB121的XbaⅠ和SacⅠ位点构建成植物表达载体pCB121-rolC,该载体具有潮霉素抗性基因和GUS基因,可以非常方便的用来对香蕉的遗传转化。
本试验在前期建立的香蕉遗传转化体系的基础上(胡春华等,2010a),构建了rolC基因并将其转到了野生蕉中,通过对转基因野生蕉的GUS基因表达检测和rolC基因表达检测,证明rolC基因已经整合到野生蕉的基因中并能成功表达,同时也证明pCB121-rolC载体构建的正确性。前人对rolC基因导致植株生根能力提高的作用,在本试验的转基因野生蕉中也得到进一步的验证。下一步工作我们将继续对转rolC基因植株进行观测和评价,为将rolC基因转化香蕉栽培品种,筛选出矮化、根系发达的香蕉新种质提供参考。
3材料与方法
3.1供试材料与试剂
本实验中使用的植物表达载体pBI121和pCAMBIA1301,根癌农杆菌菌株EHA105,大肠杆菌菌株DH5α及Ri质粒等均为本试验室保存。植物材料野生蕉(Musa itinerans Cheesm.)胚性细胞悬浮系根据魏岳荣等(2006)利用未成熟合子胚诱导获得。
RNA提取试剂Trizol Reagent购自Invitrogen公司,pGEM-T载体购自Promega公司,T4 DNA连接酶、限制性内切酶以及反转录酶AMVRTase均购自TaKaRa公司,琼脂糖DNA回收试剂盒购自天根生化公司,其它化学试剂均为国产分析纯。
3.2引物设计
根据GenBank公布的rolC基因(GenBank accession No. X64255)序列,设计一对特异性引物:5′-gactctagaatggctgaagacgacctgtgt-3′;5′-cggagctcgccgattgcaaacttgcactc-3′,其中,上游引物和下游引物分别引入Xba Ⅰ和SacⅠ内切酶位点并加保护性碱基,引物由上海生工生物工程技术公司合成。
3.3 植物表达载体pCB121的构建
植物表达载体pBI121用Hind Ⅲ和EcoRⅠ完全双酶切,电泳回收pBI121双酶切约3 kb的小片段(35S-GUS-NOSt),并将其克隆到经过相同酶切的pCAMBIA1301上,转化大肠杆菌DH5α 感受态,提取质粒,对重组质粒进行酶切鉴定,将经过鉴定的重组子命名为pCB121。
3.4 rolC基因的克隆及植物表达载体构建
以Ri质粒为模板进行特异引物的PCR扩增。PCR扩增产物利用DNA回收试剂盒(购自天根生化公司)回收。将回收目的片段与pGEM-T载体(购自Promega公司)连接,连接产物转化大肠杆菌DH5α感受态细胞,蓝白斑筛选获得阳性克隆,取阳性克隆送上海生工生物工程技术公司测序。测序结果经BLAST检索序列数据库,确定所克隆的序列为rolC基因编码序列。之后用XbaⅠ和SacⅠ双酶切将rolC基因从T载体中切下,回收酶切目的基因片段,将其克隆到植物表达载体pCB121的XbaⅠ和SacⅠ位点,用特异引物对重组质粒进行PCR鉴定和XbaⅠ和SacⅠ双酶切鉴定,鉴定正确的阳性质粒重命名为pCB121-rolC,质粒pCB121-rolC用冻融法转化根癌农杆菌菌株EHA105。
3.5 rolC基因转化野生蕉胚性细胞悬浮系
以继代保持在M2液体培养基中野生蕉胚性悬浮细胞系为转化受体,利用农杆菌介导法将rolC基因转到野生蕉中。遗传转化及植株再生参照胡春华等(2010b)的方法进行。
3.6 GUS基因的检测
取与农杆菌共培养4 d之后的ECS、液体筛选培养的各代抗性ECS、再生抗性胚以及再生苗的叶和根进行GUS组织染色鉴定,以相应的未经转化的材料做对照。GUS基因瞬时表达检测参照Jefferson (1987)的组织化学染色法方法进行。
3.7 PCR分子鉴定
取经过GUS基因检测为阳性的再生香蕉叶片及对照叶片,采用改良CTAB方法(胡春华等, 2006)提取DNA,用rolC基因特异引物进行PCR扩增。PCR产物用1%琼脂糖凝胶电泳,凝胶成像系统照相,检测PCR结果。
3.8 RT-PCR检测rolC基因表达
取GUS染色和PCR鉴定均为阳性的转化再生苗及对照苗的新鲜叶片,用Trizol Reagent试剂(购自invitrogen公司)提取总RNA,以oligo (dT)为引物合成cDNA第一链,再按照如下的PCR反应体系和程序进行PCR扩增。PCR反应体系为25 μL:其中4 μL dNTPs (1 mmol/l),10×PCR Buffer 2.5 μL,上、下游特异引物(10 μmol/μL)各1.5 μL,反转录合成的cDNA 1 μL,Taq DNA聚合酶0.3 μL(3 U/μL),ddH2O 14.2 μL。PCR反应程序为:94 ℃预变性5 min;然后94 ℃变性30 sec,55 ℃退火30 sec,72 ℃延伸60 sec,35个循环,最后72 ℃延伸10 min。PCR扩增产物于1.2%的琼脂糖凝胶电泳检测。
参考文献
Cong Y., Sun A.J., Yao Q.H, Zhang Z., 2006, Study on the biology characteristics of rolC-transgenic Malus robusta Rehd. in vitro. Scientia Agricultura Sinica, 39(12): 2563-2569 (丛郁,孙爱君,姚泉洪, 章镇. 转rolC基因八棱海棠组培苗生物学特性的研究. 中国农业科学, 2006, 39(12): 2563-2569)
Hu C.H., Wei Y.R., Liu K., Yi G.J., Huang B.Z., Huang Y.H., 2010, Cloning of chitinase gene and its genetic transformation of wild banana (Musa itinerans Cheesm.), Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 8(4): 719-724 (胡春华, 魏岳荣, 刘凯, 易干军, 黄秉智, 黄永红, 2010, 几丁质酶基因克隆及其野生蕉转化, 分子植物育种, 8(4): 719-724)
Hu C.H., Wei Y.R., Yi G.J., Huang B.Z., Huang Y.H., 2010, Establishment of a high efficient agrobacterium-mediated transformation system for banana, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 8(1): 172-178 (胡春华, 魏岳荣, 易干军, 黄秉智, 黄永红, 2010, 根癌农杆菌介导的香蕉高效遗传转化系统的建立, 分子植物育种, 8(1): 172-178)
Hu C.H., Xie Y.M., Huang X.C., Guo C., Jiao L., Wu X.R., Deng Z. N., 2006, In vitro propagation of rol A, B, C transgenic citrange. Guoshu xuebao(Journal of Fruit Science), 23(1): 142-144(胡春华, 谢玉明, 黄训才, 郭琛, 邓子牛, 2006, 转rolA、B、C基因枳橙快繁技术, 果树学报, 23(1): 142-144)
Hu C.H., Deng Z.N., Gentile A., Xu Y., Xiong X.Y., 2006, Molecular Analysis, morphological and physiological evaluation of the transgenic citrange plants with rolA, rolB, rolC genes. Yuanyi xuebao(Acta Horticulture Scinica), 33(1): 130-133 (胡春华, 邓子牛, Gentile A., 徐艳, 熊兴耀. 2006, 转rol基因枳橙分子鉴定及部分生物学的观测, 园艺学报, 33 (1): 130-133)
Jefferson R.A., 1987, Assaying Chimeric genes in Plants: The GUS gene fusion System, Plant Molecular Biology Reporter, 5(4): 387-40 doi:10.1007/BF02667740
Rugini E., Pellegrineschi A., Mencuccini M., Mariotti D. Increase of rooting ability in the woody species kiwi (Actinidia deliciosa A. Chev.) by transformation with Agrobacterium rhizogenes rol genes. Plant cell report, 1991, 10: 291-295 doi:10.1007/BF00193144
Sreeramanan S., Mazial M., Abadullah M. P., Rosli N. M., Xavier R., 2006, Potential selectable marker for genetic transformation in banana. Biotechnology, 5(2): 189-197 doi:10.3923/biotech.2006.189.197
Wang L.R., Miao L.P., Zhang X.J., Yang M.S., 2010, Comparison of related traits among the transgenic poplar 741 with different rol gene. Journal of Plant Genetic Resources, 11 (4): 451-456(王连荣, 缪丽萍, 张晓军, 杨敏, 2010, 转不同rol基因741杨株系相关性状比较分析, 植物遗传资源学报, 11(4): 451-456)
Wei Y.R., Huang X.L., Huang B.Z., Yang H., Qiu J.S., Xu L.B., 2006, Establishment of embryogenic cell suspensions and regeneration of Musa itinerans from immature seeds, Guoshu xuebao(Journal of Fruit Science), 23(1): 41-45(魏岳荣, 黄学林, 黄秉智, 杨护, 邱继水, 许林兵, 2006, 利用未成熟种子建立野生阿宽蕉胚性细胞悬浮系和植株再生的研究, 果树学报, 23(1): 41-45)
White F. F., Taylor B. H., Huffman G.A., Gordon M. P., Nester E.W., 1985, Molecular and genetic analysis of the transferred DNA regions of the root-inducing plasmid of Agrobacterium rhizogenes . J Bacterio, 164(1): 33-44
Zhang Z., Sun A.J., Fang J.G., Shang B.C., 2001, Study on AgrobacteriunOmediated transformation of tobacco plant with rolC gene. Journal of Nanjing Agricultural University, 24(1): 25-29 (章镇, 孙爱君, 房经贵, 盛炳成, 2001, 农杆菌介导rolC基因转化烟草植株的研究, 南京农业大学学报, 24(1): 25-29)