 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2013 年, 第 11 卷, 第 16 篇 doi: 10.5376/mpb.cn.2013.11.0016
收稿日期: 2013年03月20日 接受日期: 2013年04月27日 发表日期: 2013年06月08日
引用格式(中文):
查中萍等, 2013, Bt水稻T1C-19中外源基因的三引物多重PCR检测方法, 分子植物育种(online), 11(16): 1106-1113 (doi: 10.5376/mpb.cn.2013.11.0016)
引用格式(英文):
Zha et al., 2013, A Tri-primer Multiplex PCR Method for the Exogenous Genes in Bt Rice T1C-19, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 11(16): 1106-1113 (doi: 10.5376/mpb.cn.2013.11.0016)
转cry1C基因水稻T1C-19是一个优良的抗螟虫水稻育种资源。本研究目的在于研发一种用于检测T1C-19及其衍生材料中外源基因的三引物多重PCR (polymerase chain reaction, PCR)检测方法。根据T1C-19中插入的外源基因序列和插入位点左右旁侧水稻基因组序列设计了3个PCR引物C1、C2和C3,并对多重PCR体系进行了优化。结果表明,0.5 μL 10 μmol/L C1+0.4 μL 10 μmol/L C2+0.2 μL 10 μmol/L C3的多重PCR体系可以准确区分cry1C基因纯合、杂合和阴性三种基因型,纯合体和阴性材料中均只扩增出一条DNA片段,纯合体中的片段大小为512 bp,而阴性材料中的片段大小为386 bp,杂合体中则同时扩增出这两条片段。该体系的建立为利用T1C-19进行抗螟虫水稻育种提供了一个简便有效的基因鉴定技术。
稻纵卷叶螟、二化螟和三化螟是水稻的主要害虫,其危害会造成叶片枯白、枯心苗、白穗,瘪谷大量增加,严重影响水稻产量。转Bt毒蛋白基因水稻对稻纵卷叶螟、二化螟和三化螟具有良好的抗性,种植Bt水稻既可以有效避免稻纵卷叶螟、二化螟和三化螟对水稻的危害,又可以减少杀虫剂的使用,减轻环境污染。水稻科学家们已经培育出一系列的转Bt基因水稻如转cry1A(b)/cry1A(c)融合基因水稻T51-1、T9-3,转cry2A基因水稻T2A-1,转cry1C基因水稻T1C-19等(Tu et al., 2000; Ye et al., 2001a; Chen et al., 2005; Tang et al., 2006),这些Bt水稻为培育抗螟虫水稻新品种提供了种质资源。在抗虫转基因水稻育种研究中,以Bt水稻作抗虫基因供体,优良常规水稻品种(品系)作受体进行杂交(回交)选育,再利用分子标记对抗虫基因进行跟踪,从而选育出抗螟虫的优良水稻新品种(品系)。外源Bt基因是否纯合是影响育种进程的一个关键因素。目前所用的检测Bt基因的分子标记主要是根据导入的外源基因片段序列设计的特异显性标记,该标记只能检测目标基因的有无,不能区分杂合基因型和纯合基因型,需要在下一代对基因型进行验证,因此显性标记检测效率低,耗费时力(邓鸿铃等, 2007; Tang et al., 2006; Yang et al., 2011)。根据外源基因及其插入位点侧翼序列设计多重PCR标记可以有效的鉴别杂合基因型和纯合基因型,提高选择效率,加快育种进程(欧阳波等, 2006; 贾芝琪等, 2009; 张焕春等, 2012)。
转cry1C基因水稻新品系T1C-19,无论是人工接虫还是田间鉴定,基本不受稻纵卷叶螟、二化螟和三化螟危害,是培育抗螟虫水稻新品种(品系)的优良亲本(Tang et al., 2006; Zheng et al., 2011)。本研究根据T1C-19中插入的外源基因左侧水稻基因组序列设计1个正向引物C1,根据插入位点右旁侧水稻基因组序列设计1个反向引物C3,在插入的外源基因序列靠近左侧水稻基因组处设计1个反向引物C2。利用这3个引物进行多重PCR扩增,在非转基因水稻和纯合转基因水稻中分别扩增出大小不同的1个片段,在转基因杂合体中同时扩增出上述2个片段。因此该体系可以同时鉴定出转基因纯合、转基因杂合和转基因阴性3种基因型,为利用T1C-19进行抗螟虫水稻分子育种提供了一个简便有效的基因鉴定技术。
1结果与分析
1.1内参基因的检测
利用内参actin基因引物对转基因水稻T1C-19,非转基因水稻9311、R838、宜恢72,杂交F1代材料9311/T1C-19、R838/T1C-19、宜恢72/T1C-19进行PCR检测,结果见图1。除了空白对照外的所有水稻材料中均扩增出303 bp目标片段。说明所用DNA模板和PCR扩增体系正常。
|
图1 内参基因actin的PCR检测结果 Figure 1 PCR result of the reference gene actin |
1.2二引物PCR体系对转基因水稻材料扩增的特异性
以不同类型水稻材料DNA为模板,分别利用引物C1+C2和C1+C3进行PCR扩增,结果见图2。C1+C2在转基因纯系T1C-19、转基因杂合体9311/ T1C-19、R838/T1C-19、宜恢72/T1C-19中扩增出一条约512 bp的片段,在非转基因材料9311、R838、宜恢72中没有扩增产物(图2A)。C1+C3在转基因纯系T1C-19中没有产物,在转基因杂合体9311/T1C-19、R838/ T1C-19、宜恢72/T1C-19,以及非转基因材料9311、R838、宜恢72中扩增出一条约386 bp的片段(图2B)。该结果与设计的扩增产物大小一致。
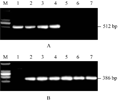 图2 二引物PCR体系在水稻材料中的扩增 Figure 2 PCR amplification with two-primer system in rice |
1.3二引物体系扩增产物的序列分析
为了进一步验证二引物体系扩增产物是否为目标基因序列,对引物C1+C2和C1+C3在9311、T1C-19和9311/T1C-19中扩增出的片段进行测序(图3)。C1+C2在T1C-19和9311/T1C-19中扩增出的DNA片段序列完全一致(图3a)。对该序列进行BLAST分析,结果表明该序列与引物设计时所用的GeneBank (HQ161062.1)中的T1C-19的基因组序列相同,其中小写部分为T-DNA插入位点的侧翼序列,大写部分为T-DNA序列。C1+C3在9311和9311/ T1C-19中扩增出的DNA片段序列也完全一致(图3b)。BLAST分析表明,该片段来自于水稻第11染色体组(GeneBank: AC123519.2),且与T1C-19的T-DNA插入位点的侧翼序列相同,其中大写部分为T-DNA插入位点的左侧翼序列,小写部分为T-DNA插入位点的右侧翼序列。测序结果表明,引物C1+C2和C1+C3的扩增结果与设计一致,均扩增出目标片段。
 图3 二引物PCR体系扩增产物序列分析 Figure 3 The sequence of PCR products with two-primer system |
1.4三引物多重PCR扩增体系的优化
本研究中两个目标片段的引物退火温度设计相同,因此在二引物扩增的基础上,按照原有DNA模板浓度、dNTP、DNA聚合酶用量,而引物C1、C2、C3按2:1:1用量配置三引物PCR扩增体系。结果发现两个片段有不对称扩增现象。在此基础上改变DNA模板浓度及扩增循环数,发现两个目标片段的不对称扩增现象仍然存在。结合三引物多重PCR扩增体系中存在1个正向引物C1和2个反向引物C2、C3,引物之间的竞争会影响扩增效果。为此,设计了4个不同引物使用量的PCR反应体系。体系1:0.5 μL 10 μmol/L C1+0.4 μL 10 μmol/L C2+0.4 μL 10 μmol/L C3,体系2:0.5 μL 10 μmol/L C1+0.4 μL 10 μmol/L C2+0.3 μL 10 μmol/L C3,体系3:0.5 μL 10 μmol/L C1+0.4 μL 10 μmol/L C2+0.2 μL 10 μmol/L C3,体系4:0.5 μL 10 μmol/L C1+0.4 μL 10 μmol/L C2+0.1 μL 10 μmol/L C3。并利用转基因纯系T1C-19、转基因杂合体9311/T1C-19和非转基因材料9311基因组DNA为模板,进行三引物PCR扩增。由图4看出,4个PCR反应体系均能区分转基因杂合体、转基因纯合体和非转基因材料,T1C-19、9311及杂合体9311/T1C-19中扩增出清晰的片段,片段大小分别与T1C-19和9311中的片段大小一致。体系3的扩增效果最好,表现在杂合体两条片段的扩增量几乎一致。
|
图4 三引物多重PCR反应体系中不同引物使用量的扩增效果 Figure 4 The effects of primer quantities on tri-primer multiplex PCR amplification |
1.5三引物多重PCR扩增体系在转基因后代材料中的验证
利用优化后的三引物多重PCR扩增体系3对T1C-19,非转基因水稻R838、宜恢72及其杂种R838/ T1C-19和宜恢72/T1C-19进行检测,结果见图5。在T1C-19中扩增出一条512 bp的片段,在R838、宜恢72中分别扩增出一条386 bp片段,在R838/T1C-19和宜恢72/T1C-19中同时扩增出512 bp和386 bp的两条片段。检测结果表明,在这些材料中该体系同样可以准确地区分转基因杂合体、转基因纯合体和非转基因材料。
|
图5 三引物多重PCR扩增体系在不同水稻材料中的验证 Figure 5 The tri-primer multiplex PCR amplification in various rice varieties (combinations) |
在9311/T1C-19、R838/T1C-19和宜恢72/T1C-19的F2代植株中分别随机取10株,利用PCR扩增体系3进行检测,检测结果显示,在F2代中出现了转基因杂合、转基因纯合和转基因阴性单株的分离(表1)。收获这10株的种子种植成F3代株系,每个株系取20株进行三引物PCR检测。检测结果表明,来自F2代转基因纯合和转基因阴性单株的F3家系目标基因稳定,仍为转基因纯合和转基因阴性基因型,而来自F2代转基因杂合单株的F3家系中目标基因发生分离,出现转基因杂合、转基因纯合和转基因阴性单株。以上结果表明,利用该三引物多重PCR扩增体系可以准确地鉴定出T1C-19及其衍生的后代材料中转基因杂合、转基因纯合和转基因阴性植株。
 表1 转基因水稻F2代和F3代材料的三引物多重PCR检测结果 Table 1 The results of tri-primer multiplex PCR in F2 and F3 breeding populations |
2讨论
目前,将Bt 基因导入到水稻中并获得良好抗性的水稻品种越来越多(Chen et al., 2005; Ye et al., 2001b),导入cry1C基因的T1C-19 是抗螟虫表现最好的转基因材料之一(Tang et al., 2006),随着抗虫转基因技术的广泛应用和日趋成熟,利用T1C-19作为抗虫基因供体,已经培育了多个抗虫水稻新品系(田雨等, 2011; 冯睿彤等, 2012)。目前对T1C-19的杂交后代cry1C基因检测的分子标记均属于显性标记(Tang et al., 2006; Yang et al., 2011; 田雨等, 2011; 李孝琼等, 2012),这些标记只能判断外源基因的有无,但无法区别基因型是纯合还是杂合。本研究建立了用于检测转基因水稻T1C-19及其衍生材料中外源基因的三引物多重PCR检测体系,该体系可以准确简便地区分出转基因杂合、转基因纯合和转基因阴性三种基因型。
多重PCR技术利用一次PCR反应检测多个靶标DNA片段,比传统PCR省时省力。该技术已广泛地应用于转基因植物的检测,主要是用于同时检测多个外源基因成分的存在(吴影等, 2006; 武海斌等, 2009; 魏霜等, 2012),也有利用外源基因插入的侧翼序列设计共显性引物标记进行多重PCR检测转基因的基因型(欧阳波等, 2006; 贾芝琪等, 2009; 张焕春等, 2012)。本研究针对T1C-19中特异转化事件,设计了同时检测2个靶标片段的3个共显性引物标记C1、C2和C3 (图6)及其三引物多重PCR体系。多重PCR技术的难点主要体现在反应体系的不平衡。反应体系的不平衡导致在前面几轮循环中优势引物的扩增产物大量增加,而这些大量增加的产物又对DNA聚合酶起抑制作用(Santalucia, 2007),从而使前期处于劣势的引物的扩增产物效率越来越低。引物设计的缺陷是导致反应体系的不平衡的主要原因,包括引物退火温度不一致,特异性差,存在二聚体等(胡毅玲等, 2001; 黄银花等, 2003)。本文根据2个靶标片段所设计的引物退火温度相同,都是55℃,引物经过Blast分析,特异性强且不存在二聚体。利用这些引物分别进行单一PCR扩增都能特异地扩增出目标DNA片段。有大量研究表明,在成功的单一PCR扩增条件下,进行多重PCR 反应,一般都能得到较好的扩增结果(Arlorio et al., 2002; Ma et al., 2003; 王凤格等, 2003)。本文设计的3个引物中,其中1个引物为共用的上游引物。因此在建立多重PCR体系时先从反应体系中的引物配比上着手,其他反应体系如DNA模板浓度、dNTP、DNA聚合酶用量保持与单一PCR一致,这样既可以简化多重PCR反应体系,又可以解决多重PCR中多个产物不对称扩增。本研究设计的三引物PCR扩增体系扩增产物条带清晰,产物测序结果正确。用该体系对不同的转基因杂交组合及其亲本材料进行检测,均能区分转基因杂合、转基因纯合和转基因阴性三种基因型。通过对T1C-19不同转基因杂交组合的分离世代F2代基因型检测及对F3家系基因型的进一步验证,结果表明该体系对T1C-19不同转基因杂交后代的基因型鉴定准确率达到100%,说明该体系可以用于T1C-19及其衍生系中的cry1C基因型检测。
利用已有的Bt水稻资源进行抗螟虫水稻育种是防治水稻螟虫的有效途径,C1+C2+C3三引物多重PCR检测方法的建立为利用T1C-19进行抗螟虫水稻分子育种提供了一个简便有效的基因鉴定技术,有利于提高对cry1C基因的检测效率,加快抗螟虫水稻育种进程。
3材料与方法
3.1水稻(Oryza sativa L.)材料和试剂
转cry1C基因纯合系T1C-19由华中农业大学作物遗传改良国家重点实验室/国家植物基因研究中心(武汉)提供。非转基因水稻9311、辐恢838、宜恢72由作者实验室保存。
以非转基因水稻9311、辐恢838、宜恢72为母本,T1C-19为父本进行杂交,获得cry1C基因杂合的F1代,F1代自交获得F2代,在F2代中随机选择10株进行3引物PCR检测,分别收获这10株自交种子种植成F3代株系。
DNA提取和PCR检测试剂均购自Takara公司。
3.2方法
3.2.1 DNA提取
取约1~2 cm长的水稻幼嫩叶片置于2 mL圆底离心管中,加入2×CTAB 400 μL后在QIAGEN Tissuelyser样品研磨仪中磨碎匀浆,置60℃水浴20 min,加入400 μL氯仿/异戊醇(24:1)震荡混匀10 min,10 000 rpm离心10 min,取200 μL上清置于另一加有400 μL 95%预冷乙醇的1.5 mL离心管,静置10 min,13 000 r/min离心10 min,弃上清后晾干,加入50 μL灭菌的超纯水溶解。
3.2.2水稻内参基因的PCR检测
为了保证水稻基因组DNA的质量和PCR检测体系的正常可靠,以水稻actin基因作为参照基因(Liu et al., 2007)。actin基因(RAc1, Accession number X16280)上下游引物分别为5'-aagatcctgacggagcgtggttac-3'和5'-cttcctaatatccacgtcgcacttc-3'。PCR产物大小为303 bp。PCR反应体系为15 μL,其中包含10×PCR缓冲液(含Mg2+) 1.5 μL,2.5 mmol/L dNTP 1.2 μL,10 µmol/L上下游引物各0.3 μL,5 U/μL Taq DNA聚合酶0.2 μL,DNA模板1 μL。PCR反应程序为94℃反应4 min,然后进入三温度循环,每个循环包括94℃反应40 s,58℃反应30 s,72℃反应30 s,共30个循环,最后72℃反应5 min。
3.2.3三引物设计
在T1C-19中T-DNA序列左侧水稻基因组序列(GenBank: HQ161062.1)中设计一条正向引物C1,序列为5'-cacgaaagagaagggcactc-3';在T-DNA序列右侧水稻基因组序列中设计一条反向引物C3,序列为5'-gcaactgtgttgtaggtatg-3';在T-DNA中靠近左侧水稻基因组处设计一条反向引物C2,序列为5'- tcccagataagggaattaggg-3'。T-DNA的插入位点和引物位置(图6a),T-DNA的侧翼序列(图6b)。在非转基因水稻中,C1+C3扩增出一条386 bp的PCR产物;在转基因纯合体中C1+C2扩增出一条512 bp的PCR产物,由于T-DNA序列过长,C1+C3没有扩增产物。在转基因杂合体中同时扩增出386 bp和512 bp的2条带。引物利用Premier 3软件设计,由上海生工生物工程技术有限公司合成。
 图6 三引物在转基因水稻T1C-19基因组中的位置 Figure 6 The position of three primers in the genome of T1C-19 |
3.2.4二引物PCR扩增特异性检测
PCR反应体系为15 μL,其中包含10×PCR 缓冲液(含Mg2+) 1.5 μL,2.5 mmol/L dNTP 1.2 μL,5 U/μL Taq DNA聚合酶0.2 μL,DNA模板1 μL,10 µmol/L引物C1、C2(或者C1, C3)使用量分别为0.3 μL。PCR反应程序为94℃反应4 min,然后进入三温度循环,每个循环包括94℃反应40 s,55℃反应30 s,72℃反应30 s,共30个循环,最后72℃反应5 min。
3.2.5二引物PCR扩增产物测序
PCR产物经0.8%的琼脂糖凝胶电泳分离后,回收包含目标片段的胶块,用上海生工生物工程技术有限公司生产的DNA胶回收试剂盒回收目标片段DNA,送南京金斯瑞生物科技有限公司进行测序。
3.2.6三引物多重PCR检测体系
PCR反应体系为15 μL,其中包含10×PCR缓冲液(含Mg2+) 1.5 μL,2.5 mmol/L dNTP 1.2 μL,5 U/μL Taq DNA聚合酶0.2 μL,DNA模板1 μL和适当量的三引物C1、C2、C3。C1、C2和C3的浓度为10 µmol/L,引物使用量根据优化结果确定。PCR 反应程序为94℃反应4 min,然后进入三温度循环,每个循环包括94℃反应40 s,55℃反应30 s,72℃反应30s,共30个循环,最后72℃反应5 min。
作者贡献
査中萍、万丙良和杜雪树是本研究的实验设计和执行人;査中萍参与实验设计、实验操作、数据分析和论文写作;万丙良是项目的构思者和负责人,指导实验设计、数据分析、论文写作和修改;杜雪树参与实验操作和数据处理。
致谢
本研究由国家转基因生物新品种培育重大专项(2011ZX08001-001)及湖北省农业科技创新中心资助项目(2007-620-001-03)共同资助。作者感谢华中农业大学作物遗传改良国家重点实验室/国家植物基因研究中心(武汉)林拥军教授提供的Bt水稻T1C-19。感谢两位匿名的同行评审人的评审建议和修改建议。
参考文献
Arlorio M., Coïsson J., Cereti E., Travaglia F., Capasso M., and Martelli A., 2002, Polymerase chain reaction (PCR) of puroindoline b and ribosomal/puroindoline b multiplex PCR for the detection of common wheat (Triticum aestivum) in Italian pasta, European Food Reasearch and Technology, 216(3): 253-258
Chen H., Tang W., Xu C.G., Li X.H., Lin Y.J., and Zhang Q.F., 2005, Transgenic indica rice plants harboring a synthetic cry2A* gene of Bacillus thuringiensis exhibit enhanced resistance against lepidopteran rice pests, Theor. Appl. Genet., 111: 1330-1337
http://dx.doi.org/10.1007/s00122-005-0062-8
PMid:16187120
Deng H.L., Guo X.D., and Wu Y.L., 2007, Detection of BT transgenicrice gene by polymerase chain reaction, Xiandai Shipin Keji (Mordern Food Science and Technology), 23(4): 71-74 (邓鸿铃, 郭新东, 吴玉銮, 2007, 利用PCR方法检测转BT基因水稻, 现代食品科技, 23(4): 71-74)
Feng R.T., Xu J.Y., Yan C.Y., Deng X.W., Li C.H., and Mou T.M., 2012, Improvement of insect resistance of rice restorer line zhenhui 084, Zajiao Shuidao (Hybrid Rice), 27(1): 60-66 (冯睿彤, 徐俊英, 闫成业, 邓学武, 李春海, 牟同敏, 2012, 水稻三系恢复系镇恢084的螟虫抗性改良, 杂交水稻, 27(1): 60-66)
Hu Y.L., Wang S.Y., Chi G.B., Guo C., and Liao Y.P., 2001, Mutiplex PCR for detection of genetic marker on cancer in molecular epidemiological study, Zhongguo Gonggong Weisheng (China Public Health), 17(5): 412-413 (胡毅玲,王声湧, 池桂波, 郭畅, 廖倚萍, 2001, 多重PCR 在肿瘤遗传标志分子流行病学研究中的应用, 中国公共卫生, 17(5): 412-413)
Huang Y.H., Hu X.X., Xu W.Z., Gao Y., Feng J.D., Sun H., and Li N., 2003, The factors affecting the efficiency of multiplex PCR, Yichuan (Hereditas (Beijing)), 25(1): 65-68 (黄银花, 胡晓湘, 徐慰倬, 高宇, 冯继东, 孙汉, 李宁, 2003, 影响多重PCR扩增效果的因素, 遗传, 25(1): 65-68)
Jia Z.Q., Zhang Z.H., Cui Y.H., Li Y., Huang S.W., and Du Y.C., 2009, Creening homozygous transgenic plants by flanking sequences amplification of T-DNA in tomatoes, (Journal of Agricultrral Biotechnology), 17(5): 820-824 (贾芝琪, 张忠华, 崔艳红, 李颖, 黄三文, 杜永臣, 2009, 利用外源基因侧翼序列扩增筛选番茄纯合转基因植株, 农业生物技术学报, 17(5): 820-824)
Li X.Q., Guo S.B., Wei Y., Li J.M., Liu K.Q., and Gao G.Q., 2012, Comparison of two screening methods for detecting insect resistant offspring of Bt-transgenic rice, Nanfang Nongye Xuebao (Journal of Southern Agriculture), 43(2): 141-145 (李孝琼, 郭嗣斌, 韦宇, 李杰民, 刘开强, 高国庆, 2012, Bt抗虫水稻转育后代两种筛选方法的比较, 南方农业学报, 43(2): 141-145)
Liu J.G., Zhang Z., Qin Q.L., Peng R.H., Xiong A.S., Chen J.M., Xu F., Zhu H., and Yao Q.H., 2007, Isolated and characterization of a cDNA encoding ethylene-responsive element binding protein (EREBP)/AP2-type protein, RCBF2, in Oryza sativa L., Biotechnol. Lett., 29(1): 165-173
http://dx.doi.org/10.1007/s10529-006-9214-4
PMid:17136305
Ma W., Zhang W., and Gale K.R., 2003, Multiplex-PCR typing of high molecular weight glutenin alleles in wheat, Euphytica, 134(1): 51-60
http://dx.doi.org/10.1023/A:1026191918704
Ou Y.B., Long F., Zhang Y.Y., and Ye Z.B., 2006, Rapid and large-scale genetic analysis of transgenic tomato by NPTⅡ marker, Wuhan zhiwuxue Yanjiu (Journal of Wuhan Botanical Research), 24(1): 12-16 (欧阳波, 龙芳, 张扬勇, 叶志彪, 2006, 利用转基因标记NPTⅡ快速、规模化纯合转基因番茄, 武汉植物学研究, 24(1): 12-16)
SantaLucia J., 2007, Physical principles and visual-OMP software for optimal PCR design, Methods in Molecular Biology, 402: 3-34
http://dx.doi.org/10.1007/978-1-59745-528-2_1
PMid:17951788
Tang W., Chen H., Xu C.G., Li X.H., Lin Y.J., and Zhang Q.F., 2006, Development of insect-resistant transgenic indica rice with a synthetic cry1C* gene, Molecular Breeding, 18(1): 1-10
http://dx.doi.org/10.1007/s11032-006-9002-9
Tian Y., Xu J.Y., Li C.H., Lin Y.J., and Mou T.M, 2011, Improvement of insect-resistance of 9311 and development of insect-resistant rice hybrids, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 44(4): 664-672 (田雨, 徐俊英, 李春海, 林拥军, 牟同敏, 2011, 水稻品种9311的螟虫抗性改良和抗螟虫杂交稻组合选育, 中国农业科学, 44(4): 664-672)
Tu J.M., Zhang G.A., Datta K., Xu C.G., He Y.Q., Zhang Q.F., Khush G.S., and Datta S.K., 2000, Field performance of transgenic elite commercial hybrid rice expressing Bacillus thuringiensis δ-endotoxin, Nature Biotechnology, 18: 1101-1104
http://dx.doi.org/10.1038/80310
PMid:11017051
Wang F.G., Zhao J.R., She H.D., Guo J.L., Chen G., Liao Q., Sun S.X., and Chen R.M., 2003, Series of research on establishing DNA fingerprinting database of Chinese new maize cultivars Ⅲ. Multiplex PCR applied in maize SSR amplification, Yumi Kexue (Journal of Maize Sciences),11(4): 3-6 (王凤格, 赵久然, 佘花娣, 郭景伦, 陈刚, 廖琴, 孙世贤, 陈如明, 2003, 中国玉米新品种DNA 指纹库建立系列研究III. 多重PCR 技术在玉米SSR 引物扩增中的应用, 玉米科学, 11(4): 3-6)
Wei S., Chen Z., Lu C.B., Ma J., Bai W.B., and Wu X.Y., 2012, Multiplex PCR detection of transgenic components of genetically modified rice, Shipin Kexue (Food Science), 33(12): 159-162 (魏霜, 陈贞, 芦春斌, 马骏, 白卫滨, 吴希阳, 2012, 多重PCR检测转基因水稻的转基因成分, 食品科学, 33(12): 159-162)
Wu H.B., Sun H.W., Li B.D., Yang C.L., and Lu X.B., 2009, Detection of genetically modified maize by multiplex PCR-gene chip, Nongye Shengwu Jishu Xuebao (Journal of Agricultural Biotechnology), 17(6): 1075-1082 (武海斌 , 孙红炜 , 李宝笃 , 杨崇良 , 路兴波, 2009, 转基因玉米多重 PCR基因芯片联用的检测方法, 农业生物技术学报, 17(6): 1075-1082)
Wu Y., Lu X.Z., Zhao W., Wang X.F., and Li L., 2006, Analysis method of genetically modified detection of multiplex polymerase chain reaction (MPCR), Anhui Nongye Kexue (Journal of Anhui Agricultural Sciences), 34(7): 1297-1299 (吴影, 陆徐忠, 赵伟, 汪秀峰, 李莉, 2006, 多重PCR分析方法应用于转基因农作物的检测, 安徽农业科学, 34(7): 1297-1299 )
Yang Z., Chen H., Tang W., Hua H.X., and Lin Y.J., 2011, Development and characterisation of transgenic rice expressing two Bacillus thuringiensis genes, Pest Manag. Sci., 67(4): 414-422
http://dx.doi.org/10.1002/ps.2079
Ye G.Y., Shu Q.Y., Yao H.W., Cui H.R., Cheng X.Y., Hu C., Xia Y.W., Gao M.W., and Altosaa I., 2001b, Field evaluation of resistance of transgenic rice containing a synthetic cry1Ab gene from Bacillus thuringiensis berliner to two stem borers, Journal of Economic Entomology, 94(1): 271-276
http://dx.doi.org/10.1603/0022-0493-94.1.271
PMid:11233125
Ye G.Y., Tu J.M., Hu C., Datta K., and Datta S.K., 2001a, Transgenic IR72 with fused Bt gene cry1Ab/cry1Ac from Bacillus thuringiensis is resistant against four lepidopteran species under field conditions, Plant Biotechnology, 18(2): 125-133
http://dx.doi.org/10.5511/plantbiotechnology.18.125
Zhang H.C., Wang X.F., Li Y.Y., Chen X.Y., Liao Q.M., and Xu J.F., 2012, A rapid and accurate PCR method for homozygous lines screening for genetically modified rice containing Cry1Ab, Zhejiang Nongye Xuebao (Acta Agriculturae Zhejiangensis), 24(4): 549-553 (张焕春, 汪小福, 李玥莹, 陈笑芸, 缪青梅, 徐俊锋, 2012, 转CrylAb水稻纯合体快速准确的PCR鉴定方法, 浙江农业学报, 24(4): 549-553)
Zheng X.S., Yang Y.J., Xu H.X., Chen H., Wang B.J., Lin Y.J, and Lu Z.X., 2011, Resistance performances of transgenic Bt rice lines T2A-1 and T1c-19 against Cnaphalocrocis medinalis (Lepidoptera: Pyralidae), Journal of Economic Entomology, 104(5): 1730-1735
http://dx.doi.org/10.1603/EC10389
PMid:22066204