2. 云南省农业科学院生物技术与种质资源保存研究所, 昆明, 650223
3. 云南大学生命科学院, 昆明, 650091
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2013 年, 第 11 卷, 第 5 篇 doi: 10.5376/mpb.cn.2013.11.0005
收稿日期: 2013年03月20日 接受日期: 2013年04月23日 发表日期: 2013年04月27日
引用格式(中文):
林秀琴等, 2013, 应用GISH技术鉴定甘蔗野生种外源染色体, 分子植物育种(online), 11(5): 1025-1031 (doi: 10.5376/mpb.cn.2013.11.0005)
引用格式(英文):
Lin et al., 2013, Identify the Wild Exogenous Chromosomes in Saccharum Using Genomic in situ Hybridization, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 11(5): 1025-1031 (doi: 10.5376/mpb.cn.2013.11.0005)
为了鉴定分析甘蔗远缘杂交中野生种外源染色体,以及分析其在子代细胞中的遗传行为。本研究以双亲本叶片基因组总DNA为原位杂交探针,对子代染色体进行单色及双色基因组荧光原位杂交(genomic in situ hybridization, GISH)。结果表明:2种杂交方式均能鉴定子代中野生种外源染色体,但是,双色GISH比用单色GISH更容易区别双亲本染色体。通过研究在子代细胞中鉴定出14~17条野生种滇蔗茅外源染色体及37~41条甘蔗属热带种染色体,亲本染色体以非整倍的n+n方式传递。对子代进行核型分析,核型公式为2n=54=16 m+38 sm,核型属2 B类型。本研究对进一步深入开发利用野生种滇蔗茅优异基因具有重要意义。
甘蔗是中国主要的糖料经济作物,蔗糖产量占全国食糖总产的90%以上。然而,中国甘蔗单产和产糖率同世界蔗糖业发达国家相比,仍处于较低水平,其主要原因是生产上缺乏优良品种。甘蔗野生种及其近缘野生种中含有许多甘蔗栽培种中所迫切需要的优异基因,如抗病性基因和抗逆性基因等,通过种间有性杂交利用这些基因是甘蔗遗传改良的重要途径,有望获得突破性甘蔗品种。
滇蔗茅(Erianthus rockii Keng)产于中国西南的四川、云南和西藏等地区,多生于海拔500~2700 m的干燥山坡草地(Chen et al., 2006),是中国特有的甘蔗近缘野生植物资源(Cai et al., 2005)。由于具有耐旱、耐寒、抗锈病等优良特性(李文凤等, 2005; 2007),云南甘蔗研究所加大了对该资源的考察收集与杂交利用研究(刘新龙等, 2009),通过光周期诱导甘蔗属热带种开花与滇蔗茅进行远缘杂交,创制出了一批杂交后代材料(Aitken et al., 2007; 王丽萍等, 2008; 陆鑫等, 2012a; 2012b)。GISH在作物远缘杂交育种中具有十分广阔的应用前景,是在分子水平上识别杂种真伪的有效办法(钟少斌等, 1997),具有更加直观、灵敏和可靠的优点(贾东亮等, 2001; 蓝伟侦等, 2006)。本文应用GISH技术鉴定甘蔗野生种外源染色体,旨在科学分析野生种外源染色体与甘蔗属背景染色体的遗传行为,这对进一步深入开发利用滇蔗茅优异基因具有重要意义。
1结果与分析
1.1 单色及双色GISH结果分析
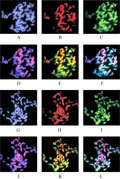
以亲本DNA为探针对子代材料进行的单、双色杂交,结果表明,杂交的状态均较好,杂交效率较高,背景干净。所制备的中期染色体标本中期细胞完整,染色体分散好、形态好,可以检测到清晰的杂交信号。图1中,A和G示DAPI衬染效果,染色体呈蓝色背景;B和H示野生种DNA探针的单色GISH效果,染色体呈红色荧光信号;C和I示甘蔗属热带种DNA探针的单色GISH效果,染色体呈绿色荧光信号;D和J示蓝色和红色叠加的效果,结果显示:野生种探针除与子代中野生种整条染色体杂交外,还与大多数甘蔗属热带种染色体在着丝粒及近端粒进行杂交,区分双亲本染色体的效果不明显;E和K示双亲本DNA探针的双色GISH效果,即红色和绿色叠加的效果,结果表明,双色GISH更容易将野生种外源染色体与甘蔗属背景染色体区别开来,来自母本甘蔗属热带种的染色体呈黄绿色或绿色荧光信号,来自野生种滇蔗茅的染色体呈橙红色或橙黄色荧光信号;F和L示红、绿、蓝三色叠加的效果。
|
图1 基因组荧光原位杂交结果
Figure 1 The result of GISH |
1.2染色体遗传分析
在双色GISH实验结果中,选11个比较完整的中期分裂相细胞对子代染色体的遗传组成进行分析(表1):在子代体细胞中检测到37~41条甘蔗属热带种(母本)染色体及14~17条野生种(父本)外源染色体。已知双亲本染色体数目分别为2n=80和2n=30条,所以认为甘蔗属热带种与野生种滇蔗茅远缘杂交过程染色体基本上符合n+n (整倍或非整倍的n)传递方式。在所观察的细胞中未发现野生种外源染色体与甘蔗属背景染色体发生交换、重组或异位。
|
表1 F1代染色体组成分析
Table 1 Chromosome constitution in F1 progeny |
1.3荧光核型分析
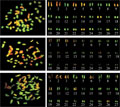
取3个较好的中期细胞进行核型分析(图2),结果子代材料的染色体臂比介于1.38~2.42之间,其中第6、第8、第13、第14、第15、第19、第21和第27号染色体为中部着丝点染色体(m),其余19对染色体为亚中部着丝点染色体(sm)。染色体组全长47.13 µm,平均臂比为1.80,染色体的长度比为3.25,臂比大于2:1的染色体占0.15%,核型属2 B类型,核型公式为2n=54=16 m+38 sm。
|
图2 中期细胞及荧光核型图
Figure 2 Metaphase cells and the karyogram of the fluorescence |
2讨论
2.1染色体制片质量对GISH实验效果的影响
染色体制片质量(染色体分散清晰, 互不重叠或重叠较少, 染色体形态良好的制片)是影响GISH实验效果好坏的基础,因此在实验过程中要根据具体情况调整供试材料预处理的条件,提高制片水平,以得到高质量的染色体制片。甘蔗及其野生种均属于小染色体类型,又加上数目多,且形态相似的特点,采用滴片法制备染色体玻片标本,是一种简便有效的方法。金危危等(2001)研究表明,滴片法能够获得良好的荧光原位杂交效果。本实验结果表明用对二氯苯水饱和溶液与0.002 mol/L 8-羟基喹啉等体积混合液离体预处理子代根尖样品(室温, 4 h),有利于积累更多的有丝分裂相及中期分裂相细胞,用0.075 mol/L KCl室温低渗1 h,能使染色体充分分散。采用现配的卡诺氏固定液固定根尖材料,可以保存染色体的固有形态,增加了探针的穿透能力,便于与靶DNA进行原位杂交。在滴片法中Mouras等(1978)采用机械力将酶解的材料捣碎,进一步用低离心率短暂离心的方法获得细胞悬液,此法效果并非很好。主要是因为离心使上清液中的大量细胞碎片与细胞混在一起,不利于染色体铺展。本研究将酶解的材料捣碎在适量的卡诺氏固定液中,将细胞悬液静置片刻去掉底部大块沉淀物质,再将细胞悬液放室温静置20~30 min,目的是细胞沉降而细胞碎片留在上清液中,去上清液保留下层溶液进行滴片,此法细胞收率高。此外,滴片法还应当严格控制酶解时间和后低渗时间,当材料或组织块较大质地较硬时,时间要长一些,反之相反。滴片高度一般在30~100 cm,玻片水平倾角约30℃,尽量将细胞悬液滴在玻片非标签端的中下部,便于后续的杂交洗脱。
2.2防止染色体掉片的方法
由于实验过程要对杂交区域进行洗脱,经常会出现染色体从载玻片上脱落的现象,在制片时使用多聚赖氨酸处理的防脱载玻片可以增加染色体的吸附力;滴片后过酒精灯火焰,既可以蒸发掉部分固定液,也能使染色体更好地贴附在玻片上。实验用胃蛋白酶处理玻片标本,目的是消化细胞质中的蛋白质,使探针和试剂更易进入染色体,获得较均匀的杂交信号并在一定程度上减少背景的产生,但胃蛋白酶酶解过度或时间过长会造成染色体形态不完整(如染色体边缘弥散、染色体断裂等),也容易造成染色体掉片。如果染色体制片质量较高,实验过程中就可以省略胃蛋白酶酶解这一步骤(林小虎等, 2005)。另外,60℃烘箱烤片及染色体高温变性前对玻片的预热也可以使染色体与载玻片结合得更牢固,防止染色体掉片。在实验过程中严格控制实验温度(37℃~42℃为宜),洗脱的时间不宜过长,以及在整个实验过程中应保持pH的稳定等,也可以减少染色体掉片发生的频率。
2.3原位杂交探针的长度和浓度
由于植物的基因组很大,不能直接用于探针标记,标记前需将其剪切打断成较小片段,以提高杂交效率。对于延展的染色体,探针长度可超过1 000 bp。小片段探针较大片段探针杂交速率快,特异性强,但15~30 bp的寡核苷酸探针带有的标记物少灵敏度较低。基因组DNA的剪切打断方法主要有煮沸法、超声波清洗仪剪切、移液枪反复吸打及高压灭菌打断法等,由于不同种的DNA含G、C量不同,这使不同物种的DNA在降解到一定长度所需的时间存在差异(李璇等, 2002; 顾爱侠等, 2010 )。本研究采用的是高压灭菌打断法,亲本基因组DNA以121℃高温灭菌10 min后,得到的片段多数为300~500 bp,适宜用作基因组荧光原位杂交探针。国内制备的荧光原位杂交探针浓度主要在0.5~5.0 μg/mL之间,在一定的范围内,增加探针浓度,可以增加杂交率和杂交敏感性,但过多的探针可能造成较大的“噪音”干扰。探针的任何内在物理特性均不影响其使用浓度,但受不同类型标记物的固相支持物的非特异结合特性的影响。
2.4 GISH技术在甘蔗育种中的作用
栽培甘蔗属于异源多倍体植物,要想对其染色体来源与遗传特性深入研究,GISH无疑是一种特别有效的方法(D’Hont et al., 1996; Cuadrado et al., 2004; Piperidis et al., 2010a),同时,GISH技术也被广泛地应用于甘蔗远缘杂交后代染色体鉴定研究(D’Hont, 2005; Piperidis et al., 2010b; Wang et al., 2010)。应用单色GISH时,封阻DNA与探针用量比例相对要高些,才能鉴定F1代材料野生种外源染色体,用于染色体遗传组成的粗略分析,单色GISH的研究成本相对较低;当对杂交F1花粉母细胞减数分裂染色体遗传行为研究、F2以后及更高世代的染色体分析时,用双色或多色GISH会得到更精确的结果。本研究对进一步分析高世代材料中含滇蔗茅野生种外源染色体及其遗传行为奠定了实验基础。
3材料与方法
3.1材料
实验用材料包括甘蔗属热带种、野生种滇蔗茅及其远缘杂交后代材料,均栽种在云南省农业科学院甘蔗研究所甘蔗杂交亲本圃中。
3.2染色体玻片标本的制备
F1代根尖样品用对二氯苯水饱和溶液与0.002 mol/L 8-羟基喹啉等体积混合液,于室温预处理4 h,双蒸水洗2次10 min,用0.075 mol/L KCl于室温低渗1 h,双蒸水洗2次10 min,卡诺氏固定液I (无水乙醇:乙酸=3:1, 现配现用),于4℃冰箱固定24 h,双蒸水洗2次10 min,根尖材料浸泡在70%乙醇溶液中,4℃冰箱保存备用。制片方法详见(尤瑞麟, 2008, 北京大学出版社, 159-160),略有修改。取出2条根尖,双蒸水洗2次10 min,置于洁净的凹面载玻片上,将根尖表皮和根冠去掉,剥下分生区组织,0.25 N HCl解离3-6 min,转入500 μL离心管中,加150 μL酶液(2%纤维素酶+0.5%离析酶)于37℃恒温水浴锅处理45 min (期间轻轻摇几次)。水洗2次10 min,用双蒸水后低渗1-2 h,加100 μL现配的卡诺氏固定液Ⅰ将酶解好的组织块捣碎,静置片刻去沉淀和静置20~30 min去上清,用移液枪滴片,滴片前将载玻片置-20℃冰箱预冷10 min,左右各滴一滴,过酒精灯火焰,使载玻片上出现小雨点现象即可,室温自然晾干,或-20℃冰箱保存备用。
3.3叶片基因组总DNA的提取、DNA探针的标记
采用CTAB法提取双亲本基因组总DNA及玉米叶片基因组总DNA(封阻用),参照范源洪等(1999)和王英等(2008)的方法略有修改,用百泰克多功能DNA回收纯化试剂盒对DNA样品进行纯化和回收。采用高压灭菌法(121℃, 10 min)将基因组DNA打断成较小的片段,1.5%琼脂糖凝胶电泳检测DNA片段的大小。双亲本DNA模板分别用德国Roche公司产品DIG-High Prime和Biotin-High Prime进行标记,具体方法见说明书。
3.4原位杂交过程
配制40 μL杂交混合液(含50%去离子甲酰胺, 10% DS, 0.5% SDS, 6 ng/μL探针及适量封阻DNA),涡流混合器上混匀,于PCR仪上97℃变性10 min,迅速取出,置冰水盒中冷却10 min待用。染色体玻片标本用60℃烘箱烤片干燥5 h,每片加70%去离子甲酰胺100 µL,加封口膜盖片后于77℃水浴锅变性7 min,揭去膜。过-20℃ 70%、95%、100%梯度酒精脱水,5 min/级。从-20℃ 100%酒精中取出染色体玻片标本,迅速甩干玻片上的酒精,将变性的杂交混合液滴在变性的染色体玻片标本上,盖上封口膜,放在一密闭湿盒中,置于37℃恒温水浴锅中杂交过夜。用0.1% SDS (2×SSC)漂去盖片,0.1% SDS (0.2×SSC)洗3次5 min,5% BSA,37℃处理30 min (封阻内源性生物素蛋白产生的干扰),加荧光抗体工作液(25 μg/mL Bio-Avidin-FITC与15 μg/mL Anti-DIG-Rhodamin均等混合液, 避光)进行检测,37℃,温育1 h,用1×PBS/Teween 20 37℃漂洗3次5 min,DAPI衬染7 min (避光),1×PBS室温漂洗3次3 min。用Vectashied抗荧光衰减剂封片后,在德国Ziess公司荧光显微镜下观察,用Metasystem ISIS系统对细胞荧光图像进行拍照和处理。
3.5核型分析
用Metasystem Isis软件进行染色体核型分析,核型分析参照李懋学和陈瑞阳(1985)的标准。
作者贡献
林秀琴、陆鑫、苏火生和刘洪博是本研究的实验设计和实验研究的执行人;蔡青是项目的构思者和负责人,指导实验设计,论文写作与修改;刘新龙参与实验设计及论文写作修改;毛钧参实验结果分析和论文写作。全体作者都阅读并同意最终的文本。
致谢
本研究在中国科学院昆明植物研究所完成,感谢顾志建研究员在染色体制片及原位杂交探针制备方面给予的宝贵意见,还要感谢杨静博士在基因组荧光原位杂交实验过程中给予的帮助和指导。
参考文献
Aitken K., Li J., Wang L., Qing C., Fan Y.H., and Jackson P., 2007, Characterization of intergeneric hybrids of Erianthus rockii and Saccharum using molecular markers, Genet Resources Crop Evolution, 54(7): 1395-1405
http://dx.doi.org/10.1007/s10722-006-9124-2
Cai Q., Aitken K.S., Fan Y.H., Piperidis G., Jackson P., and McIntyre C.L., 2005, A preliminary assessment of the genetic relationship between Erianthus rockii and the “Saccharum complex” using microsatellite(SSR) and AFLP markers, Plant Science, 169(5): 976-984
http://dx.doi.org/10.1016/j.plantsci.2005.07.002
Chen S.L., Renvoize S.A., and Wu Z.Y., eds., 2006, Flora of china, Science Press and St Louis, Missouri Botanical Garden Press, Beijing, China, Vol22: pp. 576-583
Cuadrado A., Acevedo R., de la Espina S.D., Jouve N., and de la Torre C., 2004, Genome remodeling in three modern S. officinarum×S. spontaneum sugarcane cultivars, J. Exp. Bot., 55(398): 847-854
http://dx.doi.org/10.1093/jxb/erh093
PMid:14990623
D'Hont A., 2005, Unraveling the genome structure of polyploids using FISH and GISH; examples of sugarcane and banana, Cytogenet Genome Res., 109(1-3): 27-33
http://dx.doi.org/10.1159/000082378
PMid:15753555
D’Hont A., Grivet L., Feldmann P., Rao S., Berding N., and Glaszmann J.C., 1996, Characterisation of the double genome structure of modern sugarcane cultivars (Saccharum spp.) by molecular cytogenetics, Mol. Gen. Genet., 250(4): 405-413
http://dx.doi.org/10.1007/BF02174028
http://dx.doi.org/10.1007/s004380050092
PMid:8602157
Fan Y.H., Cai Q., Su B., and Zhang Y.P., 1999, Effects of DNA extraction and purification processes on the RAPD results of six Saccharinae species, Xinan Nongye Xuebao (Southwest China Journal of Agricultural Sciences), 12(1): 1-7 (范源洪, 蔡青, 宿兵, 张亚平, 1999, DNA提纯方法对6种甘蔗亚族植物RAPD的影响, 西南农业学报, 12(1): 1-7)
Gu A.X., Li X.J., Feng D.L., Wang Y.H., Chen X.P., and Shen S.X., 2010, Preparation of blocking DNA in genomic in situ hybridization, Hebei Nongye Daxue Xuebao (Journal of Agricultural University of Hebei), 33(5): 77-79 (顾爱侠, 李雪姣, 冯大领, 王彦华, 陈雪平, 申书兴, 2010, 基因组原位杂交中封阻DNA制备方法研究, 河北农业大学学报, 33(5): 77-79)
Jia D.L., Shu L.H., Song Y.C., Qin R., Zhu L.L., and He G.C., 2001, Identification of hybrid of Oryza sativa X O. Meyeriana using genomic in situ hybridization, Wuhan Zhiwuxue Yanjiu (Journal of Wuhan Botanical Research), 19(3): 177-180 (贾东亮, 舒理慧, 宋运淳, 覃瑞, 祝莉莉, 何光存, 2001, 栽培稻与疣粒野生稻杂种F1代的基因组原位杂交鉴定, 武汉植物学研究, 19(3): 177-180)
Jin W.W., Li X., Li Z.Y., Ning S.B., Ling D.H., and Song Y.C., 2001, Detection and analysis of alien genes in transgenic rice by fluorescence in situ hybridization, Shiyan Shengwu Xuebao (Acta Biologiae Experimentalis Sinica), 34(3): 163-168 (金危危, 李霞, 李宗芸, 宁顺斌, 凌定厚, 宋运淳, 2001, 转基因水稻中外源基因的荧光原位杂交(FISH)分析, 实验生物学报, 34(3): 163-168)
Lan W.Z., Li G., He G.C., Wu S.J., Liu Z., and Qin R., 2006, Analyses of a O. Officinalis monosomic alien addition line in meiosis with GISH, Zhongnan Minzu Daxue Xuebao (Journal of South-central University for Nationalities (Natural Sciences Edition)), 25(1): 28-31 (蓝伟侦, 李刚, 何光存, 吴士筠, 刘钊, 覃瑞, 2006, 一个药用野生稻异源单体附加系在减数分裂时期的GISH分析鉴定, 中南民族大学学报(自然科学版), 25(1): 28-31)
Li M.X., and Chen R.Y., 1985, A suggestion on the standardization of karyotype analysis in plants, Wuhan Zhiwuxue Yanjiu( Journal of Wuhan Botanical Research), 3(4): 297-302 (李懋学, 陈瑞阳, 1985, 关于植物核型分析的标准化问题, 武汉植物学研究, 3(4): 297-302)
Li W.F., Cai Q., Huang Y.K., Fan Y.H., and Ma L., 2005, Identification of sugarcane wild germplasm resources resistant to Puccinia erianthi, Zhiwu Baohu (Plant Protection), 31(2): 51-53 (李文凤, 蔡青, 黄应昆, 范源洪, 马丽, 2005, 甘蔗野生资源对蔗茅柄锈菌的抗性鉴定, 植物保护, 31(2): 51-53)
Li W.F., Cai Q., Huang Y.K., Fan Y.H., and Wang L.P., 2007, Identification of fine sugarcane parent and innovative germplasm to resistant Puccinia erianthi, Zhongguo Tangliao (Sugar Crops of China), (4): 10-12 (李文凤, 蔡青, 黄应昆, 范源洪, 王丽萍, 2007, 甘蔗优良亲本及创新种质对蔗茅柄锈菌的抗性鉴定, 中国糖料, (4): 10-12)
Li X., Hu W.J., and Li C.B., 2002, Optimization of probe length in genomic in situ hybridization, Zhongyang Minzu Daxue Xuebao (Journal of the CUN (Natural Sciences Edition)), 11(1): 63-66 (李璇, 忽伟军, 李常宝, 2002, 基因组原位杂交中探针长度的优化, 中央民族大学学报(自然科学版), 11(1): 63-66)
Lin X.H., Li X.F., Wang L.M., Lu W.H., and Wang H.G., 2005, Analysis of factors influencing GISH used in triticeae crops'body cells, Shiyan Shengwu Xuebao (Acta Biologiae Experimentalis Sinica), 38(2): 126-132 (林小虎, 李兴峰, 王黎明, 陆文辉, 王洪刚, 2005, 麦类作物体细胞基因组原位杂交(GISH)效果影响因素的分析, 实验生物学报, 38(2): 126-132)
Liu X.L., Cai Q., Bi Y., Lu X., Ma L., and Ying X.M., 2009, Genetic diversity analysis for germplasm of Erianthus rockii in china, Zuowu Xuebao (Acta Agronomica Sinica), 35(2): 262-269 (刘新龙, 蔡青, 毕艳, 陆鑫, 马丽, 应雄美, 2009, 中国滇蔗茅种质资源遗传多样性的AFLP分析, 作物学报, 35(2): 262-269)
Lu X., Mao J., Liu H.B., Liu X.L., Ma L., Su H.S., and Cai Q., 2012a, Innovation germplasm of Erianthus rockii Ι. Establishment of F1 intergeneric distant hybridization of Saccharum officinarum L. and Erianthus rockii and the identification of F1 by SSR molecular markers, Zhiwu Yichuan Ziyuan Xuebao (Journal of Plant Genetic Resources), 13(2): 321-324 (陆鑫, 毛钧, 刘洪博, 刘新龙, 马丽, 苏火生, 蔡青, 2012a, 甘蔗野生种滇蔗茅种质创新利用研究Ⅰ.甘蔗与滇蔗茅远缘杂交F1群体构建与SSR分子标记鉴定, 植物遗传资源学报, 13(2): 321-324)
Lu X., Su H.S., Lin X.Q., Mao J., Liu H.B., and Cai Q., 2012b, Innovation utilization of Erianthus rockii germplasmⅡ. Genetic analysis of important agronomic traits on F1 of saccharum officinarum and E. Rockii, Hunan Nongye Daxue Xuebao (Journal of Hunan Agricultural University (Natural Sciences)) , 38(2): 121-124 (陆鑫, 苏火生, 林秀琴, 毛钧, 刘洪博, 蔡青, 2012b, 甘蔗野生种滇蔗茅种质创新利用研究Ⅱ.滇蔗茅 F1 群体重要农艺性状的遗传分析, 湖南农业大学学报(自然科学版), 38(2): 121-124)
Mouras A., Lut A., and Salesses G., 1978, Protoplasts use in cytology: improvement of recent method in order to identify Nicotina and Prunus mitotic chromosomes, Caryologia, 31(1): 117-127
Piperidis G., Piperidis N., and D'Hont A., 2010a, Molecular cytogenetic investigation of chromosome compositon and transmission in sugarcane, Mol. Genet. Genomics, 284(1): 65-73
http://dx.doi.org/10.1007/s00438-010-0546-3
PMid:20532565
Piperidis N., Chen J.W., Deng H.H., Wang L.P., Jackson P., and Piperidis G., 2010b, GISH characterization of Erianthus arundinaceus chromosomes in three generations of sugarcane intergeneric hybrids, Genome, 53(5): 331-336
http://dx.doi.org/10.1139/G10-010
PMid:20616864
Wang L.P., Cai Q., Lu X., Ma L., Liu X.L., Li W.F., and Xia H.M., 2008, Study of wild species Erianthus rockii germplasm innovation and use, Zhongguo Tangliao (Sugar Crops of China), 2: 8-11 (王丽萍, 蔡青, 陆鑫, 马丽, 刘新龙, 李文凤, 夏红明, 2008, 甘蔗近缘属野生种滇蔗茅(Erianthus rockii)的种质创新利用, 中国糖料, 2: 8-11)
Wang X.H., Yang Q.H., Li F.S., He L.L., and He S.C., 2010, Characterization of the chromosomal transmission of intergeneric hybrids of Saccharum spp. and Erianthus fulvus by genomic in situ hybridization, Crop Science, 50(5): 1642-1648
http://dx.doi.org/10.2135/cropsci2010.01.0004
Wang Y., Qiu H.Y., Gao H.Q., Huang D.Y., and Zhuang N.S., 2008, Study on extraction methods of sugarcane genomic DNA, Zhongguo Nongxue Tongbao (Chinese Agricultural Science Bulletin), 24(12): 44-49 (王英, 邱海燕, 高和琼, 黄东益, 庄南生, 2008, 甘蔗基因组DNA提取方法的研究, 中国农学通报, 24(12): 44-49)
Zhong S.B., Yao J.X., Zhang D.Y., and Li H.B., 1997, Application of DNA in situ hybridization to chromosome analysis in Triticeae, Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 30(1): 33-37 (钟少斌, 姚景侠, 张德玉, 李浩兵, 1997, 麦类作物DNA原位杂交及其在远缘杂种染色体分析中的应用, 中国农业科学, 30(1): 33-37)