作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2013 年, 第 11 卷, 第 28 篇 doi: 10.5376/mpb.cn.2013.11.0028
收稿日期: 2013年09月02日 接受日期: 2013年09月04日 发表日期: 2013年10月26日
引用格式(中文):
范鹏珍等, 2013, 一种更加安全的Northern印迹检测‘津田’芜菁中microRNA的方法, 分子植物育种(online), 11(28): 1206-1210 (doi: 10.5376/mpb.cn.2013.11.0028)
引用格式(英文):
Fan et al., 2013, A Safer Method for Northern Blot Analysis of MicroRNAs in Turnip Brassica rapa 'Tsuda', Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding), 11(28): 1206-1210 (doi: 10.5376/mpb.cn.2013.11.0028)
对于植物microRNA的Northern印记检测普遍使用变性聚丙烯酰胺凝胶和32P标记的探针,但是该方法具有丙烯酰胺和32P的潜在危害。为了克服这些缺陷并建立一种更加安全的检测microRNA的Northern印记的方法,我们采用4%的琼脂糖凝胶和地高辛标记的探针来分离和检测津田芜菁中的microRNA,最终成功地检测到了microRNA目的条带。这种方法既能够避免丙烯酰胺和32P对人体的潜在危害,又能够克服聚丙烯酰胺凝胶在溴化乙锭染色和转膜过程中极易破裂等缺陷,还能够省去预电泳的步骤,更加安全省时、方便操作。
MicroRNA(miRNA)是一类长度为20~24 nt的内源非编码小RNA,在植物生长发育以及抵抗胁迫等过程中发挥着重要作用。Northern 印记是检测miRNA表达量的方法之一,也是发现并命名新的miRNA(novel miRNA)的规则之一(Ambros et al., 2003)。
目前,对miRNA的Northern检测普遍使用变性聚丙烯酰胺凝胶电泳来分离条带。在探针的标记方面,由于miRNA的丰度一般都很低,为保证良好的信号强度和理想的实验结果,多数人选择使用放射性标记的探针(Luo et al., 2012; Pall et al., 2007; Válóczi et al., 2004; Xia et al., 2012);但从安全方面考虑,也有少量文献中使用安全性较高的地高辛标记的探针(Bari et al., 2006; Zhang et al., 2011)。
对miRNA 进行Northern检测时,上样电泳之前需要对聚丙烯酰胺凝胶进行预电泳。预电泳后胶孔中有尿素析出,上样前需要清除尿素;我们在以前检测津田芜菁(Brassica rapa 'Tsuda') miRNA的试验中,发现聚丙烯酰胺凝胶极易破裂,所以转膜、EB染色拍照等过程中需要格外小心,但是仍然得不到理想的实验结果;另外,丙烯酰胺单体是一种神经毒剂,配制和使用溶液时也要特别小心。我们尝试使用浓度为4%的琼脂糖凝胶来分离条带进行Northern检测,避免了聚丙烯酰胺凝胶的这些缺陷,多次试验都取得了较为理想的结果。因此,我们认为4%的琼脂糖凝胶结合地高辛标记的探针可以作为一种更加安全方便的方法来进行津田芜菁miRNA的Northern检测。
1结果与分析
1.1总RNA提取结果
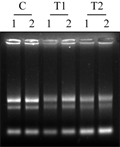
凝胶电泳结果显示,所有样品的总RNA均有5S、18S、28S 三条带;Nanodrop2000分光光度计测定后,浓度均在2 μg•μL-1以上,A260与A280 比值均在1.8 以上,浓度与纯度均符合实验要求。图1中字母C、T1、T2分别代表Control、Treatment 1和Treatment 2。
|
|
1.2电泳、切胶及转膜结果
30 μg RNA样品在100V电压下、4%琼脂糖凝胶中电泳约1.5 h后 (图2A),切除多余部分剩下包含10 bp~150 bp区域的凝胶(图2B),转膜完毕后在紫外凝胶成像仪中照相,能观察到有极微量的残留(图3),但总体来说转膜还比较彻底。
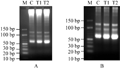 图2 RNA样品在4%琼脂糖凝胶中电泳结果图(A); 切除多余部分的4%琼脂糖凝胶图(B) Figure 2 Electrophoresis of RNA samples in 4% agarose gel (A); 4% agarose gel after removal of spare parts(B) |
|
|
1.3 X光片扫描、处理并计算灰度值
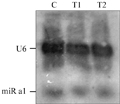
X光片扫描结果如图4所示,与图2B比照之后,内标U6条带在约100 nt处,miRa1条带在20~30 nt之间。图像经过处理、灰度扫描后的计算结果如图5所示。
|
|
|
|
2讨论
以上实验证明:4%琼脂糖凝胶Northern印迹检测津田芜菁中microRNA的方法是可行的。该方法既能够避免丙烯酰胺有毒、聚丙烯酰胺凝胶易碎等缺陷,又能够省去清除胶孔析出的尿素以及预电泳等步骤,还能够有效地分离目的条带,更加安全、方便、易操作。
由于microRNA在总RNA中所占的比例极低,故要保证足够的上样量。我们综合考虑上样量、胶孔容量、提取RNA的浓度等因素,经过多次试验,确定上样量30 μg,上样总体积为20 μL时效果更好。由于先前在蛭石中生长的幼苗,会带有一些杂质,导致提取的RNA样品纯度下降,因此我们使用1/2 Hogland营养液进行培养,结果获得了浓度和纯度都能够满足实验要求的样品。
预杂交后,可同时加入miRNA(如miR a1)探针和内标(U6)的探针进行孵育,这样在同一张膜上可以同时检测出目标miRNA和内标的条带,方便后续的分析。
陆明华等的实验方案中,显影之后的杂交膜进行探针剥离后于室温或-20℃冰箱中保存,可用于再次杂交,且检测顺序一般从低丰度到高丰度的RNA (陆明华和刘默芳, 2010, 中国细胞生物学学报, 32(2): 195-196)。而我们经过多次试验,发现丰度较大的内标U6即使在进行探针剥离后,经过洗膜、显影,仍然有“大量”的残留。由于miRNA的条带均在22 nt左右,如果一个丰度相对较低但能检测出条带的miRNA杂交后进行探针剥离仍有残留的话,用同一张膜做另外一个丰度相对较高的miRNA的杂交时,必然会影响其实验结果;如果一个丰度相对较低的miRNA杂交后没有检测出条带,剥离探针后可以用于检测另外一个丰度相对较高的miRNA。故我们认为,做miRNA Northern 印迹的膜一旦检测出一个miRNA的条带,应该尽量避免重复使用同一张膜进行另外一个miRNA的杂交,以免探针剥离不彻底而影响实验结果。
3结论
目前,miRNA的Northern 印迹检测均使用变性聚丙烯酰胺凝胶电泳来分离目的条带。由于探针标记方式的不同,造成显影结果有很大差异;一般来说,放射性标记要比地高辛标记的效果要好。但从安全方面考虑,应选择使用地高辛标记的探针。我们使用地高辛标记的探针,用4%的琼脂糖凝胶分离目的条带,显影后的结果并不亚于用变性聚丙烯酰胺凝胶电泳来分离目的条带所得到的结果,而且也比我们之前用变性聚丙烯酰胺凝胶来分离目的条带显影得到的结果要好许多。因此,我们认为4%的琼脂糖凝胶结合地高辛标记的探针作为一种更加安全的方法用于检测津田芜菁中的miRNA是可行的。
4材料与方法
4.1材料
将野生型津田芜菁种子播种在1/2 Hogland培养基上生长3d后,分别在3种不同条件下(Control, Treatment 1, Treatment 2)处理24 h,处理完毕后迅速包在锡纸中,液氮速冻后贮藏在-80℃冰箱中。
本文涉及到的各种缓冲液和试剂的配制参考《现代分子生物学模块实验指南》(李玉花, 2007, 高等教育出版社, pp.14-35)和Roche公司的《DIG Wash and Block Buffer Set》。
4.2方法
4.2.1总RNA样品制备
我们使用天根公司的Phase Lock GelTM Heavy 柱子配合TRNzolA+试剂提取总RNA;在0.8%琼脂糖凝胶中电泳检测,用Nanodrop2000 分光光度计(Thermal Scientific)测定浓度后,每个样品稀释成浓度2 μg•μL-1,总体积15 μL,即上样量为30 μg。样品保存于-20℃冰箱中备用。
4.2.2 4%琼脂糖凝胶的制备
准备好长12.5 cm、宽6 cm的胶槽(保证胶足够长, 宽度根据样品多少调整);称取2 g琼脂糖,量取50 mL 1× TAE 缓冲液,反复溶解至看不到明显的颗粒为止, 迅速用微量移液器加入2.5 μL EB (10 μg•mL-1),轻轻混匀,立即倒入胶槽中(高浓度的琼脂糖胶很容易凝固, 制备过程中操作要迅速),凝胶至少10 min。
4.2.3上样电泳
将准备好的RNA样品取出,置于冰上,待融化后每个样品中加入3 μL 6× Loading Dye和2 μL RNA上样缓冲液,混匀,瞬时离心;95℃金属浴中变性5 min;上样,并上3 μL 10 bp DNA Ladder (Fermentas)作为Marker,100 V 电泳约1.5 h。
4.2.4切胶
在紫外凝胶成像仪中拍照后,在胶上包含10 bp DNA Ladder 10 bp~150 bp的区域,切出约5cm × 5cm 的方形胶。
4.2.5转膜
裁5cm × 5cm 的3M 滤纸6张、尼龙膜1张,在1× TAE 缓冲液中浸泡5 min;将3张已浸湿的3M 滤纸一层一层铺在半干电转仪的平板上,在滤纸上铺上尼龙膜,将胶有RNA(背离胶孔)的一面朝下置于尼龙膜上,再将剩下的3张滤纸层层叠加铺在胶上,做成“三明治”,然后用玻璃棒在上面滚动,尽可能地赶走气泡, 可再添加一些TAE缓冲液使其更加湿润。盖上电转仪盖子,以恒定电流100 mA (约3.3 mA•cm-2)转膜约1 h。
转膜结束后,可用铅笔在膜上标记有RNA的那一面,并用剪刀剪掉一角以标记相对位置。将转膜后的胶拍照,确认目的条带所在位置的所有RNA被转到了尼龙膜上。
4.2.6交联
在膜还是湿润的时候,置于紫外凝胶成像仪中打开紫外灯,曝光30 s;然后将尼龙膜夹在两层干净的滤纸之间, 80℃烘烤30 min,使RNA完全固定在膜上。将膜储存在洁净密封袋中备用。
4.2.7预杂交
将Northern 杂交液37℃预热;准备杂交袋;将鲑精DNA(100 μg•mL-1)在95℃变性5 min后置于冰上。将交联后的尼龙膜放进杂交袋中,量取10 mL Northern 杂交液,再加入5 μL 鲑精DNA,混匀后加入杂交袋中,尽可能地挤尽袋中的气泡,封口;将杂交袋置于50℃水浴摇床中振荡孵育1 h。
4.2.8杂交
取5 μg•μL-1 探针10 μL加入杂交袋中,挤气泡,封口;42℃ 水浴,振荡孵育16 h(过夜)。
4.2.9洗膜、曝光
杂交完毕后,从杂交袋中取出尼龙膜,将有RNA的一面向上置于Washing I 溶液中,室温振荡5 min; 再将膜置于Washing II 溶液中,室温振荡30 min;然后将膜置于 1× Washing Buffer中,室温振荡5 min;将膜放入杂交袋中,加入10 mL 1× Blocking Buffer,挤气泡,封口,室温振荡30 min。
取1 μL Anti-digoxigenin-AP 加入杂交袋中,挤气泡,封口,室温振荡45 min;将膜置于1× Washing Buffer中室温振荡15 min,重复该步骤一次;将膜置于1× Detection Buffer中平衡 2~5 min。
将洗涤完毕的尼龙膜置于洁净透明的杂交袋中;取5 μL CDP-star 加入500 μL 1× Detection Buffer 中混匀,然后加入杂交袋中,去除气泡,黑暗条件下显色5 min。将杂交袋夹在吸水纸中间吸去多余的显色液,然后将装有膜的杂交袋放入暗盒中,在膜上压上X 光片,盖好暗盒,曝光约1 h。X光片显影和定影,观察杂交结果。
4.2.10 X光片扫描及灰度值计算
用扫描仪将定影后的X光片扫描,然后用ImageJ软件进行背景消除、调整亮度和对比度等处理后测出条带的灰度值;将miRNA条带灰度值除以内标条带的灰度值得到的比值作为比较miRNA表达量的依据。
作者贡献
周波是本研究的实验设计和实验研究的执行人;范鹏珍完成数据分析、论文初稿的写作;周波参与实验设计、试验结果分析;周波是项目的构思者及负责人,李玉花指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由中央高校基本科研业务费专项资金(DL11CA03)资助。
参考文献
Ambros V., Bartel B., Bartel D.P., Burge C.B., Carrington J.C., Chen X., Dreyfuss G., Eddy S.R., Griffiths-Jones S., Marshall M., Matzke M., Ruvkun G., and Tuschl T., 2003, A uniform system for microRNA annotation, RNA, 9(3): 277-279
http://dx.doi.org/10.1261/rna.2183803
PMid:12592000 PMCid:PMC1370393
Bari R., Datt Pant B., Stitt M., Scheible W.R., 2006, PHO2, microRNA399, and PHR1 define a phosphate-signaling pathway in plants, Plant Physiol., 141(3): 988-999
http://dx.doi.org/10.1104/pp.106.079707
PMid:16679424 PMCid:PMC1489890
Luo Q.J., Mittal A., Jia F., and Rock C.D., 2012, An autoregulatory feedback loop involving PAP1 and TAS4 in response to sugars in Arabidopsis, Plant Mol. Biol., 80(1): 117-129
http://dx.doi.org/10.1007/s11103-011-9778-9
PMid:21533841 PMCid:PMC3272322
Pall G.S., Codony-Servat C., Byrne J., Ritchie L., and Hamilton A., 2007, Carbodiimide-mediated cross-linking of RNA to nylon membranes improves the detection of siRNA, miRNA and piRNA by northern blot, Nucleic Acids Res., 35(8): e60
http://dx.doi.org/10.1093/nar/gkm112
PMid:17405769 PMCid:PMC1885651
Válóczi A., Hornyik C., Varga N., Burgyán J., Kauppinen S., and Havelda Z., 2004, Sensitive and specific detection of microRNAs by northern blot analysis using LNA-modified oligonucleotide probes, Nucleic Acids Res., 32(22): e175
http://dx.doi.org/10.1093/nar/gnh171
PMid:15598818 PMCid:PMC545470
Xia R., Zhu H., An Y.Q., Beers E.P., and Liu Z., 2012, Apple miRNAs and tasiRNAs with novel regulatory networks, Genome Biol., 13(6): R47
http://dx.doi.org/10.1186/gb-2012-13-6-r47
PMid:22704043 PMCid:PMC3446319
Zhang H., He H., Wang X., Wang X., Yang X., Li L., and Deng X.W., 2011, Genome-wide mapping of the HY5-mediated gene networks in Arabidopsis that involve both transcriptional and post-transcriptional regulation, Plant J., 65(3): 346-358
http://dx.doi.org/10.1111/j.1365-313X.2010.04426.x
PMid:21265889