2.北京市农林科学院蔬菜研究中心, 北京, 100097
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 20 篇 doi: 10.5376/mpb.cn.2011.09.0020
收稿日期: 2010年12月14日 接受日期: 2011年02月11日 发表日期: 2011年02月24日
曾兴莹等, 2011, 花椰菜与黑芥体细胞杂种不同世代甲基化变异MSAP分析, 分子植物育种 Vol.9 No.20 (doi: 10.5376/mpb.cn.2011.09.0020)
本文用 MSAP 法检测花椰菜与黑芥体细胞杂种回交一代到回交三代(BC1、BC2、BC3)及自交二代到自交四代(S2、S3、S4)的甲基化变异情况。结果表明:回交后代和自交后代之间的甲基化水平差异不大,但是回交后代的甲基化水平高于自交后代的甲基化水平。而且进一步深入的分析 DNA 甲基化在亲本和子代间的变异情况发现,甲基化变异类型主要以 B 类型(即子代与亲本之一带型一致的位点)为主,这说明甲基化变异并非无规律的变异,而是倾向于某一亲本变异类型,这可能是杂交过程中某一亲本的优势,也可能是新物种形成中淘汰那些不利变异的结果。
DNA甲基化(DNA methylation)主要发生在CG或CNG基元序列中,5-甲基胞嘧啶是植物DNA甲基化的主要形式。尽管DNA甲基化不改变DNA的碱基序列,但具有明显的表观遗传效应。许多研究表明,物种间的远缘杂交导致了表观遗传学的变化,其中不仅包括DNA胞嘧啶甲基化变异,还有基因表达和转录水平的变化 (Chan et al., 2005; Salmon et al., 2005)。通过对大米草(Salmon et al., 2005)、水稻(Xiong et al., 1999)、拟南芥(Madlung et al., 2002)等植物基因组的DNA甲基化研究发现,杂交后代基因组中DNA甲基化与亲本有明显的差异,并且表现出不同的甲基化模式,还有一些表现为过甲基化。所以研究者有理由相信这种不同的DNA甲基化模式变异是普遍存在的。
花椰菜(Brasica oleracea L. var. botrytis L.)为十字花科芸薹属一年生植物,起初由十字花科野生甘蓝演化而来,由于生长习性的演变和阶段性的变异,经不同环境条件和不同目标的选择和培育而形成的变种,因此是生物学研究的很好的试材。另外,由于它营养价值高、适应性广以及在我国分布广这些特点,因而深受育种者以及消费者的喜爱。但在生产中常常遭受黑腐、根肿、黑胫等多种病害的威胁,严重影响了花椰菜产量和品质。黑芥(Brassica nigra, 2n=16)是芸苔属三个基本种之一,具有黑腐病、黑胫病、根肿病抗性。本实验室通过体细胞杂交技术成功得到了杂种(Zhang et al., 2008),希望通过两者的体细胞杂交来实现抗病基因在远缘种间的转移。本实验对黑芥与花椰菜体细胞杂种的不同世代进行MSAP分析,分析早期世代基因组位点变化与甲基化模式变化特征及其对于育种上指导早期选择,以尽快获得遗传、表型及育性稳定的多倍体,用于回交育种以改良品种,也具有重要的实践意义。
1结果与分析
1.1位点的甲基化水平分析
由于同裂酶HpaⅡ和MspⅠ的酶切位点均为“CCGG/GGCC”,由于这两种酶的酶切位点的DNA序列甲基化敏感程度不同,所以根据对比HpaⅡ与MspⅠ不同的扩增模式可细分为:A型(如图1):均有带,代表非甲基化位点(或单链内甲基化);B型:HpaⅡ有带、MspⅠ无带,代表半甲基化位点;C型:HpaⅡ无带、MspⅠ 有带,代表完全甲基化位点。通过反复试验,共筛选出16对选择性扩增引物组合,并对MSAP图谱进行统计。8种材料MSAP图谱中共401条带,各材料检测到的甲基化位点分别为95、106、95、105、101、99、98、98条,亲本的整体甲基化水平为35.3%和39.1%;回交后代的整体甲基化水平分别37.5%、39.3%、37.7%;自交后代的整体甲基化水平分别为36.7%、36.6%、36.4% (表1)。可见,回交后代和自交后代之间的甲基化水平差异不大,但是回交后代的甲基化水平高于自交后代的甲基化水平。进一步分析发现,8种材料的半甲基化水平为6.0%、6.5%、6.7%、6.5%、6.2%、6.7%、6.5%、6.2%。全甲基化水平依次为17.7%、20.0%、19.0%、 19.7%、19.0%、18.0%、18.0%、18.3% (表1)。
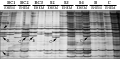 图1 引物E对双亲及杂种后代基因组的MSAP图谱示例 Figure 1 E primer on the parents and progeny genome map of MSAP |
表1 不同世代MSAP 扩增统计结果 Table 1 Statistical results of MSAP in different generation |
1.2亲本和子代间的遗传与变异
根据3种不同的带型,我们将进一步深入的分析DNA甲基化在亲本和子代间的变异情况。我们将所有的条带的模式统计(表2)。
 表2 甲基化模式在亲本和子代间的遗传与变异 Table 2 Methylation patterns in parents and offspring heredity and variation |
其中表中X位点代表的是未甲基化的单态性CCGG位点。A类型代表的是有胞嘧啶甲基化的单态性位点。B类型代表的是子代与亲本之一带型一致的位点。而C、D 类型代表子代与两个亲本带型不一致的位点,即子代新出现的带型。从表中可以看出,B类位点最为丰富,占所有位点的55%以上,而与亲本相比发生变异的位点在10.7%~15.2%之间。
2讨论
许多研究表明,不同的DNA胞嘧啶甲基化变异水平能够导致不同的基因表达和转录水平的变化。(Seheb et al., 2006)。而通过研究发现,杂交后代间基因组DNA甲基化与亲本相比有明显的差异,与亲本相比不仅有些位点表现为过甲基化,还有一些表现为去甲基化。本文以花椰菜和黑芥的体细胞杂种的回交后代以及自交后代为材料,以MSAP法检测了胞嘧啶甲基化水平以及甲基化变异模式。
实验结果显示:回交后代和自交后代的总体甲基化水平为37.5%、39.3%、37.7%和36.7%、36.6%、36.4%。各世代之间甲基化水平没有明显的差异,可能是由于本实验所用的材料都是回交和自交早代的材料,基因组还都处于一个相对不稳定的状态,不仅世代间DNA甲基化变异不明显,而且回交后代与自交后代之间总体的甲基化水平也无明显的差异。回交后代和自交后代的半甲基化水平分别为6.7%、6.5%、6.2%和6.7%、6.5%、6.2%,全甲基化水平分别为19.0%、19.7%、19.0%和18.0%、18.0%、18.3%,可以看出不论是回交后代还是自交后代的甲基化水平是以全甲基化水平为主要方式,而且回交后代的全甲基化水平高于自交后代,表明自交后代的甲基化遗传机制尚不稳定。
本研究结果表明:花椰菜和黑芥的体细胞杂种的回交后代和自交后代甲基化和非甲基化变异位点占所有甲基化位点的40.8%和42.5%,说明回交后代和自交后代间的甲基化位点大部分可以稳定遗传,在所有的变异位点中主要以B型为主,其余A、C、D三种类型较少,表明DNA甲基化变异是有规律的,它会倾向于某一个亲本类型,这可能是杂交过程中某一亲本的优势。
目前植物远缘杂交引起基因组DNA甲基化水平及模式在小麦一黑麦杂种(Houehins et al., 1997)、拟南芥属(Comai, 2000; Lee et al., 2001; Madlung et al., 2002)和小麦属(刘宝等, 2000, 多倍体小麦物种形成可诱发稳定遗传的胞嘧啶甲基化变异, 自然科学进展, 8: 710-715; Shaked et al., 2001; Kashkush et al., 2003)中所取得的一系列的研究成果,可以说明远缘杂种世代间表观遗传变异不仅与DNA序列变化有关而且与DNA胞嘧啶甲基化变异有关。
3材料与方法
3.1供试材料
试材为黑芥(B. nigra, BB, 2n=16)与花椰菜品种(B. oleracea var. botrytis, CC, 2n=18)及其体细胞杂种后代,分别S2、S3、S4代及以花椰菜为回交亲本,得到的BC1、BC2、BC3代。全部由北京市农林科学院蔬菜研究中心生物技术研究室提供。
3.2方法
DNA 的提取:取供试材料的叶片采用SDS法提取植物总DNA,并用紫外分光光度计检测其浓度。MSAP法检测基因组的甲基化变异,其中所有的接头、预扩增引物及选择性扩增引物的序列以Vos等(Vos et al., 1995)序列为参照,详见表3。所有序列由北京赛百盛基因技术有限公司合成。用EcoRⅠ/HpaⅡ和EcoRⅠ/MspⅠ两组限制性内切酶对DNA样品分别进行酶切。Taq酶和PCR反应体系试剂均购自北京全式金生物技术有限公司提供。酶切连接体系(20 μL)包括:5 μL模板DNA,2.5 μL 10×Tango Buffer,2.5 μL ATP,1 μL BSA,2 μL EcoRⅠ接头,2 μL HpaⅡ/MspⅠ接头,2 μL EcoRⅠ,2 μL HpaⅡ(或MspⅠ),1 μL T4连接酶,其余用ddH2O补齐。反应混合液在37℃反应6 h,8℃ 4 h,最后4℃反应过夜。然后酶切连接产物用ddH2O稀释10倍后作为预扩增反应的模板,其中模板量为4 μL。最后将预扩增所得的PCR产物稀释50倍后再次用于选择性扩增反应,并进行变性聚丙烯酰胺凝胶电泳分离和硝酸银染色检测。
 表3 MSAP分析的接头和引物序列 Table 3 MSAP adapters and primers used in this study |
作者贡献
刘凡老师、王桂香老师是本研究的实验设计和实验研究的执行人;在此研究中曾兴莹完成了论文初稿的写作、数据的分析以及结果分析。而且王桂香老师对此论文进行了修改。全体作者都阅读并同意最终的文本。
致谢
本研究由北京市科技计划项目(D08070500690803)和北京市科技计划项目(Z09090501040902)共同资助。
参考文献
Chan S.W., Henderson I.R., Jacobsen S.E., 2005, Gardening the genome: DNA methylationin Arabidopsis thaliana, NatRev. Genet., 6: 351-360 doi:10.1038/nrg1601 doi:10.1038/nrg1664
Salmon A., Ainouche M.L., Wendel J.F., 2005, Genetic and epigenetic consequences of recent hybridization and polyploidy in Spartina (Poaceae), Mol. Ecol., 14: 1163-1175 doi:10.1111/j.1365-294X.2005.02488.x
Xiong L.Z., Xucg, Maroof M.A.S., 1999, Patterns of cytosine methylationin an elite rice hybrid and it sparental lines detected by methylation sensitive amplification polymorphism technique, Mol. Gen. Genet., 261: 439-446 doi:10.1007/s004380050986
Madlung A., Masuelli R.W., Watson B., 2002, Remodeling of DNA methylation and phenotypic and transcriptional changes in synt hetic Arabidopsis allotet raploids, Plant Physiol., 129: 733-746 doi:10.1104/pp.003095
Zhang L., Zhao H., Chen B., 2008, Development and identification of interspecific somatic hybrids between cauliflower and black mustard, Zhiwuxue Tongbao (Chinese Bulletin of Botany), 25: 176-184 (张丽, 赵泓, 陈斌, 刘凡, 2008, 花椰菜与黑芥种间体细胞杂种的获得和鉴定, 植物学通报, 25: 176-184)
Vos P., Hogers R., Bleeker M., 1995, A FLP: a new techique for DNA finger printing, Nucleic Acids Research, 23: 4407-4414 doi:10.1093/nar/23.21.4407
Seheb H., Grossniklaus U., 2006, The first high-resolution DNA “methylome”, Cell, 126: 1025-1028
Houehins K., O’Dell M., Flavell R.B., 1997, Cytosine methylation and nueleolar dominance in cereal hybrids, Mol. Gen. Genet., 255: 294-301 doi:10.1007/s004380050500
Comai L., 2000, Genetic and epigenetic interactions in allopolyploid plants, Plant Mol. Biol., 43: 387-399 doi:10.1023/A:1006480722854
Lee H.S., Chen Z.J., 2001, Protein-coding genes are epigenetically regulated in Arabdopsis polyploids, Proc. Natl. Acad. Sei. USA, 98: 6753-6758 doi:10.1073/pnas.121064698
Madlung A., Masuelli R.W., Watson B., 2002, Remolding of DNA methylation and phenotypic and transcriptional changes in synthetic Arabdopsis polyploids, Plant Physiol., 129: 733-746 doi:10.1104/pp.003095
Shaked H., Kashkush K., Ozakan H., 2001, Sequence elimination and cytosine methylation are rapid and reproducible responses of the genome to wide hybridization and allopolyploidy in wheat, Plant Cell, 13: 1749-1759 doi:10.2307/3871316 doi:10.1105/tpc.13.8.1749
Kashkush K., Feldman M., Levy A.A., 2003, Transeription activation of retrotransposons alters the expression of adjacent genes in wheat, Nature geneties, 33: 102-106