2.华南农业大学园艺学院, 广州, 510642
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 66 篇 doi: 10.5376/mpb.cn.2011.09.0066
收稿日期: 2011年03月12日 接受日期: 2011年04月28日 发表日期: 2011年05月26日
徐小万等, 2011, 利用cDNA-AFLP技术分析不同耐性辣椒叶片表达差异, 分子植物育种 Vol.9 No.66 (doi: 10.5376/mpb.cn.2011.09.0066)
为鉴定辣椒高温高湿双重胁迫响应基因,应用cDNA-AFLP技术,以辣椒耐高温高湿品种(系)-Ⅰ品种(系)和极不耐高温高湿品种(系)-D品种(系)为试材,对高温高湿胁迫4~6片叶期辣椒叶片基因表达进行了mRNA指纹分析。选取6对差异较明显的引物组合扩增结果,对基因表达的异同进行了统计,共分离得到315条TDFs,其中277条TDFs与高温高湿胁迫无关,13条TDFs高温高湿胁迫诱导表达,16条TDFs高温高湿胁迫抑制表达,4条TDFs在耐高温高湿材料中特异表达,5条TDFs在热湿敏感材料中特异表达,为下一步获得有价值的耐热湿相关基因奠定了初步基础。
辣椒(Capsicum annuum L.)主要起源于墨西哥、危地马拉等地,现已成为我国第二大蔬菜作物。但由于过高的温度和空气湿度易造成辣椒早衰、生育期缩短、产量品质下降,现已成为华南高温多湿地区辣椒生产的主要限制因素之一;而且温度和湿度总是同时存在,相互影响,综合作用。因此,提高辣椒的耐高温多湿能力是目前辣椒育种研究的重要内容之一,正确理解辣椒的耐逆机制是耐逆育种的基础。徐小万等(2008; 2009a; 2009b; 2010)从形态、生理以不同的生长发育期对辣椒耐热耐湿做了大量前期研究。基因的差异表达研究是获得抗逆相关基因的有效途径。目前,在转录水平上对植物 外界非生物胁迫应答机制的研究主要集中在拟南芥、小麦、水稻等模式植物,以辣椒为试材研究的相对较少;研究的胁迫类型以干旱、冷害、盐胁迫为主,以高温胁 迫或湿涝胁迫为研究对象的则很少,对植物高温胁迫应答机制的研究也很有限,尚未见到关于高温高湿双重逆境下辣椒转录谱动态变化的研究报道(Zhang et al., 2005; Rensink et al., 2005)。cDNA-AFLP是近年来发展起来的一种重要的转录基因组学研究工具,具有高效、灵敏、重复性强等特点,被广泛用于基因差异表达的研究 (Vandenabeele et al., 2003; Bove et al., 2005)。因此,本研究采用cDNA-AFLP技术研究高温多湿逆境下辣椒叶片基因的差异表达情况,以期为获得有价值的耐热湿相关基因奠定初步基础。
1结果与分析
1.1 RNA提取和检测
作为cDNA合成的原料,试验分别提取了对照与处理的耐高温高湿湿品种(系)——Ⅰ品种(系)和极不耐高温高湿品种(系)——D品种(系)第4片叶中总RNA,每个样品约0.1 g。各样品RNA没有蛋白质、酚类物质污染,总RNA OD260/OD280值在1.8~2.0之间;RNA普通琼脂糖凝胶电泳(图1),RNA没有发生降解,总RNA质量较好,适于cDNA合成,28S、18S和5S rRNA三条带清晰,28S rRNA和18S rRNA条带整齐。
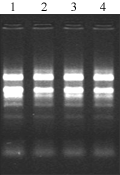
图1 对照与处理Ⅰ、D品种(系)叶片总RNA电泳分析
Figure 1 Electrophoresis of total RNA in the Ⅰ, D line
1.2 cDNA合成
以图1提取的总RNA为材料合成cDNA(图2),结果表明29个循环为cDNA的第二链合成最佳的循环数;合成的双链cDNA质量较好,cDNA在0.1~3 kb之间形成Smear。为保证合成产物浓度相当,个别泳道长度稍短的样品加了3~5个循环。
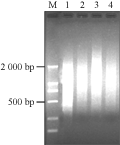
图2 对照与处理Ⅰ、D品种(系)叶片总RNA反转录后cDNA电泳分析
Figure 2 Electrophoresis of cDNA reverse transcripted from total RNA in the Ⅰ, D line
1.3 cDNA-AFLP结果分析
为分离与辣椒耐高温高湿有关的基因,对耐高温高湿性较强的Ⅰ品种(系)和对热湿极敏感的D品种(系)在高温高湿胁迫前后的基因表达情况进行了分析,进行选择性扩增先后用66对引物组合,共获得cDNA扩增条带3 200多条,长度分别在100~600 bp之间(图3)。选取扩增结果差异较明显的6对引物组合,对基因表达的异同进行统计(表1)。87.94%的条带在4个样品中均有表达,初步认为其可能 代表了辣椒中的house-keeping基因,在高温高湿胁迫前后的表达量没有明显变化。在4个样品中有差异的条带占12.06%,其中两个品种(系) 高温高湿胁迫后表达量均明显增强的条带占4.13% (stress inducible fragments at high temperature and high air humidity, SIN),在两个品种(系)中高温高湿胁迫后表达量明显减弱的条带占5.08% (stress suppressible gene at high temperature and high air humidity, SS),可能代表辣椒共有的与高温高湿胁迫相关的基因,与遗传背景无关。而在耐高温高湿品种(系)中受高温高湿胁迫诱导特异表达基因(expressed gene induced at high temperature and high air humidity in resistant line, SIR)的扩增产物占1.27%;在热湿敏感品种(系)中受高温高湿胁迫诱导(expressed gene induced at high temperature and high air humidity in susceptible line, SIS)特异表达基因的扩增产物占1.59%。这些扩增产物与各自遗传背景密切相关,代表了耐高温高湿或对热湿敏感的辣椒叶片中高温高湿诱导表达的基因, 可能与耐高温高湿或对热湿敏感的机制有关。
![]()
图3 cDNA-AFLP分析获得的差异表达片段
Figure 3 Different expression fragments gotten from cDNA-AFLP analysis

表1 cDNA-AFLP 片段差异表达分析
Table 1 Analysis of differentially expressed fragments from cDNA-AFLP
2讨论
在非生物逆境胁迫下植物基因表达模式发生改变,诱导表达一部分基因、同时抑制表达另一部分基因,以抵御非生物胁迫(Altenbach and Kothari, 2004)。本研究所得差异片段也反映了这一变化。Bachem等(1996)年发展了cDNA-AFLP技术,将AFLP用于mRNA的表达差异分析, 保留了AFLP技术的可靠性与高效性、又具有可重复性(Money et al., 1996),可用于植物生长发育过程中基因的分离与表达特性分析。
Bachem等(1998)比较了RAD-PCR、DD-PCR及cDNA-AFLP技术对反应条件及模板质量的敏感性,结果表明cDNA-AFLP要明显地优于前两者。目前cDNA-AFLP技术已经被广泛地应用于基因的表达差异研究,并且被证实是比较有效的。杨寅桂等(2007)对黄瓜幼苗进行热激处理2 h,采用cDNA-AFLP技术分离到了黄瓜热激响应基因。李浩等(2007)于小麦开花后15~18 d (灌浆中期)及30~33 d (灌浆后期)分别进行连续3 d的高温胁迫处理,通过cDNA-AFLP分析获得差异条带,结果表明高温胁迫对灌浆中期基因表达的影响比灌浆后期显著,实验中2个品种在高温胁迫下的基 因表达模式存在显著差异。刘志勇等(2008)为鉴定番茄高温胁迫响应基因,应用cDNA-AFLP技术,对高温胁迫早期叶片基因表达进行了mRNA指纹分析。通过768对引物组合的筛选,共分离得到187个差异表达的转录衍生片段(TDFs),其中增强表达或高温胁迫下特异性表达TDFs 153条,抑制表达34条。
本研究用66对引物组合进行选择性扩增,共获得cDNA扩增条带3 200多条,长度分别在100~600 bp之间。本研究表明,cDNA-AFLP技术适合于研究辣椒热湿胁迫条件下基因的表达差异,选取扩增结果差异较明显的6对引物组合,统计了基因表达异同,共分离得到315条TDFs,其中277条TDFS与高温高湿胁迫无关,13条TDFs高温高湿胁迫诱导表达,16条TDFs高温高湿胁迫抑制表达, 4条TDFs在耐高温高湿材料中特异表达,5条TDFs在热湿敏感材料中特异表达。本研究为进一步研究辣椒耐热湿相关基因奠定了初步基础,但试验没有进一 步对差异条带进行测序分析,可以利用RACE或电子克隆的方法获取其全长基因,进一步研究与辣椒耐热湿性之间的关系。
3材料与方法
3.1植物材料与胁迫处理
本研究采用前期已鉴定的耐高温多湿品种(系)——Ⅰ品种(系)和热湿敏感品种(系)——D品种(系) (徐小万等, 2009a; 2009b),在4~6片叶期时,将其幼苗移入华南农业大学测试中心人工气候室(光照强度20 000 LX)进行如下处理:对照,7:00~19:00温度维持28℃,19:00~7:00温度维持18℃,使昼夜温差为10℃,RH为75%。高温高湿处理,7:00~19:00温度维持40℃,19:00~7:00温度维持30℃,使昼夜温差为10℃,空气相对湿度为90%,4 d后取第四片叶,液氮速冻后,保存于-80℃备用。
3.2总RNA提取及双链cDNA的合成
制备RNA的离心管、枪头等用0.1%的DEPC水浸泡处理。叶片总RNA的提取采取Trizol法(Invitrogen公司),按使用说明操作。1.5%普通琼脂糖凝胶电泳检测RNA的完整性,同时用核酸蛋白仪测定RNA的浓度。双链cDNA引用SMARTTM PCR CDNA Synthesis Kit的方法合成。
3.3 cDNA-AFLP差异片断分析
cDNA-AFLP分析参考王永勤等(2003)的方法,扩增产物在6%聚丙烯酰胺凝胶上电泳分离,银染检测。上海生工生物技术服务有限公司合成cDNA-AFLP的引物和接头,AseⅠ和TaqⅠ接头和引物序列见表2。

表2 AseⅠ和TaqⅠ接头和引物序
Table 2 Adaptor and primer sequence of AseⅠ and TaqⅠ
作者贡献
徐小万、雷建军是本研究的实验设计和实验研究的执行人;徐小万完成数据分析,论文初稿的写作。全体作者都阅读并同意最终的文本。
致谢
本研究由现代农业产业技术体系建设专项基金及广东省科技计划项目(2009B060600004, 2010B020304001)共同资助。
参考文献
Altenbach S.B., and Kothari K.M., 2004, Transcript profiles of genes expressed in endosperm tissue are altered by high temperature during wheat grain development, J. Cereal Sci., 40: 115-126 doi:10.1016/j.jcs.2004.05.004
Bachem C.W., Van der Hoeven R.S., De Bruijn S.M., Vreugdenhil D., Zabeau M., and Visser R.G., 1996, Visualization of differential gene expression using a novel method of RNA fingerprint based on AFLP: analysis of gene expression during potato tuber development, The plant Journal, 9(5): 745-753 doi:10.1046/j.1365-313X.1996.9050745.x
Bachem C.W.B., Oomen R.J.F.J., and Visser R.G.F., 1998, Transcript imaging with cDNA-AFLP: a step-by-step protocol, Plant Molecular Biology Reporter, 16(2): 157-173 doi:10.1023/A:1007468801806
Bove J., Lucas P., Godin B., Ogé L., Jullien M., and Grappin P., 2005, Gene expression analysis by cDNA-AFLP highlights a set of new signaling networks and translational control during seed dormancy breaking in Nicotiana plumbaginifolia, Plant Mol. Biol., 57(4): 593-612 doi:10.1007/s11103-005-0953-8
Li H., Zhang P.P., Zha X.D., Xia X.C., and He Z.H., 2007, Isolation of differentially expressed genes from wheat cultivars jinan17 and Yumai34 with good bread quality under heat stress during grain filling stage, Zuowu Xuebao (Acta Agronomica Sinica), 33(10): 1644-1653 (李浩, 张平平, 查向东, 夏先春, 何中虎, 2007, 优质面包小麦品种济南17和豫麦34灌浆期高温胁迫差异表达基因的分离, 作物学报, 33(10): 1644-1653)
Liu Z.Y., Du Y.C., Wang X.X., Guo Y.M., and Gao J.C., 2008, Identification of differentially expressed genes by cDNA-AFLP approach during heat stress in tomato leaves, Yuanyi Xuebao (Acta Horticulturae Sinica), 35(7): 1011-1016 (刘志勇, 杜永臣, 王孝宣, 国艳梅, 高建昌, 2008, 高温胁迫下番茄叶片差异表达基因的cDNA-AFLP分析, 园艺学报, 35(7): 1011-1016)
Money T., Reader S., Qu L.J., Dunford R.P., and Moore G., 1996, AFLP-based mRNA fingerprinting, Nucleic Acids Research, 24(13): 2616-2617 doi:10.1093/nar/24.13.2616
Rensink W.A., Iobst S., Hart A., Stegalkian S., Liu J., and Buell C.B., 2005, Gene expression profiling of potato responses to cold, heat and salt stress, Functional&Integrative Genomics, 5(4): 201-207
Vandenabeele S., Van Der Kelen K., Dat J., Gadjev I., Boonefaes T., Morsa S., Rottiers P., Slooten L., Montagu M.V., Zabeau M., Inzé D., and Van Breusegem F., 2003, A comprehensive analysis of hydrogen peroxide-induced gene expression in tobacco, PNAS, 100(26): 16113-16118 doi:10.1073/pnas.2136610100
Wang Y.Q., Cao J.S., Fu Q.G., Yu X.L., Ye W.Z., and Xiang X., 2003, Differential expression analysis of genic male sterilityA/B lines by cDNA-AFLP in Chinese cabbage-pak-choi (B rassica cam pestris ssp, Chinensis Makino), Zhongguo Nongye Kexue (Scientia Agricultura Sinica), 36(5): 557-560(王永勤, 曹家树, 符庆功, 余小林, 叶纨芝, 向珣, 2003, 利用cDNA-AFLP技术分析白菜核雄性不育两用系的表达差异, 中国农业科学, 36(5): 557-560)
Xu X.W., Cao B.H., Chen G.J., Chen Q.H., and Lei J.J., 2008, Effects of high temperature and air humidity stress on antioxidant system and antioxidant activity differences of hot pepper varieties, Huabei Nongxuebao (Acta Agriculturae Boreali-Sinica), 23(1): 81-86 (徐小万, 曹必好, 陈国菊, 陈清华, 雷建军, 2008, 高温高湿对辣椒抗氧化系统的影响及不同品种抗氧化性差异研究, 华北农学报, 23(1): 81-86)
Xu X.W., Lei J.J., Li Y., Wang H.M., Cao B.H., and Chen G.J, 2009a, Gray relational grade analysis of physic-biochemical traits related to high temperature and air humidity resistance in hot Pepper, Xibei Nongye Xuebao (Acta Agriculturae Boreli-occidentalis Sinica), 18(5): 241-245 (徐小万, 雷建军, 李颖, 王恒明, 曹必好, 陈国菊, 2009a, 辣椒耐高温高湿生理生化性状灰色关联度分析, 西北农业学报, 18(5): 241-245)
Xu X.W., Lei J.J., Luo S.B., Cao B.H., Chen G.J., Li Y., and Wang H.M., 2009b, Identification of hot pepper (Capsicum annuum L.) seedling for high temperature and air humidity resistance, He Nongxuebao (Journal of Nuclear Agriculturae Sciences), 23(5): 884-890 (徐小万, 雷建军, 罗少波, 曹必好, 陈国菊, 李颖, 王恒明, 2009b, 辣椒苗期耐热耐湿鉴定方法的研究, 核农学报, 23(5): 884-890)
Xu X.W., Lei J.J., Luo S.B., Li Y., Wang H.M., Tian Y.H., and Zeng Li., 2010, Effects of high temperature and air humidity stress on antioxidant activity differences of hot pepper varieties at budding stage, He Nongxuebao (Journal of Nuclear Agriculturae Sciences), 24(2): 394-400 (徐小万, 雷建军, 罗少波, 李颖, 王恒明, 田永红, 曾莉, 2010, 高温高湿对不同品种(系)现蕾期辣椒(Capsicum annuum L.)抗氧化的影响, 核农学报, 24(2): 394-400)
Yang Y.G., Lou Q.F., Zhuang Y., Zhang W.P., and Chen J.F., 2007, Isolation of heat response-related gene in cucumber seedlings, Shengtaixue Zazhi (Chinese Journal Of Ecology), 26(7): 1034-1037 (杨寅桂, 娄群峰, 庄勇, 张万萍, 陈劲枫, 2007, 黄瓜幼苗热胁迫响应基因的分离, 生态学杂志, 26(7): 1034-1037)
Zhang Y., Mian M.A.R., Chekhovskiy K., So S., Kupfer D., Lai H.S., and Roe B.A., 2005, Differential gene expression in festuca under heat stress conditions, Journal of Experimental Botany, 56(413): 897-907 doi:10.1093/jxb/eri082