作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 74 篇 doi: 10.5376/mpb.cn.2011.09.0074
收稿日期: 2011年03月10日 接受日期: 2011年05月25日 发表日期: 2011年06月15日
陈罡等, 2011, 美国白蜡SRAP-PCR反应体系的建立与优化, 分子植物育种 Vol.9 No.74 (doi: 10.5376/mpb.cn.2011.09.0074)
本研究利用正交试验设计L16 (45)对美国白蜡SRAP-PCR反应体系的五个因素(Mg2+, dNTP, 引物, Taq DNA聚合酶和模板DNA)在四个水平上进行优化试验,结果表明,Mg2+浓度对反应体系的影响最大;建立的美国白蜡SRAP-PCR最佳体系(25 μL)为:Mg2+ 2.5 mmol/L、Taq DNA聚合酶 0.5 U、dNTPs 0.25 mmol/L、引物 0.4 μmol/L、模板DNA 40 ng/μL。利用优化后的反应体系对4个美国白蜡材料进行了种间多态性检测,结果表明,该体系能够很好的满足美国白蜡基因组SRAP扩增的要求。这一优化体系的建立为今后利用SRAP标记技术对美国白蜡进行分子遗传研究提供基础。
美国白蜡(Fraxinus americana)又名白梣,木犀科落叶乔木,原产北美,抗逆性强,适生范围广,是良好的水土保持经济树种。另外,其树型美观,树冠茂密,绿叶期较长,也是城市绿化的优良树种。目前应用分子标记技术在白蜡树种上的研究尚未见报道,因此,开展新型分子标记技术研究对促进白蜡育种进程具有重要的指导作用。
SRAP标记是由美国加州大学Li和Quiros博士(Li and Quiros, 2001)开发的一种基于PCR扩增的分子标记技术,其利用一对正反引物对开放阅读框(ORFs)扩增而产生多态性。与其他分子标记相比,该标记具有简单快速、稳定性好、多态性高、不需预知物种序列等优点,目前已在植物遗传多样性分析、遗传图谱构建及种质鉴定等领域广泛应用。对于SRAP-PCR扩增体系已在多种植物研究中建立,但在美国白蜡中尚未见报道。本研究利用正交设计,以美国白蜡为材料,建立了一套对其适宜的SRAP-PCR反应体系,旨在为进一步开展美国白蜡种质资源遗传多样性研究奠定工作基础。
1结果与分析
1.1美国白蜡基因组DNA的提取及浓度检测
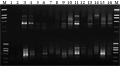
采用改良的CTAB法(钟鸣等, 2002)对美国白蜡基因组DNA进行提取,利用紫外分光光度计及1%琼脂糖凝胶电泳检测其浓度及质量,电泳结果图中电泳条带清晰完整(图1),所得的DNA质量较高,能够完全满足后续的实验要求。经过稀释使其浓度在20 ng/μL左右。
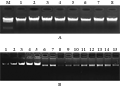 图1 1%琼脂糖检测基因组DNA 注: A: M: λDNA/Hind Ⅲ marker; 1~8: 美国白蜡基因组DNA; B: 1~5: λDNA, 从左到右分别为15 ng, 30 ng, 60 ng, 90 ng, 150 ng; 6~15: 稀释后的DNA Figure 1 The total DNA isolates checked by 1% Agrose gel Note: A: M: λDNA/Hind Ⅲ marker; 1~8: The total DNA of Fraxinus Americana; B: 1~5: λDNA, from left to right, 15 ng, 30 ng, 60 ng, 90 ng, 150 ng; 6~15: 20 ng/μL dilution |
1.2引物筛选
同一模板DNA,16个不同引物组合对其扩增条带的多少和清晰度都不同,有的引物组合能够扩增出清晰、丰富的条带,有的引物组合扩增的条带较少、模糊(图2)。因此,在SRAP-PCR反应中,应通过不同的引物组合,筛选条带丰富、清晰的引物作为扩增引物。
|
图2 不用引物组合对扩增结果的影响 注: M: DL2000 marker; 1~16: 16个SRAP引物组合 Figure 2 The influence of different match primers on amplified products Note: M: DL 2000 marker; 1~16: 16 different match primers combination |
1.3正交试验电泳结果分析
按表1设计的16个处理进行PCR扩增后,产物用1.2%琼脂糖凝胶电泳检测(图3),根据条带数量丰富度、扩增条带敏感性与特异性进行打分(何正文等, 1998),即背景深、条带多且清晰的记16分,反之记为1分。从两次分别独立的打分结果来看,两个重复统计比较一致。通过统计分析,求出各水平的均值T1、T2、T3、T4和各因素的极差R值。结果表明:各因素水平变化对PCR反应的影响均较大,其中Mg2+浓度对扩增结果的影响最大,引物浓度影响最小。
 表1 PCR反应L16 (45)正交设计表 Table 1 L16 (45) orthogonal design of PCR reaction |
1.4 Mg2+浓度对SRAP扩增结果的影响
从Mg2+浓度与PCR评分结果关系来看,Mg2+浓度各水平间均达到显著水平,说明Mg2+浓度对PCR结果的影响较大(图4)。研究表明,Mg2+浓度对PCR扩增的产量和特异性有显著的影响,当Mg2+浓度过低时,会降低Taq DNA聚合酶活性,使反应产物减少;浓度过高时,反应特异性降低,则产生非特异性扩增。本实验结果1.5 mmol/L~2.0 mmol/L范围内结果均值随Mg2+浓度的增加而下降,这可能是由于反应各因素的共同作用等原因所致。因此,选择2.5 mmol/L为最佳浓度水平。
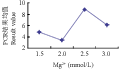 图4 Mg2+浓度与PCR评分结果关系图 Figure 4 Relationship between Mg2+ concentration and PCR score results |
1.5 dNTPs浓度对SRAP扩增结果的影响
dNTPs为PCR反应中的原料,其浓度过低会影响扩增效果,降低产率;过高则会影响扩增的准确性,且dNTPs能与Mg2+结合,使游离的Mg2+浓度下降而影响聚合酶活力;同时dNTPs浓度过高也会导致不必要的浪费。从dNTPs浓度与PCR评分结果关系可以看出,在0.15 mmol/L~0.3 mmol/L范围内,随着dNTPs浓度的增加PCR结果均值总体呈上升趋势,在0.25 mmol/L时达到最高,随后呈下降趋势;除0.2 mmol/L与0.3 mmol/L水平间差异不显著外,其余各水平间均差异显著,最终选择0.25 mmol/L为最佳浓度水平(图5)。
 图5 dNTPs浓度与PCR评分结果关系图 Figure 5 Relationship between dNTPs concentration and PCR score results |
1.6 Taq DNA聚合酶浓度对SRAP扩增结果的影响
Taq DNA聚合酶浓度是影响PCR反应的一个重要因素,酶的浓度过低会影响扩增效率,使扩增产物量减少;浓度太高容易导致非特异性扩增,并且会造成浪费。由Taq酶浓度与PCR评分结果关系可知,Taq酶在0.5 U、1.5 U和2.0 U水平间差异不显著,而三个水平均与1.0 U水平差异显著。0.5 U~1 U范围内结果均值明显下降,随后又随酶浓度的升高而上升(图6),这一结果可能是由于直观分析以及反应各因素的相互作用等原因所致。催化典型的PCR反应约需酶量2.5 U(总反应体积为100 μL)。本实验采取25 μL体积,而且0.5 U时已经达到了较好的扩增效果,因此选择0.5 U为最佳反应水平。
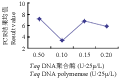 图6 Taq酶浓度与PCR评分结果关系图 Figure 6 Relationship between Taq DNA polymerase concentration and PCR score results |
1.7引物浓度对SRAP扩增结果的影响
引物浓度过低时,其与模板DNA的结合率降低,扩增产物量少;浓度过高时会引起非特异性扩增,易形成引物二聚体。从引物浓度与PCR评分结果关系可以看出,引物浓度在0.2 μmol/L~0.5 μmol/L范围内呈先上升后下降的趋势,0.3 μmol/L和0.5 μmol/L水平间差异不显著,其余每二者之间的差异均达到显著水平。当在0.4 μmol/L~0.5 μmol/L水平范围内,随着引物浓度的增高,结果均值呈下降趋势(图7),这说明过高的引物浓度在一定程度上影响了扩增条带的数目和质量,因此,选择0.4 μmol/L为最佳浓度水平。
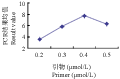 图7 引物浓度与PCR评分结果关系图 Figure 7 Relationship between primer concentration and PCR score results |
1.8模板DNA浓度对PCR结果的影响
DNA是PCR反应的模板,DNA浓度过低时扩增条带少且模糊;浓度过高则易产生非特异扩增,出现扩增结果不稳定的假象。本试验反应结果,DNA在10 ng•25/μL和20 ng•25/μL水平间差异不显著,10 ng•25/μL~80 ng•25/μL水平呈显著上升趋势,其余水平间差异极显著(图8)。已有研究表明,模板DNA的适合范围较宽,由于低DNA浓度容易导致反应体系不稳定,同时为降低TE缓冲液中EDTA对反应中Mg2+的影响,综合考虑,最终选定40 ng•25/μL为最佳反应浓度。
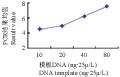 图8 模板DNA浓度与PCR评分结果关系图 Figure 8 Relationship between DNA template concentration and PCR score results |
1.9美国白蜡SRAP-PCR反应体系的验证及不同种源间多态性检测
为了进一步验证优化扩增体系的有效性,随机选用8对引物组合对4个不同种源的美国白蜡(亚拉巴马种源,宾夕法尼亚种源, 密西西比种源及田纳西种源)材料进行SRAP-PCR扩增,产物经聚丙烯酰胺凝胶电泳及银染后检测,结果均扩增出清晰的谱带并表现出很好的稳定性(图9),说明本试验建立扩增体系是可行的。选用的8对引物组合均能在4个材料中扩增出多态性条带,且多态性位点丰富,说明SRAP标记适合用于美国白蜡品种的遗传多样性分析及分子鉴定。
 图9 8对引物组合在4个不同种源美国白蜡材料中扩增出的SRAP条带 Figure 9 SRAP fragment amplified by primer combination in different material Fraxinus americana |
2讨论
美国白蜡生长速度快,绿化效果好,是沿海湿地造林的优良树种之一。因其抗逆性强,具有优良的抗逆基因资源,是进行林木抗性育种研究的理想材料。由于美国白蜡遗传基础材料匮乏,并且为多年生木本植物、世代周期长、遗传高度复杂等原因,利用传统林木遗传育种的方法难以在分子水平上揭示其遗传基础。DNA分子标记技术是直接对其DNA进行研究,不受环境和发育阶段的影响,更具目的性和高效性,是对其进行遗传图谱构建、不同品种遗传多样性分析、良种鉴定及抗性基因定位等研究的有力工具。
SRAP标记是目前一种较为理想的分子标记技术,与其他常用的分子标记相比,弥补了它们的一些不足,而且更能反应表型的多样性及进化史(Ferriol et al., 2003a, 2003b),提供的信息也更为优良(Ferriol et al., 2004)。SRAP标记引物通用性强,不需要预知物种的序列信息,因此应用广泛。目前,已经在蔬菜作物、果树等多种植物的遗传育种研究中成功应用,在林木指纹图谱建立(王宇等, 2007, 林业实用技术, (5): 3-5)、种质鉴定(於朝广等, 2009)及林木遗传多样性分析(陈罡等, 2010; 王骞春等, 2010, 辽宁林业科技, (6): 19-21, 48)等方面研究也已陆续开展,本试验首次对美国白蜡的SRAP-PCR扩增体系进行优化,建立的扩增体系稳定可靠,能够很好的用于美国白蜡分子遗传育种研究。
由于SRAP标记是一种基于PCR的分子标记技术,扩增结果受反应条件、材料、药品及仪器不同等因素的影响,因此在应用前应对其扩增体系进行优化,根据实际所用进行调整。SRAP体系优化的方法有多种,本试验对其反应体系中5个因素进行正交设计,得到了美国白蜡SRAP-PCR的最佳扩增体系,试验快捷简便,结果科学可靠。但该方法也存在一定局限性,在对扩增谱带的优劣判断上带有一定的主观成分,不能很好地说明各因素间的互作等,如果能够建立客观的PCR扩增结果评价标准,则能极大的促进以PCR技术为基础的分子标记技术的应用。
3材料与方法
3.1试验材料
供试材料为辽宁省林业科学研究院从美国引进不同种源的美国白蜡成熟饱满种子,经组培扩繁获得实生苗后,剪取其幼嫩叶片-70℃保存备用。
3.2基因组DNA提取
采用CTAB法并略加改进后提取基因组DNA。用1%琼脂糖凝胶电泳检测提取DNA的质量及完整性,并用UV1102紫外分光光度计测定其浓度,选出适宜的作为模板DNA,稀释至所需浓度后,-20 ℃保存备用。
3.3引物筛选
SRAP引物采用已发表(Li and Quiros, 2001)的引物组合,由北京赛百胜生物公司合成。随机选取16对引物组合,参考Li和Quiros的扩增反应体系及程序,进行引物筛选,选择条带丰富清晰的引物组合进行优化实验。
3.4 SRAP-PCR反应体系及扩增条件
采用正交设计确定PCR反应中5个因素(Mg2+, dNTP, 引物, Taq DNA聚合酶及模板DNA)的最佳水平,正交设计方案(表1)。随机选取一个模板按表1中的16个处理进行实验,每处理重复2次。扩增反应均在PTC-200型PCR仪(BIO-RAD)上进行。反应总体系为25 μL,扩增程序首先是94 ℃预变性5 min;然后前5个循环为:94 ℃变性30 s,37 ℃退火30 s,72℃延伸1 min;随后的35个循环为:94 ℃变性30 s,50 ℃复性30 s,72 ℃延伸1 min;最后72 ℃延伸8 min,4 ℃保存。扩增产物用2%琼脂糖凝胶电泳进行分离,经EB染色后在Gel-2000凝胶成像系统(BIO-RAD)上观察和记录。以上实验所用试剂均购自北京TIANGEN生物有限公司。
3.5 SRAP-PCR反应体系验证及不同种源美国白蜡多态性检测
在优化后的反应体系基础上,选取4个不同种源的美国白蜡材料进行体系验证,并对其进行SRAP多态性检测。PCR产物用8%非变性聚丙烯酰胺凝胶电泳进行分离,银染法染色显影后,用数码相机拍照并观察。
作者贡献
陈罡、叶景丰和马冬菁是本研究的实验设计和实验研究的执行人;陈罡完成数据分析、论文初稿的写作;王骞春和潘文利参与实验设计,试验结果分析;范俊岗是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家林业局“948”项目(2007-4-15)“抗寒耐盐碱美国白蜡优良种源及盐碱土壤改良技术引进”课题资助。作者感谢辽宁省农业生物技术重点实验室的师生在本实验过程中提供的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。本文中提到了我们实验中涉及的有关仪器和试剂供应商,这并非我们为这些仪器和试剂供应商的产品和服务提供推荐或背书。
参考文献
Chen G., Xing Z.K., Pan W.L., Guan M.D., Wei Z.P., Ye J.F., Ma D.J., and Gao J., 2010, Genetic diversities of Populus in Liaoning area by using SRAP marker, Dongbei Linye Daxue Xuebao (Journal of Northeast Forestry University), 38(10): 19-22 (陈罡, 邢兆凯, 潘文利, 关明东, 魏忠平, 叶景丰, 马冬菁, 高军, 2010, 辽宁地区主栽杨树品种的SRAP标记遗传多样性分析, 东北林业大学学报, 38(10): 19-22)
Ferriol M., Pico B., Fernandez De Corddova P., and Nuez F., 2004, Molecular diversity of a germplasm collection of squash (Cucurbita moschata) determined by SRAP and AFLP marker, Crop Science, 44(2): 653-664
Ferriol M., Pico B., and Nuez F., 2003a, Genetic diversity of a germplasm collection of Cucubita pepo using SRAP and AFLP markers, Theor. Appl. Genet., 107(2): 271-282 http://dx.doi.org/10.1007/s00122-003-1242-z PMid:12845442
Ferriol M., Pico M.B., and Nuez F., 2003b, Genetic diversity of some accession of Cucubita maxima from Spain using RAPD and SBAP markers, Genetic Resources and Crop Evolution, 50(3): 227-238 http://dx.doi.org/10.1023/A:1023502925766
He Z.W., Liu Y.S., Chen L.H., Cao M.H., and Xia J.H., 1998, Orthogonal design-direct analysis for PCR optimization, Hunan Yike Daxue Xuebao (Bulletin of Hunan Medical Universitu), 23(4): 403-404 (何正文, 刘运生, 陈立华, 曹美鸿, 夏家辉, 1998, 正交设计直观分析法优化PCR条件, 湖南医科大学学报, 23(4): 403-404)
Li G., and Quiros C.F., 2001, Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction its application to mapping and gene tagging in Brassica, Theor Appl Genet, 103(2-3): 455-461 http://dx.doi.org/10.1007/s001220100570
Yu C.G., Yin Y.L., and Xu J.H., 2009, Identification of Taxodium hybrids by SRAP analysis, Linye Kexue (Scientia Silvae Sinicae), 45(2): 142-146 (於朝广, 殷云龙, 徐建华, 2009, 用SRAP标记鉴定落羽杉属植物杂种, 林业科学, 45(2): 142-146)
Zhong M., Niu Y.C., Xu S.C., and Wu L.R., 2002, RAPD markers linked to the stripe rust resistance gene Yr5 in the wheat variety Triticum spelta album, Yichuan Xuebao (Journal of Genetics and Genomics), 29(8): 719-722 (钟鸣, 牛永春, 徐世昌, 吴立人, 2002, 小麦品种Triticum spelta album中抗条锈病基因Yr5的RAPD标记, 遗传学报, 29(8): 719-722)