2.甘肃农业大学农学院, 兰州, 730070
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 35 篇 doi: 10.5376/mpb.cn.2011.09.0035
收稿日期: 2010年11月18日 接受日期: 2011年02月28日 发表日期: 2011年03月30日
田玉娥等, 2011, 小豆组织培养和植株再生研究, 分子植物育种 Vol.9 No.35 (doi: 10.5376/mpb.cn.2011.09.0035)
小豆再生体系建立是小豆基因功能分析和转基因研究的基础,本实验研究了小豆GM278、GM13、京农5号、京农6号、京农8号、吉红9号的再生能力,分析了苗龄、外源激素、外植体种类对丛生芽诱导率的影响。不同小豆材料、苗龄及外源激素浓度组配,不定芽的诱导率不同。小豆下胚轴是适宜再生的外植体,无菌苗龄以5天之内为宜。京农5号品种丛生芽再生率最高,达82.5%。适宜丛生芽诱导培养基是MS+2 mg/L6-BA+7 g/L琼脂+30 g/L蔗糖,生根培养基为1/2MS+0.1 mg/L IBA+7 g/L琼脂+15g/L蔗糖。
小豆(Vigna angularisi),又名红小豆、赤豆,起源于中国,具有悠久栽培历史。世界上约有24个国家种植小豆,但主要在亚洲种植,我国是世界最大的小豆生产国和出口国,产品销往日本、韩国、新加坡、马来西亚、菲律宾、欧美等30多个国家和地区(林汝法和柴岩等, 2002; http://www.mgcic.com/show.php?articleid=1800)。
植物外植体离体再生是植物遗传转化的基础,豆科植物遗传转化频率低的主要原因之一是外植体离体再生较困难。近年来,在大豆中以子叶节、胚轴(袁鹰等, 2001; Wang et al., 2003; 李明春和邢来君等, 2006; 李海燕等, 2008)、胚尖(张东旭等, 2008)为外植体,进行再生能力和转化体系研究(姬月梅和邱丽娟等, 2008)。已见花生(张斌等, 2006; 雷萍萍等, 2009)、蚕豆(刘洋, 2010)、豌豆(苏承刚等, 2007)、绿豆(张树录等, 1986; 聂刘旺等, 1999)、苜蓿(梁慧敏等, 2003; 赵金梅, 2010)等豆科植物的组织培养及植株再生研究的报道。
在小豆中,许智宏等(1983)初步用5-7日苗龄的无菌苗上胚轴,在MS附加不同种类或浓度的植物素培养基中得到再生植株,认为玉米素促芽效果较好。金正彪等(1985)将上胚轴外植体在单MS培养基中诱导出再生植株,0.2 mg/L NAA和0.2 mg/L BA对愈伤组织的形成和芽的分化最为合适,4周后形成愈伤组织。鲁明塾和杨金水等(1985)用子叶愈伤组织诱导出再生植株,但苗分化率较低。黄培铭等(1989)用叶肉原生质体愈伤组织分化成苗。金文林和蓬原雄三(1993)用小豆初生叶、上胚轴、子叶、子叶节、主根基部和根尖外植体诱导愈伤组织及再生植株;其中上胚轴能够诱导出愈伤组织及芽、根、得到幼苗和植株;子叶能诱导出愈伤组织、根和芽;其他外植体可诱导出愈伤组织和根,但诱导率低,需要时间长;在加入0.1~0.4%的6-BA培养基上,进行外植体直接再分化,不同品种再生能力存在很大差异,L-I-57最好,其最高芽诱导率为29.2%;发芽培养基中加入6-BA,诱导外植体愈伤组织所需时间短, 诱导率可达100%。Sato(1993)用上胚轴诱导的愈伤组织分离和培养原生质体,从原生体培养出愈伤组织并诱芽诱根、得到完整植株,认为1mg/L的2,4D+BAP (6-benzylaminopurine, 6-苄基嘌呤)激素浓度组合诱导频率最高。Renato A. Avenido等(2000)将小豆下胚轴和根在MS+B5维生素+4.4 µmol/L BA (6-benzyladenine)的培养基中,诱导出丛生芽,获得再生植株;以培养6周8~10 mm长的子叶节为外植体为宜,日本栽培小豆Bansei aki的最高芽分化可达78.7%。
国内用小豆下胚轴离体再生的研究还未见报道,本研究旨在筛选再生能力强的小豆材料及外植体、找出有利再生的激素浓度配比,提高诱导效率,建立中国栽培小豆适宜的组织培养再生体系,为小豆基因功能分析和转基因研究及通过遗传转化改良小豆奠定基础。
1结果与分析
1.1种子萌发天数对小豆下胚轴再生能力的影响
萌发5 d、7 d、9 d和11 d的无菌苗下胚轴在MS+2 mg/L 6BA+3%蔗糖的芽诱导培养基上诱导生芽,培养30 d左右在下胚轴的下端周围分化出丛生芽,统计芽分化频率结果表明(表1),萌发5 d、7 d、9 d和11 d的无菌苗下胚轴都能诱导形成丛生芽,但芽的分化频率有所差异。随着无菌苗发芽天数逐渐增大,丛生芽分化频率减小。
表1 种子萌发天数对小豆下胚轴诱芽的影响 Table 1 Effects of sterile seedling age on budding rate from hypocotyl in azuki bean |
1.2激素浓度对小豆下胚轴诱导从生芽的影响
激素是诱导植物组织再生的关键因素,不同激素,同一激素的不同浓度,对同一种外植体的诱导效果不同。本试验采用3种不同的BA和NAA浓度组合,共9种培养基,这些培养基,除了MS+1 mg/L 6-BA+0.5 mg/L NAA+3%蔗糖的培养基不能诱导外植体产生丛生芽外,其他8种培养基都能诱导下胚轴外植体最下端处产生丛生芽,以BA浓度为2 mg/L,不加NAA的培养基对小豆下胚轴分化芽的诱导效果最好,芽分化频率达到82.7%。当培养基中NAA浓度为0或0.2mg/L时,随着6-BA浓度的增大,芽分化率逐渐降低;当培养基中6-BA浓度一定时,NAA浓度越大,芽分化率越小(表2)。
表2 不同6-BA和NAA浓度组配京农5号下胚轴离体培养芽分化 Table 2 Shoot initiating frequency of hypocotyls explant in JN5 by different concentration ration of 6-BA and NAA |
1.3小豆不同基因型及外植体的再生能力比较
本试验中将6个栽培小豆成熟种子萌发5天的无菌苗上胚轴和下胚轴分别接种在 MS+2mg/L 6BA+3%蔗糖的芽诱导培养基上。除JN5号上胚轴和吉红9号上、下胚轴均没有诱导出芽(表3),其余都诱导出丛生芽,但丛生芽分化频率在不同基因型和不同外植体间存在一定差异(图1),诱导率在0~82.5%范围内,其中JN5芽分化频率最高,达到82.5%。JN5上胚轴、吉红9号上胚轴和下胚轴再生率均为0,GM278、GM13、JN5、JN6小豆下胚轴再生率均大于上胚轴,表明小豆下胚轴有较高的再生能力。
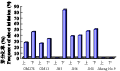 图1 不同小豆胚轴外植体芽分化频率 Figure 1 Frequency of shooting initiation from hypocotyls explant in cultivated azuki bean |
 表3 小豆胚轴外植体芽分化率 Table 3 Frequency of shoot initiation from hypocotyls explant in cultivated azuki bean |
2讨论
李凤玉等(1999)研究表明大豆子叶离体诱导不定芽、不定根的发生和植株再生最适宜的苗龄为3d。金文林和蓬原雄三(1993)认为初生叶以出芽后2 d苗龄的材料最好,而上胚轴、子叶、子叶节、主根基部和根尖外植体以出芽后3 d苗龄的愈伤组织分化诱导率较高。本研究表明发芽5 d的小豆无菌苗下胚轴芽分化频率最高,下胚轴的再生能力比上胚轴强,芽分化频率达82.5%。因此,在以小豆下胚轴为外植体进行再生试验时,应选用苗龄5 d之内的无菌苗。
6-BA 是最重要的植物激素,可促使分生组织分裂并打破顶端优势促进不定芽的形成(龚学臣等, 2005)。本研究结果表明,NAA浓度较高时,造成愈伤组织的大量生长,过度生长的愈伤组织抑制了芽的生长,因此降低了芽分化率。适宜的6-BA 浓度可显著地促进丛生芽的形成,高浓度的6-BA 对芽生长有抑制作用,本试验中添加2 mg/L 6-BA 的丛生芽诱导率显著地高于其他浓度组合的诱导率。
同一品种的不同外植体,由于内源激素含量不同,在同样培养基成分和培养条件下芽诱导率不同。不同品种由于遗传及生理差异,由下胚轴诱导芽再生的效果也不同(Barwale et al., 1986)。本实验用MS+2 mg/L 6-BA+3%蔗糖为芽诱导培养基,对6个在栽培小豆下胚轴直接诱导再生芽的效果都比较好(图2),芽分化频率达到25.3~82.5%,JN5下胚轴丛生芽诱导率82.5%,明显高于其他材料,初步认为JN5下胚轴是诱导丛生芽产生并再生植株的良好材料。马晖玲等(2004)研究表明苜蓿不同品种间体细胞胚胎发生能力表现出明显差异,紫花苜蓿品种下胚轴均有较强的再生率。金文林和蓬原雄三(1993)选用G-I-24、L-I-57、86早67、蛭川小豆和蛭川大纳言等7个栽培小豆进行外植体直接诱导,发现不同品种再生能力存在很大差异,L-I-57上胚轴外植体诱芽率最高,达29.2%。本研究认为下胚轴再生能力较强,但不同小豆下胚轴的再生能力存在差异。仍需要广泛筛选,找出再生能力强的小豆种质进行遗传转化,并进一步确定最佳诱导苗龄、激素种类和浓度,提高诱导率,缩短诱导时间,建立高效的小豆再生体系。
 图2 栽培小豆胚轴诱导的再生芽和植株 注: A: 无菌苗; B: 下胚轴直接诱导的丛生芽; C: 上胚轴直接诱导的丛生芽; D: 下胚轴再生小植株 Figure 2 Regenerating Shoot and plant induced by hypocotyls in cultivated azuki bean Note: A: Sterile seedling; B: Shoot clumps induced by hypocotyls; C: Shoot clump induced by epicotyls; D: Small plants regenerated by hypocotyls |
3材料和方法
3.1材料
小豆GM278、GM13、京农5号、京农6号、京农8号和吉红9号种子由北京农学院植物科学技术学院小豆研究室提供。
3.2方法
3.2.1无菌苗的培养
种子经严格精选后,在超净工作台上先用70%的酒精表面消毒30s,再用5%的次氯酸钠灭菌15 min,随后用无菌水冲洗5~6次,接种在MS培养基上待发芽,温度28℃,光周期16/8小时,光照强度2000lx。
3.2.2外植体的培养条件
切取无菌苗胚轴接种在芽诱导培养基上诱导生芽(芽诱导培养基配方详见各具体试验设计),每两周换一次新鲜培养基,一个月后按公式:分化频率=分化芽苗的外植体数/未被污染外植体总数,调查芽苗分化情况,并统计芽分化频率,当芽长至2 cm左右时切下转入1/2MS+0.1 mg/L IBA+1.5%蔗糖培养基中生根,培养一周后,诱导出根,每株可长出3~6条根,20 d后打开瓶盖,炼苗2~3 d,然后轻轻洗去根部培养基,移栽到已灭菌的蛭石和土壤为1:1的基质中培养。实验用培养基是含0.7%琼脂的MS固体培养基,pH5.8,121℃高压湿热灭菌16 min,接入外植体,培养昼夜温度24/18℃,光周期16/8 h,光照强度2000lx。
3.2.3成熟种子萌发天数对小豆下胚轴再生能力影响的实验
分别将在MS培养基上萌发5 d、7 d、9 d和11 d的JN5小豆无菌苗下胚轴接种在 MS+2.0 mg/L 6BA+3.0%蔗糖、pH5.8的芽诱导培养基上,一个月后统计芽分化频率。
3.2.4激素浓度对小豆下胚轴直接诱导丛生芽影响的实验
将萌发5 d的JN5号小豆无菌苗下胚轴接种在BA浓度分别为1.0 mg/L、2.0 mg/L、3.0 mg/L,NAA浓度为0、0.2 mg/L、0.5 mg/L的不同的芽诱导培养基上(见表4),一个月后统计芽分化频率。
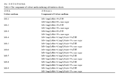 表4 芽诱导培养基构成 Table 4 The component of culture media inducing adventitious shoots |
3.2.5小豆不同基因型及胚轴再生能力比较试验
用栽培小豆GM278、GM13、JN5、JN6、JN8、吉红9号发芽6 d的无菌苗上胚轴、下胚轴外植体,在芽诱导培养基 MS+2 mg/L 6-BA+3%蔗糖上诱导丛生芽,一个月后统计芽分化频率。
作者贡献
田玉娥、刘红霞、曹劲宏和宋云星是本研究的实验设计和实验研究的执行人;田玉娥、刘红霞完成数据分析,论文初稿的写作;赵波参与实验管理、实验材料繁殖与实施,张李和吴宝美参与实验材料繁殖;万平是项目的构思者及负责人,全面指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由北京市教委科研计划面上项(KM201010020004)和北京市教委人才强教引进人才项目(PXM2007-014207-04453)资助。作者感谢中国科学院遗传与发育生物学研究所朱保葛研究员在本实验过程中的技术支持和有益的建议。感谢两位匿名的同行评审人的评审建议和修改建议。
参考文献
Barwale U.B., Kerns H.R., and Widholm J.M., 1986, Plant regeneration from callus cultures of several soybean genotypes via embryogenesis and organogenersis, Planta, 167(4): 473-481 doi:10.1007/BF00391223
Gong X.C., Ji J., Wang P., Wu Y., and Wang G., 2005, Effect of aseptic seeding age and 6-BA concentration on overgrowing shoots of soybean cotyledonary node, Jilin Nongye Daxue Xuebao (Journal of Jilin Agricultural University), 27(2): 128-130 (龚学臣, 季静, 王萍, 吴颖, 王罡, 2005, 苗龄与6-BA浓度对大豆子叶节丛生芽诱导的影, 吉林农业大学学报, 2005, 27(2): 128-130)
Huang P.M., and Ge K.L., 1989, Plant regeneration by callus derived from mesophyll protoplast of Phaseolus Angularis, Shanghai Nongye Xuebao (Acta Agrialturae Shanghai), 5(1): 31-36 (黄培铭, 葛扣麟, 1989, 赤豆叶肉原生质体愈伤组织再生植株, 上海农业学报, 5(1): 31-36)
Ji Y.M., Chen S.Y., Li Y.H., Zhang L.J., Song X.H., Chang R.Z., and Qiu L.J., 2008, Optimization of genetic transformation system from soybean cotyledon mediated by agrobacterium, Dadou Kexue (Soybean Science), 27(1): 26-32 (姬月梅, 陈受宜, 李英慧, 张丽娟, 宋晓华, 常汝镇, 邱丽娟, 2008, 农杆菌介导大豆子叶节遗传转化体系的优化研究, 大豆科学, 27(1): 26-32)
Jin W. L., and Yuzo F., 1993, The induction of calli from aduzki bean and direct plant regeneration, Beijing Nongxueyuan Xuebao (Journal of Beijing Agricultural College), 8(1): 95-99 (金文林, 蓬原雄三, 1993, 小豆外植体的愈伤组织诱导及直接植物体再分化, 北京农学院学报, 8(1): 95-99)
Jin X. B., Mi Y.C., and Zhu, Z., 1985, Plant regeneration from epiticotyl epticotyl explants of Phaseolus Angularis Wight, Beijing Daxue Xuebao (Acta Scientiarum Naturalium Universitatis Pekinensis),1: 76-80 (金兴彪, 米杨澄, 朱激, 1985, 赤豆上胚轴外植体的再生植株, 北京大学学报(自然科学版), 1: 76-80)
Lei P.P., Li M.Q., Zhang L.F., Huang L., Zhao J., and Wang J.S., 2009, Efficient plant regeneration by tissue cultures in peanut, Zhongguo Youliao Zuowu Xuebao (Chinese Journal of Oil Crop Sciences,) , 31(2): 163-166 (雷萍萍, 李美芹, 张力凡, 黄玲, 赵健, 王晶珊, 2009, 花生组织培养及高频率植株再生, 中国油料作物学报, 31(2): 163-166)
Li H.Y., Wu X.X., Han Y.P., and Liu M., 2008, Study on regenerative factors of soybean cotyledonary node, Dongbei Nongye Daxue Xuebao (Journal of Northeast Agricultural University), 29(3): 5-8 (李海燕, 武小霞, 韩英鹏, 刘淼, 2008, 影响大豆子叶节再生的因素研究, 东北农业大学学报, 29(3): 5-8)
Li M.C., Cai Y., Zhao G.L., Caiyn Q.G.L., Zhou H., Sun W., and Xing L.J., 2006, Improvement of cotyledon node regeneration system in soybean(Glycine max), Zuowu Xuebao (Acta Agronomica Sinica), 32(2): 223-227 (李明春, 蔡易, 赵桂兰, 财音青格乐, 周皓, 孙伟, 邢来君, 改良大豆子叶节再生体系的研究, 作物学报, 2006, 32(2): 223-227)
Li Y.F., Yang W.F., and Liang H.M., 1999, Relationship between the effect of BA on the organ differentiation of the cultured soybean cotyledons and the seedling ages of the detached cotyledons, Hangzhou Daxue Xuebao (Journal of Zhejiang University (Science Edition)), 26(1): 76-78 (李凤玉, 杨婉芬, 梁海曼, 1999, BA对大豆子叶培养物器官分化的影响及其与子叶离体时苗龄的关系, 杭州大学学报, 26(1): 76-78)
Liang H.M., Huang J., Xia Y., Wang T.M., Sun Z.X., and Li X.Y., 2003, Establishment of high frequency regeneration system for tissue culture of alfalfa, Nongye Shengwu Jishu Xuebao (Journal of Agricultural Biotechnology), 11(3): 321-322 (梁慧敏, 黄剑, 夏阳, 王太明, 孙仲序, 李小玉, 2003, 苜蓿组织培养高频率再生体系的建立, 农业生物技术学报, 11(3): 321-322)
Lin R.F., Chai Y., Liao Q., Sun S.W., and Tian J., 2002, Minor Grain Crops in China, Beijing, China Agricultural Science and Technology Press, P210pp.210-223 (林汝法, 柴岩, 廖琴, 孙世贤, 田静, 2002, 中国小杂粮, 北京, 中国农业科学技术出版社, pp.210-223)
Liu Y., 2009, In vitro of faba bean’s tissue culture(Vicia faba L.) and genetic variation identification of its regeneration plant, Qinghai University, Master Thesis, Supervisor: Chi D.Z., Ma X.G., pp.16-29 (刘洋, 2009, 春蚕豆的组织培养及其再生植株遗传变异鉴定, 青海大学, 硕士论文, 导师: 迟德钊, 马晓岗, pp.16-29xx-xx)
Lu M. S., Ge K.L., and Yang J.S., 1985, A Preliminary report of callus induction and plantlet regeneration from cotyledon explants in Phaseolus Angularis Wight, Shanghai Nongye Xuebao (Acta Agrialturae Shanghai), 1(4): 35-38 (鲁明塾, 葛扣麟, 杨金水, 1985, 赤豆子叶愈伤组织的诱导和植株再生, 上海农业学报, 1(4): 35-38)
Ma H.L., Lu X.S., and Ge J., 2004, Study on plant regeneration in diverse cultivars of Medicago sativa, Caoye Kexue(Acta Prataculturae Sinica), 6(13): 99-105 (马晖玲, 卢欣石, 曹致中, 葛军, 2004, 紫花苜蓿不同栽培品种植株再生的研究, 草业学报, 6(13): 99-105)
Nie L.W., 1990, Study on the induction and maintenance of calli of phaseolus aureus, Anhui Shifan Daxue Xuebao (Journal of Anhui Normal University), 3: 47-52 (聂刘旺, 1990, 绿豆愈伤组织的诱导及其保持的研究, 安徽师范大学学报, 3: 47-52)
Renato A., AvenidoA., and Kazumi H., 2000, Benzyladenine-induced adventitious shoot regeneration from hypocotyls of adzukibean (Vigna angularis {Willd.} Ohwi & Ohashi), Plant Growth Regulation, 31: 147–153 doi:10.1023/A:1006302816178
Sato T., Asaka D., Harada T., and Matsukawa I.I., 1993, Plant regeneration from protoplasts of adzuki bean (Vigna angularis Ohwi & Ohashi), Japan J. Breed, 43: 183-191
Wang L., Clemente T., Wang L.Z., Sun S.S., and Huang Q.M., 2003, Regeneration study of soybean cultivars and their susceptibility to Agrobacterium tumifaciens EHA 101, Zuowu Xuebao (Acta Agronomica Sinica), 29(5): 664-660 (王岚, Clemente T., 王连铮, 辛世文, 黄其满, 2003, 大豆品种的再生性能及对EHA 101农杆菌的敏感性, 作物学报, 29(5): 664-660)
Xu Z.H., Gao M.X., and Wei Z.M., 1983, Plant regeneration from epiticotyl segment culture of Phaseolus Angularis, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 5: 40-41 (许智宏, 高明星, 卫志明, 1983, 赤豆上胚轴切段培养中的植株再生, 植物生理学通讯, 5: 40-41)
Yuan Y., Liu D.P., Zheng P.H., Xu W.J., and Li H.L., 2001, Study on plant on plant regeneration from soybean culture, Dadou Kexue (Soybean Science), 20(1): 9-13 (袁鹰, 刘德璞, 郑培和, 徐文静, 李海龙, 2001, 大豆组织培养再生植株研究, 大豆科学, 20(1): 9-13)
Zhang B., Fan Z. X., Liu X., Qin L., Li C.S., and Bi Y.P., 2006, Establishment of a regeneration system of peanut tissue culture, Anhui Nongye Kexue(Journal of Anhui Agricultural Sciences), 34(15): 3590-3592 (张斌, 范仲学, 柳絮, 秦岭, 李长生, 毕玉平, 2006, 花生再生体系的建立, 安徽农业科学, 34(15): 3590-3592)
Zhang D.X., Zhang J., Shang L., Zhang Y.W., Yang C.Y., and Wang D.M., 2008, Study on the regeneration system of soybean embryonic tips, Hebei Nongye Daxue Xuebao (Journal of Agricultural University of Hebes), 31(4): 7-13 (张东旭, 张洁, 商蕾, 张蕴伟, 杨春燕, 王冬梅, 大豆胚尖再生体系的研究, 河北农业大学学报, 2008, 31(4): 7-13)
Zhang S.L., and Zhen G.C., 1983, Tissue culture and plantlet regeneration from epticotyl explants in phaseolus aureus, Zhiwu Shenglixue Tongxun (Plant Physiology Communications), 3: 42-43 (张树录, 郑国锠, 1983, 绿豆上胚轴培养与植株再生, 植物生理学通讯, 3: 42-43)
Zhao J.M., Li F., Zhou H., Sun Q.Z., and Bi J., 2010, Establishment of alfalfa tissue culture syetem, Henong Xuebao (Journal of Nuclear Agricultural Sciences), 24(3): 507-512 (赵金梅, 李芳, 周禾, 孙启忠, 毕静, 2010, 紫花苜蓿组织培养体系的建立, 核农学报, 24(3): 507-512)