2.安徽省怀远县龙亢农场, 怀远, 233428
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 45 篇 doi: 10.5376/mpb.cn.2011.09.0045
收稿日期: 2011年02月17日 接受日期: 2011年02月28日 发表日期: 2011年04月14日
闫小燕等, 2011, 冷诱导基因wcs19与小麦抗寒性关系研究, 分子植物育种 Vol.9 No.45 (doi: 10.5376/mpb.cn.2011.09.0045)
低温伤害不仅会限制农作物的栽种范围,也会造成农作物减产。为了阐明冷诱导基因wcs19 DNA序列与小麦幼苗抗寒性的关系,对来自于全国各个麦区及部分外引种质共233份小麦资源进行了幼苗抗寒性鉴定及wcs19基因STS检测,结果表明233份小麦品种间wcs19基因在DNA水平上没有差异,其幼苗抗寒性可能与wcs19基因表达水平有关;进一步的序列分析表明,wcs19基因DNA序列含有一段121 bp~122 bp的内含子,且该内含子序列中包含一个SNP,即,内含子序列+9 bp处G碱基的插入和缺失,此内含子及内含子中的SNP与幼苗抗寒性的关系还需进一步研究确定。
低温是限制小麦生长、发育以及分布的主要因素之一,并有时会导致小麦的严重减产。因此增强小麦的抗寒性已经成为育种工作者的首要目标。小麦的抗寒基因是一种诱发基因,在遭受冻害前,如果经过一段时间的非冻低温胁迫后,抗寒性增强,这一现象称为冷驯化或冷锻炼(cold acclimation CA) (Hughes et al., 1996)。一般来说,当冷冻发生时,冬性品种相对于春性品种具有更好的保护机制来抵御低温,这种遗传学差异为冬性小麦在低温状态下的生长提供了竞争优势(Chauvin et al., 1993)。潘杰、简令成等在诱导合成冬小麦抗寒特异性蛋白的试验中证实植物的抗寒性是一种累积性的数量性状,是由多基因控制的(潘杰和简令成, 1990),也就是说,植物的抗寒性是由多种特异的基因调控的。在小麦21对染色体中至少有10对参与抗寒性的调节,且抗寒基因只有在一定条件(主要是低温和短日照)的诱导下,才能表现为抗寒力。冷驯化过程涉及多种基因的表达,如COR (cold-regulated)基因、LTI78 (low temperature induced78)、LEA (1ate embryogenesis abundant)蛋白基因等。COR基因是冷诱导基因,在它的启动子区域含有5个碱基核心序列CCGAC的脱水反应元素DRE (Dehydration responsive element),DRE作为顺式作用启动子元素能在低温胁迫时激活COR基因的表达(Novillo and Alonso, 2004)。植物冷驯化的机制一般认为有2种:一种是依赖于ABA (abscisic acid),另一种是不依赖于ABA的。小麦中受ABA诱导的COR基因包括wrab15 (Kobayashi et al., 2004),wrab17 (Tsuda et al., 2000; Kobayashi et al., 2008),wrab18 (Kobayashi et al., 2004),wrab19 (Tsuda et al., 2000; Egawa et al., 2006),而不受ABA诱导的基因包括wcs19 (Fowler et al., 2001),wcor14 (Tsvetanov et al., 2000),wcor15 (Takumi et al., 2003)。
植物耐冻性的形成是低温下新陈代谢活跃和基因表达增强的结果(Guy, 1990),在冷驯化时数个蛋白质以及对应的mRNA积累较多,在某些情况下,这些积累物与植物或组织发展为耐冻性的能力有关(Perras, 1989),而另外一些基因在低温下表达量增多,则由其他因子诱导,比如ABA,水分胁迫等。在低温时积累的蛋白质首先被认为具有物种专一性,但是后来的研究结果显示它们是家族特有的(Houde et al., 1992)。在低温下这些蛋白质的富集显示耐冻性的形成与其数量有密切关系。这些蛋白质在耐冻性中的确切功能还需进一步研究。由于耐冻性是由多基因控制的,要研究某个独立的基因就必须理解冷诱导和耐冻性发生过程中全部的遗传起源和生理学基础。wcs19基因在禾本科植物的绿色叶片组织中优先表达,并且同时需要低温和光照,另外,此基因不受ABA、干旱、热休克、盐分、创伤以及缺氧压力的影响(Chauvin et al., 1993)。本文根据NCBI公布的wcs19的mRNA序列设计引物,采用体外扩增技术对小麦冷诱导基因wcs19进行克隆与序列分析,并结合实验室抗寒性鉴定研究wcs19基因在小麦抗寒中所起的作用。
1结果与分析
1.1 233个品种抗寒性分析
从图1可知,233个品种的抗寒性分布广泛,品种间差异极显著,所有品种的抗寒性变幅为0.0~1.0,表现出较为明显的表型差异。
 图1 233个品种的抗寒性分布 Figure 1 distribution of cold resistance in 233 cultivars |
1.2 wcs19基因PCR检测
经过引物筛选,结果表明编号为wcs19a引物扩增特异性较好,预计目标片段422 bp,但实际扩增出了500 bp的片段。采用该对引物对233份材料进行wcs19基因检测(图2),结果发现,该对引物虽然特异性较好,但在品种间没有多态性,233份材料均检测出wcs19基因。
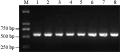 图2 wcs19a引物对部分材料的检测 注: 1: 津0483; 2: 石B02-5289; 3: 徐4036; 4: B94142-3-2; 5: 郑农20; 6: 04中36; 7: 02P157; 8: 邯郸6172; M: D2000 ladder marker Figure 2 Identification of wcs19a primer in partial materials Note: 1: jin0483; 2: shiB02-5289; 3: xu4036; 4: B94142-3-2; 5: zhengnong20; 6: 04zhong36; 7: 02P157; 8: handan6172; M: D2000 ladder marker |
1.3 wcs19基因片段序列分析
为了寻找wcs19基因序列变异与幼苗抗寒性的关系,从233个品种中随机挑选了20个抗寒性分别为强、中、弱的品种进行测序,测序由上海英骏公司完成。应用DNAMAN6.0软件对测序结果与NCBI上面公布的wcs19序列相似性的分析结果表明,20条序列与GenBank登录号为L13437的mRNA序列相似性为62.88%(图3)。20条序列都含有一段121 bp~122 bp的内含子序列,该内含子序列中包含一个SNP:内含子序列+9 bp处G碱基的插入和缺失(图3和图4)。
图3 20个测序品种与已知冷诱导基因wcs19序列的相似性比较 Figure 3 Comparison of wcs19 sequence similarity among 20 sequenced species |
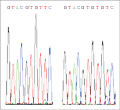 图4 测序结果chromas分析图谱 注: 左图: G碱基的缺失; 右图: G碱基的插入 Figure 4 chromas analysis atlas of sequencing results Note: Left picture is G base deletion; Right picture is G base insertion |
2讨论
针对冷诱导基因wcs19设计的引物其扩增结果没有出现差异性条带,而且序列特征分析结果与原序列基本一致,可以推断冷诱导基因wcs19在小麦的抗寒性中所起的作用很小,或者说不是主效基因。
分析这种结果产生的原因主要有两个:一是目前从小麦中分离鉴定的冷诱导基因有wcs120、wcs200、wcs66 、wcs19等,主要受低温胁迫的影响(Guo et al., 1990),本文只对wcs19作了初步研究,再加上植物的抗寒性是由多基因控制的,是多种基因共同起作用的结果,其作用机制十分复杂,所以wcs19基因在DNA水平上与植物抗寒性不能紧密关联也不足为奇。二是Stockinger等(1997)在研究拟南芥在低温胁迫下如何调节COR基因表达的分子机制时,采用酵母单杂交方法分离鉴定出一种cDNA,其编码产物能识别COR基因中的CRT/DRE (C-repeat/dehydration-responsive element)元件并与之特异结合,故命名为CRT/DRE结合因子即CBF1 (CRT/DRE-binding factor 1)。Thomashow(1998)后来发现CBF1的过量表达可以诱导一组COR基因表达,从而提高植物的抗寒性。CBF通过结合于下游COR基因的启动子区域来激活COR基因表达,增加植物抗寒性。目前已经从多种植物中分离出不同类型CBF类似蛋白,包括抗寒植物和不抗寒植物。从小麦中分离出来的CBF基因至少有7种 (Jaglo et al., 2001; Kume et al., 2005; Skinner et al., 2005),这些CBF基因对小麦的抗寒性起着重要的作用。另有研究指出ICE ( Inducer of CBF expression)是在低温时可以诱导CBF家族表达的转录激活因子,在低温时它能结合在CBF的启动子序列上,诱导CBF表达,而后CBF结合到其下游目的基因启动子的DRE序列上,诱导COR表达,从而提高植株的抗寒性(Thomashow et al., 2001)。所以,wcs19基因在小麦抗寒过程中的作用可能与其表达水平有关,也可能与其上游CBF、ICE基因有关。
植物抗冷冻能力是由一系列起直接或间接作用的基因控制的,所以研究某一冷诱导基因启动子序列或者上游调控基因与植物抗寒能力的关系也许能揭示抗寒性形成的遗传物质基础,因此对多个冷诱导基因综合分析以及研究CBF和ICE对小麦抗寒性的影响将成为下一步工作的目标。
3材料与方法
3.1试验材料
试验所收集的233份小麦育种亲本材料来自于全国各个麦区,2008~2009年种植于安徽怀远龙亢农场,其中用来克隆wcs19基因片段并进行测序的品种见表1。
 表1 wcs19基因测序品种及其相关特性 注: 冬春性为田间记录, +表示内含子序列+9 bp处G碱基的缺失 Table 1 sequencing varieties of wcs19 gene and correlation properties Note: Spring and winter was field growth examination, + indicates at the +9 bp has deletion of G base |
3.2试验方法
3.2.1小麦抗寒性鉴定
采用麦芽冰冻恢复力鉴定法,具体方法为:随机挑选50粒小麦种子,放在铺有湿润滤纸的培养皿内,室内发芽。当麦芽长到1 cm~2 cm时,将其移到4℃冰箱锻炼10 d,然后放置到-20℃冰冻12 h,取出后移到4℃冰箱解冻一天,最后在室温下恢复生长3 d,记录麦芽总数和存活麦芽数,计算麦芽冰冻恢复率(董玉琛等, 2000)。
麦芽冰冻恢复率=存活麦芽数/麦芽总数×100%
根据麦芽冰冻恢复率,比较小麦样品间的抗寒性。
3.2.2引物的设计与合成
基于GenBank登录号为L13437的mRNA序列,运用Primer premier 5.0软件进行引物设计,并用Oliger软件对引物进行分析,共设计分析了4对引物,详见表2。
 表2 wcs19基因的特异引物序列 Table 2 Specific primers sequence of wcs19 genes |
以上引物均由上海生工生物工程技术服务有限公司合成。
3.2.3基因组总DNA的提取
采用SDS—Tris饱和酚法提取小麦基因组总DNA(Gale et a1., 2001),用1.5%琼脂糖电泳检测DNA质量。
3.2.4 PCR检测
PCR扩增于BIO-RAD My Cycler 1.0上进行。反应体系为:总体积10 μL,其中含有0.25 mmol/L dNTP,1×PCR Buffer,2.5 mmol/L Mg2+,上下游引物各0.25 μmol/L,0.5 U DNA Taq聚合酶,40 ng模板DNA。
PCR反应条件为:94℃预变性5 min;94℃变性1 min,50℃~60℃ 退火1 min;72℃ 延伸l min,共38个循环;最后72℃延伸8 min,4℃保存。PCR扩增产物用2.0%琼脂糖凝胶,以120V恒压电泳分离,EB染色,凝胶成像系统照相保存。
3.2.5序列测序与分析
测序由上海英骏公司(www.invitrogen.com)完成,应用DNAMAN6.0软件对测序获得的序列进行比对分析。
作者贡献
闫小燕、周志良、徐恩静是本研究的实验设计和实验研究的执行人;司红起、闫小燕完成数据分析,论文初稿的写作;周志良、徐恩静参与实验设计,试验结果分析;王永玖为本实验提供实验材料;马传喜、司红起是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由现代农业产业技术体系专项经费和国家科技支撑计划(2009BADA6B01)共同资助,本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
Chauvin L.P., Houde M., and Sarhan F., 1993, A leaf-specific gene stimulated by light during wheat acclimation to low temperature, Plant Molecular Biology, 23: 255-265 doi:10.1007/BF00029002 PMid:8219063
Dong Y.C., and Zheng D.S., 2000, Chinese wheat Genetic resources,Agricultural Press, Beijing, China, pp.240-242 (董玉琛, 郑殿升, 编著, 2000, 中国小麦遗传资源, 中国农业出版社, 中国, 北京, pp.240-242)
Egawa C., Kobayashi F., Ishibashi M., Nakamura T., Nakamura C., and Takumi S., 2006, Differential regulation of transcript accumulation and alternative splicing of a DREB2 homolog under abiotic stress conditions in common wheat, Genes & Genetic Systems, 81: 77-91 doi:10.1266/ggs.81.77
Fowler D.B., Breton G., Limin A.E., Mahfoozi S., and Sarhan F., 2001, Photoperiod and temperature interactions tegulate low-temperature-induced gene expression in barley, Plant Physiology, 127: 1676-1681 doi:10.1104/pp.010483 PMid:11743112 PMCid:133572
Guo W., Ward R.W., and Thomashow M.F., 1990, Characterization of a Cold-Regulated Wheat Gene Related to Arabidopsis cor47, Plant Physiol, 100: 915-922 doi:10.1104/pp.100.2.915 PMid:16653076 PMCid:1075644
Houde M., Dhindsa R.S., and Sarhan F., 1992, A molecular marker to select for freezing tolerance in gramineae, Mol Gen Genet, 234: 43-48 PMid:1495483
Hughes M., and Dunn M., 1996, The molecular biology of plantacclimation to low temperature, J.Exp.Bot, 47: 291-305 doi:10.1093/jxb/47.3.291
Jaglo K.R., Kle V.S., Amundsen K.L., Zhang X., Haake V., Zhang J.Z., Deits T., and Thomashow M.F., 2001, Components of the Arabidopsis C-repeat/dehydration-responsive element binding factor cold-response pathway are conserved in Brassica napus and other plant species, Plant Physiol, 127: 910-917
doi:10.1104/pp.010548 PMid:11706173 PMCid:129262
Kobayashi F., Takumi S., and Nakamura C., 2008, Increased freezing tolerance in an ABA-hypersensitive mutant of common wheat, Journal of Plant Physiology, 165: 224-232 doi:10.1016/j.jplph.2006.11.004
PMid:17240477
Kobayashi F., Takumi S., Nakata M., Ohno R., Nakamura T., and Nakamura C., 2004, Comparative study of the expression profiles of the Cor/Lea gene family in two wheat cultivars with contrasting levels of freezing tolerance, Physiologia Plantarum, 120: 585-594 doi:10.1111/j.0031-9317.2004.0293.x PMid:15032820
Kume S., Kobayashi F., Ishibashi M., Ohno R., Nakamura C., and Takumi S., 2005, Differential and coordinated expression of Cbf and Cor/Lea genes during long-term cold acclimation in two wheat cultivars showing distinct levels of freezing tolerance, Genes Genet Syst, 80: 185-197 doi:10.1266/ggs.80.185
Novillo F., and Alonso J.M., 2004, Cold acclimation of Arabidopsis thaliana: Affect on plasma membrane lipid composition an defreeze-induced lesions, Plant Biology, 11: 3985-3990
Pan J., and Jian L.C., 1990, Advances of the Studies on Biomembranes and Proteins in Plant Freezing Injury and Cold Hardness, Zhiwuxue Tongbao (Chinese Bulletin of Botany), 7(1): 1-5 (潘杰, 简令成, 1990, 植物寒害和抗寒机制中膜与蛋白质研究的进展, 植物学通报, 7(1): 1-5)
Perras M., and Sarhan F., 1989, Synthesis of freezing tolerance proteinsin leaves, crown and roots during cold acclimation of wheat, Plant Physiol, 89: 577-585 doi:10.1104/pp.89.2.577 PMid:16666585 PMCid:1055884
Skinner J.S., Von Zitzewitz J., Szucs P., Marquez-Cedillo L., Filichkin T., Amundsen K., Stockinger E.J., Thomashow M.F., Chen T.H., and Hayes P.M., 2005, Structural, functional, and phylogeneticcharacterization of a large CBF gene family in barley, Plant Mol Biol, 59: 533-551 doi:10.1007/s11103-005-2498-2 PMid:16244905
Stockinger E.J., Gilmour S.J., and Thomashow M.F., 1997, Arabidopsis thaliana CBF1 encodes an AP2 domain-containing transcriptional activator that binds to the C-repeat/DRE,a cis-acting DNA regulatory element that stimulates transcription in response to low temperature and water deficit, Proc Natl Acad Sci USA, 94: 1035-1040 doi:10.1073/pnas.94.3.1035
Takumi S., Koike A., Nakata M., Kume S., Ohno R., and Nakamura C., 2003, Cold-specific and light-stimulated expression of a wheat (Triticum aestivum L.) Cor gene Wcor15 encoding a chloroplast-targeted protein,Journal of Experimental Botany, 54: 2265-2274 doi:10.1093/jxb/erg247 PMid:12909691
Thomashow M.F., 1998, Role of cold-responsive genes in plant freezing tolerance, Plant Physio1, 118: 1-7
Thomashow M.F., Gilmour S.J., and Stockinger E.J., 2001, Modification of fatty acid comosition in rice plants by transformation with a tobacco microsomal 23 fatty acid desaturase gene, Physic Plant, 112: 171-175
doi:10.1034/j.1399-3054.2001.1120204.x
Tsuda K., Tsvetanov S., Takumi S., Mori N., Atanassov A., and Nakamura C., 2000, New members of a cold-responsive group-3 Lea/Rab-related Cor gene family from common wheat (Triticum aestivum L.), Genes & Genetic Systems, 75: 179-188 doi:10.1266/ggs.75.179
Tsvetanov S., Ohno R., and Tsuda K., 2000, A cold-responsive wheat (Triticum aestivum L.) gene wcor14 identified in a winter-hardy cultivar Mironovska, 808, Genes & Genetic Systems, 75: 49-57 oi:10.1266/ggs.75.49