 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 57 篇 doi: 10.5376/mpb.cn.2011.09.0057
收稿日期: 2010年12月21日 接受日期: 2011年01月28日 发表日期: 2011年05月13日
岳晋军等, 2011, 毛竹种胚愈伤组织诱导及分化的初步研究, 分子植物育种 Vol.9 No.57 (doi: 10.5376/mpb.cn.2011.09.0057)
为了建立毛竹再生体系,研究了毛竹种胚不同放置和切割方式对愈伤组织诱导率和质量的影响。结果表明:放置方式对愈伤组织诱导的影响明显,盾片朝下处理在4 mg/L 2,4-D的MB培养基上诱导出较多的致密状愈伤组织,盾片朝上紧密状愈伤组织的诱导率较低,更易生根;不同切割处理也对毛竹愈伤组织诱导影响明显,横切能够较好地控制疏松水渍状愈伤组织的产生,诱导出较多的致密状愈伤组织;剥胚处理和纵切处理对胚活性影响较大,愈伤组织诱导启动较慢且易褐变。在不同的激素浓度中,以4 mg/L 2,4-D较适合毛竹种胚的愈伤组织诱导。在分化过程中,不同的激素配比对愈伤组织存活的影响差异不显著,表明毛竹种胚诱导出的紧实型愈伤组织分化也较困难。
毛竹(Phyllostachys heterocycla var. pubescens) 又称楠竹、江南竹、孟竹,属于大型竹,秆高20 m以上,直径18 cm,毛竹产于秦岭汉水流域至长江流域以南海拔1 000 m以下的酸性土壤上,常组成大面积纯林具有重要的生态价值,是我国竹类植物中分布最广、材质最好、用途最多的优良竹种(周芳纯, 1974)。毛竹具有生长迅速、繁殖能力强、容易更新、连续利用等特点,随着近年来竹材加工业的迅猛发展,毛竹林面积逐年扩大,约占现有竹林面积的一半, 成为名副其实的“第二森林”。毛竹加工利用的工业化程度不断提高,改造毛竹固有缺陷,培育适合工业化利用的毛竹无性系成为竹业发展的必然要求,然而毛竹开花生物学特性特殊,常规育种手段改良毛竹遗传品质较困难。随着现代生物技术的发展,不少人将研究重点转移到通过生物技术手段改良毛竹。生物技术改良首要问 题就是需要建立毛竹的再生体系。建立毛竹遗传转化的再生体系时,采用竹笋等作外植体,往往受到季节限制,取样研究很不方便且褐变严重,国内外研究表明从竹笋上诱导的愈伤组织极易褐变难分化(吴益民, 1999; 张光楚, 1998);参照水稻等农作物再生体系建立的经验,种胚容易诱导出能够分化的胚性愈伤组织(袁金玲等, 2009a; 2009b),不少人将研究重点转向了毛竹种胚(李楠等, 2009),毛竹成熟种胚作为外植体不受季节限制,可以周年使用,但有污染率较高的问题(谢庆华等, 2000),同时存在高质量愈伤组织诱导困难和诱导率低下等问题。为了提高毛竹成熟种胚的愈伤组织诱导率和质量,对毛竹种胚在不同放置和切割方式下愈伤组 织诱导的影响进行了研究,以期推动毛竹的再生体系及其生物技术遗传改良等研究。
1结果与分析
1.1不同放置方式对愈伤组织诱导的影响
按照盾片朝上和盾片朝下以及剥胚等三种不同处理方式,将种胚接种到不同培养基上,培养30 d,统计愈伤组织生长情况及发生率。
从表1中数据看出,盾片朝下放置,种胚的盾片和胚芽接触培养基,最大限度地吸收培养基中的营养和激素,因此比盾片朝上更容易诱导出愈伤组织,且质量好。盾片朝上时,胚根容易接触培养基,胚根先萌动形成愈伤组织,来源于胚根的愈伤组织质量较差。
表1 放置方式对毛竹种胚愈伤组织诱导的影响 Table 1 Different placement ways on P. heterocycla var. pubescens embryo callus induction |
接种7 d后,愈伤组织开始出现,最初出现的是白色柔软的非胚性愈伤组织,一般半透明状或水渍化(图1A),此后略黄色、有一定硬度的胚性愈伤组织也会出现,两者 往往一起生长,但非胚性愈伤组织生长速度明显比胚性愈伤组织生长速度快。在较低的2,4-D浓度下,种胚更容易出现胚根和胚芽生长,愈伤组织生长速度慢且 容易褐变,当浓度升高到4.0 mg/L时愈伤组织具有较快的生长速度,且质量较高浓度情况下好,6.0 mg/L时,愈伤组织多数水渍状,透明,当升高到10.0 mg/L时,情况更加严重。
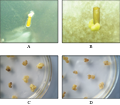 图1 毛竹种胚愈伤组织诱导情况 Figure 1 Callus states from Moso bamboo embryo |
从不同放置方式和激素浓度对愈伤组织诱导的结果来看,胚根部位发生的愈伤组织质量很差,可能盾片或者胚芽位置产生的愈伤组织质量较好,根据王海波等(孙敬三等, 2006)方法采用切除胚根的方式设计了纵切和剥胚作为对照。
1.2不同切割方式对愈伤组织诱导的影响(表2)
剥胚为三种处理方式中操作最复杂的一种,胚容易受到刀片镊子的机械损伤,容易污染,没有胚乳愈伤组织的营养供给,愈伤组织发生率低至21.7%,且多是疏松,缺少紧实性的胚性愈伤组织出现,实际操作中不被接受。
.png) 表2 不同切割方式对毛竹种胚愈伤组织诱导的影响较 Table 2 Influence of different cutting on P. heterocycla var. pubescens embryos callus induction |
纵切方式特点是在胚上人为地制造出伤口,容易导致胚活力下降,愈伤组织诱导率也随着降低,诱导出的愈伤组织多数呈白色透明状,抑或灰白色,往往呈水渍化,质地松软,致密的淡黄色愈伤组织较少。
横切损伤或者切除了部分胚根,造成了胚根生活力下降,有效地控制疏松非胚性愈伤组织的产生,产生较多的淡黄色致密愈伤组织,少量的白色透明状愈伤。这种方法 是估计胚根的大约位置,切除的时候很大程度上依赖操作者经验,相对来说具有一定的局限性。但就控制疏松非胚性愈伤组织产生而言,不失为一种较好的技术措 施。
1.3愈伤组织的分化
挑选通过横切方式处理后接种到D3培养基上诱导的愈伤组织,状态较为一致,接种到不同培养基中(表3)。光照培养,26℃,30 d统计褐变及分化情况。
.png) 表3 不同激素组合对愈伤组织分化的影响 Table 3 P. heterocycla var. pubescens embryos callus differentiation on different medium |
据表3数据分析,随着培养基配方的改变,愈伤组织成活率有所不同,但统计学分析表明并未达到显著水平。从较差的角度看,MS大量元素的成分变化对愈伤组织存活率影响并不大,随着2,4-D浓度升高,其存活率有提高的趋势。
在分化过程中,初期挑选大体一致的紧密状愈伤组织颜色基本白色到黄色,没有褐变迹象,培养7 d后,逐渐出现褐变,在此期间增殖生长很小,一般褐变速度大于增殖生长,少数增殖速度大于褐变的最后表现为存活愈伤组织。
2结论与讨论
切除毛竹种胚的胚根有效地控制非胚性愈伤组织的产生,盾片朝下接种有助于愈伤组织诱导率的提高以及愈伤质量的改善。4 mg/L 2,4-D是较为合适的浓度,太高易导致愈伤组织过于疏松,而过低则很难诱导出愈伤组织。
多年生木质化程度高的散生竹对组织培养的响应性较差,是其离体培养困难的重要原因,毛竹表现尤为突出。周宏和芦娟娟分别对毛竹竹笋的愈伤组织诱导进行了研究,但研究结果截然不同,周宏报道毛竹竹笋较容易诱导愈伤组织,褐变严重,无法正常继代培养,而芦娟娟在研究中发现毛竹笋很难诱导出愈伤组织(周宏等, 2005; 韩文军等, 2004; 芦娟娟, 2006)。比较两人的培养基,芦娟娟用2,4-D浓度较周宏低,周宏采用春季3-5月新发的竹笋作为外植体材料,而芦娟娟鞭上的笋芽,没有交代取样时间,这也可能是导致诱导率不同的原因,在组织培养中外植体或者遗传背景的差异经常会导致其在培养基上反应不同。
Shinjiro等在添加3 mg/L 2,4-D的1/2 MS培养基上经过2~3 周培养,从毛竹竹笋上诱导出愈伤组织,颜色黄白色,但在随后的继代培养中均发生褐变,出现疑似分化迹象但没有得到再生植株(Ogita, 2005; Ogita, 2006)。芦娟娟在研究中发现毛竹种胚的愈伤组织诱导率最高只有37.5%,愈伤组织颜色浅黄色,质地较硬,而李楠对毛竹种子的愈伤组织诱导率只有 28%,其对愈伤组织的描述是生长较慢、颜色浅黄,质地疏松其水渍化严重。经过较为系统的条件探索,本研究的愈伤组织诱导率叫文献报道中的高。
吴益民通过综述竹类植物组织培养的文献资料,提出了竹子的愈伤组织分为非胚性愈伤组织、致密性胚性愈伤组织和粘性愈伤组织三种类型。阙国宁在黄竹和印度莿竹的组织培养中只观察到两种类型的愈伤组织,一种是胚性愈伤组织,特征是深黄色、质地紧密,具瘤状结构,另外一种是非胚性愈伤组织,质地疏松、乳白色、继代 培养后增殖速递加快(吴益民, 2000)。
丁莉萍在小麦成熟胚的研究中将愈伤组织分为两种类型,来源于胚轴的愈伤组织,致密淡黄色,具有较强的再生能力,来源于胚根的愈伤组织多数是白色或灰色,水渍状,基本上没有分化能力(阙国宁, 1994)。在实验过程中观察到的现象和丁莉萍所描述的愈伤组织起源部位和状态情况基本一致,结合阙国宁的描述,将愈伤组织分为两种类型,一类是来源于胚 根和胚芽结合部位,其生长较为缓慢,质地坚实,呈乳白色或黄色,表面光滑或具球形颗粒状(图1C),而起源于胚根部位的愈伤组织多数为生长迅速、疏松易碎的非胚性愈伤组织,白色、黄色或褐色,表面粗糙(图1D)。尽管愈伤组织具有不同状态,但在继代培养过程中,所有类型愈伤组织都存在继代容易褐变,如果分 化的话,都出现愈伤组织死亡现象,没有任何分化迹象。所不同的是,非胚性愈伤组织在培养过程中容易褐变,最终也留下了部分能够长期继代的类型,随着继代时 间的增加,部分分化成粘性愈伤组织,多次继代后,在没有任何激素的MS培养基上也能正常生长。
3材料与方法
3.1材料
毛竹种胚收集于广西地区等开花竹林,采后自然晾干,保存于-18℃条件下,需要时取出,除掉外壳,挑选饱满成熟、色泽大小均匀的正常发育种胚作为实验材料。
3.2处理方法
先进行初步的预处理后,将种胚放在无菌水浸泡12 h,0.1% HgCl2消毒10 min,期间摇晃数次,保证消毒彻底,无菌水冲洗至少10遍以上,以保证没有HgCl2毒 害,在无菌纸上通过剥胚,沿腹缝线横切,平行腹缝线纵切等3种不同方式进行处理,按照盾片向上、盾片向下2种方式接种到培养基上。按照5粒/皿进行接种,10 d时未污染的种胚挑出,用相同配方进行继代,培养30 d时,进行愈伤组织诱导率和愈伤组织质量的情况统计。统计完后将所有愈伤组织均转接到无激素的培养基上进行分化处理。
3.3培养基
基本成分:MS大量+B 5微量+B 5有机+MS铁盐+30 g/L蔗糖+8.0 g/L卡拉胶+500 mg/L Proline +300 mg/L Glutamine+500 mg/L Casamino Acids,分别附加1.0、2.0、4.0、6.0、10.0 mg/L等不同浓度梯度的2,4-D形成D1、D2、D3、D4、D5系列培养基,灭菌前pH用KOH调整到5.80,121℃下灭菌20 min。分化培养基为基本培养基,不附加任何激素用D0培养基,添加激素如表3中所示。
3.4培养条件
将接种后的培养皿放置到黑暗处培养,温度26℃。分化时接种后光照时间为16 h每天,光照强度3 000 lux,温度26℃的条件下培养。
3.5观察与统计
30 d时统计愈伤组织发生率和紧实愈伤组织数。愈伤组织诱导率=诱导出愈伤组织的外植体数/无菌外植体数×100%,紧实愈伤组织诱导率=诱导出紧实愈伤组织的外植体数/无菌外植体数×100%。
作者贡献
岳晋军,袁金玲是本研究的实验设计和实验研究的执行人;岳晋军,袁金玲及郭广平完成数据分析,论文初稿的写作;吴晓丽参与实验设计,试验结果分析;顾小平是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由浙江省重大科技专项重点项目(2009C12097)和中国林科院亚热带林业研究所基本科研业务费(RISF6908)共同资助。
参考文献
Han W.J., Zhou H., and He G., 2004, Studies on browning in callus culture of Phyllostachys heterocycla var. pubescens, Hunan Linye Keji (Journal of Hunan Forestry Science and Technology), 31(3): 4-5 (韩文军, 周宏, 何钢, 2004, 毛竹愈伤组织培养中褐变现象的研究, 湖南林业科技, 31(3): 4-5)
Li N., Jin Q.Y., Peng H.Z., Hua X.Q., and Wang K.H., 2009, Studies on germination property and callus induction of Phyllostachys heterocycla var. pubescens seed, Journal of Zhejiang Forestry Science and Technology, 29(3): 73-76 (李楠, 金群英, 彭华正, 华锡奇, 汪奎宏, 2009, 毛竹种子发芽特性和愈伤组织诱导能力初探, 浙江林业科技, 29(3): 73-76)
Lu J.J., 2006, Tissue culture of sevral bamboos, Thesis for M.S., Nanjing Forestry University, Supervisors: Ding Y.L., pp.33 (芦娟娟, 几种经济竹种的组织培养, 南京林业大学, 硕士学位论文, 导师: 丁雨龙, 2006, pp.33)
Ogita S., 2005, Callus and cell suspension culture of bamboo plant, Phyllostachys nigra, Plant Biotechnology, 22(2): 119-125 doi:10.5511/plantbiotechnology.22.119
Ogita S., 2006, Ayaka sakawa and yasuo kato, Establishment of cell culture system and Its utilization for metabolic analysis of bamboo plants, 11TH IAPTC&B Congress Biotechnology and Sustainable Agriculture 2006 and Beyond, pp.113
Que G.N., and Zhu G.Q., 1994, Study on cell suspension culture and isolation of protoplast of dendrocalamus membranceus, Linye Kexue Yanjiu (Forest Research), 7(1): 44-47 (阙国宁, 诸葛强, 1994, 黄竹细胞悬浮培养和原生质体分离, 林业科学研究, 7(1): 44-47)
Sun J.S., Zhu Z.Q., eds., 2006, Plant cell engineering experiment technology, Chemical Industry Press, Beijing, China, pp.66-67 (孙敬三, 朱至清, 主编, 2006, 植物细胞工程实验技术, 北京, 化学工业出版社, 66-67)
Wu Y.M., 1999, Current research on bamboo tissue culture and plantlet regeneration, Zhuzi Yanjiu Huikan (Journal of Bamboo Research), 18(1):32-37 (吴益民, 1999, 当前竹子的组织培养和植株再生研究, 竹子研究汇刊, 18(1): 32-37)
Wu Y.M., Bian H.W., Wang J.H., and Huang C.N., 2000, Establishment of bamboo cell suspension culture and observation of the transplants of tissue culture derived seedlings, ZhuziYanjiu Huikan (Journal of Bamboo Research), 19(1): 52-56 (吴益民, 边红武, 王军晖, 黄纯农, 2000, 竹子悬浮细胞系的建立和组织培养试管苗移栽观察, 竹子研究汇刊, 19(1): 52-56)
Xie H.Q., Xing X.Y., and Tan R.X., 2000, Study on moso bmaboo seed tissue culture, Linye Keji Tongxun (Forest Science and Technology), 12: 18-20 (谢庆华, 邢溪燕, 谭汝学, 2000, 毛竹种子组培技术初步研究, 林业科技通讯, 12: 18-20)
Yuan J.L., Gu X.P., Li L.B., Yue J.J., Yao N., and Guo G.P., 2009a, Callus induction and plantlet regeneration of Bambusa multiplex, Linye Kexue (Scientia Silvae Sinicae), 12(3): 35-39 (袁金玲, 顾小平, 李潞滨, 岳晋军, 姚娜, 郭广平, 2009a, 孝顺竹愈伤组织诱导及植株再生, 林业科学, 12(3): 35-39)
Yuan J.L., Zhang D., Gu X.P., Yue J.J., and Chen Y.T., 2009b, Suspension culture optimization of seed embryo callus from Bambusa multiplex, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 7(4): 839-844 (袁金玲, 张朵, 顾小平, 岳晋军, 陈益泰, 2009b, 孝顺竹种胚愈伤组织悬浮培养条件优化, 分子植物育种, 7(4): 839-844)
Zhang G.C., and Wang Y.X., 1998, Bamboo breeding: Current status and future trends, Zuzi Yanjiu Huikan (Journal of Bamboo Research), 17(1): 6-9 (张光楚, 王裕霞, 1998, 竹子育种工作现状与前景, 竹子研究汇刊, 17(1): 6-9)
Zhou F.C., 1974, Bamboo culture, Chinese agricultural press, Beijing, China, pp.22-24 (周芳纯, 1974, 竹林培育, 北京: 农业出版社, pp.22-24)
Zhou H., and He G., 2005, Studies on callus culture of Phyllostachys heterocycla var. pubescens, Hunan Linye Keji (Journal of Hunan Forestry Science and Technology), 32(4): 41-42 (周宏, 何钢, 2005, 毛竹愈伤组织培养研究, 湖南林业科技, 32(4): 41-42)