2.广西大学生命科学与技术学院, 南宁, 530004
3.广西大学农学院, 南宁, 530004
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 67 篇 doi: 10.5376/mpb.cn.2011.09.0067
收稿日期: 2011年05月10日 接受日期: 2011年05月21日 发表日期: 2011年05月30日
施涯邻等, 2011, 高质量木薯根, 茎, 叶总RNA和总蛋白样品的制备方法, 分子植物育种 Vol.9 No.67 (doi: 10.5376/mpb.cn.2011.09.0067)
木薯是一种重要的粮食作物和能源植物。为了研究木薯转录组和蛋白组,本研究以块根膨大期木薯品种华南124为材料,探索适合木薯块根、茎、叶的总RNA和总蛋白样品的制备方法。将高浓度氯化锂沉淀和酚氯仿抽提相结合,所获得的高纯度总RNA能够满足构建木薯cDNA文库的要求;将SDS提取缓冲液和TCA-丙酮法相结合,能够提取得到适合双向电泳的高纯度蛋白质样品。这些方法的建立,为进行大规模木薯转录组学和蛋白组学研究奠定了基础。
木薯(Manihot esculenta Crantz)是热带和亚热带地区种植的一种重要植物,在我国南亚热带地区目前的种植面积大约为6.0×105 hm2~6.67×105 hm2。木薯块根富含淀粉,是非洲、亚洲和南美地区发展中国家的7亿多人的主要膳食能量来源之一(Oates, 1997; Taylor et al., 2004)。木薯块根不仅可供人类食用,也是动物饲料和工业产品的重要原料来源。木薯生产量受到一系列因素的制约,包括病虫害和收获后块根的退化等生物因素和土壤酸度、养分不足以及干旱胁迫等非生物因素的压力。通过对木薯进行基因改造,已有报道获得高产量、高淀粉含量、强抗逆性的木薯新种质(Souza et al., 2003)。
木薯叶片成分比较复杂,含有大量的多糖、酚类和次级代谢产物,茎含有大量的纤维素,块根则含有大量的淀粉多糖。这些都是提取植物总RNA和蛋白质最难去除的干扰物质。使用传统的常规方法,例如异硫氰酸胍法、Trizol法和CTAB法均难以得到较高质量的植物 RNA (Logemann et al., 1987; Newbury and Possingham, 1977; Su and Gibor, 1988)。植物蛋白提取已经建立了很多方法(Rabilloud, 1996),选择适合的方法进行组合依赖于所提取的材料性质及应用目的。开展木薯转录组学和蛋白组学研究,首先需要获得高质量的木薯RNA和蛋白质。针对这个问题,本研究对用于构建木薯cDNA文库的各器官总RNA制备方法和适合于双向电泳的总蛋白制备方法进行了摸索。
1结果与分析
1.1木薯各器官总RNA的制备及其质量分析
采用本文报道的方法提取的木薯块根、茎和叶的总RNA,在0.8%的琼脂糖凝胶电泳后,呈现非常清晰的28S和l8S rRNA带型及微量的5S rRNA条带,没有降解及拖尾现象(图1),A260/A280在1.90~1.98 (表1),表明RNA质量很高。样品中微量的DNA可以通过使用mRNA分离试剂盒而完全去除。从不同组织得到的RNA产率为65~90 µg每克鲜组织,其中叶的产率最高,块根的产率最低。
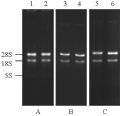 图1 木薯各组织总RNA的电泳检测 Figure l Electrophoretic analysis of RNA isolated from different tissues of cassava |
 表1 木薯各组织提取的RNA吸光度比值和产率 Table l Absorbance ratios and yields of RNA isolated from different tissues of cassava |
1.2木薯各器官总蛋白质的制备及其质量分析
对提取的木薯叶、茎和块根的总蛋白,经GE Healthcare 2-D Clean-Up Kit试剂盒处理后,可得到很好的双向电泳结果(图2)。每可组织的蛋白得率分别为:叶5 mg,茎0.6 mg,块根0.5 mg。
 图2 木薯各组织总蛋白的双向电泳检测 Figure 2 2-DE analysis of protein isolated from different tissues of cassava |
2讨论
早期常用的RNA提取方法(Chirgwin et al., 1979)能够有效地将RNA从DNA中分离出来,但是这种提取方法耗时长,而且需要进行超速离心,给研究工作带来了很大不便。随后发展起来的酸性异硫氰酸胍-酚-氯仿的一步RNA提取法(Chomczynski and Sacchi, 1987),不需要超速离心,但是由于木薯组织的成分复杂,异硫氰酸胍-酚-氯仿法在我们的前期实验中证明不适合提取木薯总RNA。
本研究使用的RNA提取缓冲液配方参考了报道过的配方(Sripati et al., 1976),根据实际情况做了一定调整。从电泳结果(图1)可以看出,所获得的总RNA的28S和18S rRNA条带清晰,没有弥散拖尾现象出现,说明RNA没有降解,且大部分杂质已经除去。虽然木薯根、茎、叶的总RNA中还有微量DNA残留,导致A260/A280的比例略低,但这很容易通过其他方法去除(例如常用的mRNA试剂盒)。同时5S rRNA条带含量较少,这与已有报道(Cathala et al., 1983)的LiCl沉淀法容易导致tRNA、5S rRNA和snRNA等小RNA产量偏低的现象完全相符,但并不影响mRNA的得率。由于构建cDNA文库前,首先要进行mRNA的分离,在纯化mRNA 的同时可以很好的将基因组DNA除去,因此样品中微量的DNA污染在反转录前就可以去除干净。目前,用本方法制备的块根膨大期的木薯品种华南124和辐选 01的叶、茎和块根的总RNA,已被成功用于cDNA文库的构建和新一代测序仪的转录组分析。
基于TCA-丙酮的蛋白质沉淀法是总蛋白提取最常用的方法之一(Damerval et al., 1986; Gorg et al., 1988, Santoni et al., 1994)。本实验室采用这种方法提取植物病原真菌——板栗疫病菌的总蛋白样品,在保证质量的前提下,产率也相对较高(王金子等, 2010)。另一种常用的蛋白质提取方法是将样品组织溶解于Tris-饱和酚中,再用含醋酸铵的甲醇溶液进行沉淀。这种方法在上世纪80年代发展起来(Hurkman and Tanaka, 1986; Schuster and Davies, 1983),适用的植物范围比较广泛,并在使用过程中得到了一定程度的改进(Isaacson et al., 2006; Saravanan and Rose, 2004)。酚法的缺点在于步骤比较繁琐,蛋白质的损失较大。目前,对于成分较为复杂的植物样品,提取方法趋于多样化(Carpentier et al., 2005; Saravanan and Rose, 2004; Wang et al., 2003)。
本研究从适合双向电泳技术的蛋白提取方法入手,对传统的TCA丙酮法进行优化。植物样品液氮研磨破碎后,先加入SDS提取缓冲液,使蛋白质溶解在缓冲液中,大部分杂质通过离心沉淀下来。研磨的同时加入2%的PVPP,除去了多酚类物质,防止蛋白氧化导致的质量下降。从双向电泳结果可以看出,凝胶背景清晰,蛋白质点聚焦充分,重复性良好。SDS提取缓冲液和传统的TCA丙酮法相结合,不仅保持了较高的蛋白质提取效率,而且最大限度的提高了样品质量,为木薯差异蛋白组学的研究打下了基础。
3材料与方法
3.1实验材料
实验用木薯(Manihot esculenta Crantz)种植于广西大学农场。收集华南124块根膨大期的块根、茎、叶,清理干净后用液氮速冻并分装保存于-80℃。
3.2仪器与试剂
LiCl,氯仿,乙二胺四乙酸钠(EDTA),甘油,三氯醋酸(TCA),β-巯基乙醇(β-ME),交联聚乙烯基吡咯烷酮(PVPP),丙酮,均为国产分析纯。水饱和酚,3-[(3-胆固醇氨丙基)二甲基氨基]-1-丙磺酸(CHAPS),十二烷基硫酸钠(SDS),购自Solarbio公司;硫脲,尿素,Tris,购自Bio Basic公司;焦碳酸二乙酯(DEPC),二硫苏糖醇(DTT),购自Merck公司;IPG胶条,覆盖油,2-D Clean-Up Kit购自GE公司。
主要设备:BECKMAN COULTER DU 730核酸蛋白分析仪,HITACHI himac CF 16RX离心机,NanoDrop ND-1000微量分光光度计,BECKMAN COULTER J2-MC离心机,Ettan IPGphor等电聚焦系统,Ettan DALTsix大型垂直电泳系统。
3.3木薯总RNA提取
(1)取6 mL RNA提取缓冲液(100 mmol/L LiCl, 100 mmol/L Tris-Hcl pH 8.0, 10 mmol/L EDTA, 1% SDS, 用DEPC-H2O 配制并高温灭菌)和6 mL水饱和酚于离心管中。(2)取0.5 g新鲜木薯组织,液氮充分研磨成粉末后,迅速转移至准备好的离心管中,震荡30 s,再加入6 mL氯仿并震荡30 s,4℃,12 000 r/min离心10 min,取上清。(3)加入等体积氯仿,4℃,12 000 r/min离心10 min,取上清。(4)将上清转移到新的离心管中,每管分装200 µL上清,加入等体积的4 mol/L LiCl溶液,混匀后-80℃放置至少1 h。(5)4℃,12 000 r/min离心20 min,弃上清,加入900 µL 75%乙醇,4℃,12 000 r/min离心5 min,沉淀自然干燥。(6)每管再加入500 µL RNA提取缓冲液,涡旋振荡溶解沉淀后,再加入600 µL 4mol/L LiCl,混匀后-80℃放置至少1 h。(7)重复步骤(5),使用75%乙醇清洗沉淀2次,自然干燥后每管加入20 µL DEPC-H2O溶解。冻存于-80℃。
3.4木薯总蛋白提取
(1) 取木薯根、茎、叶各1 g,液氮充分研磨,转移至离心管中,并加入4 mL SDS提取缓冲液(6% Tris, 5%甘油, 1% SDS, 2% DTT, 10 mmol/L硫脲, 2% PVPP, pH 7.5)。(2)室温振荡30 min,4℃,12 000 r/min离心30 min,取上清。(3)加入3倍体积-20℃预冷的TCA-丙酮溶液(含10% TCA, 0.07% β-ME),-20℃放置至少2 h。(4)4℃,12 000 r/min离心30 min,弃上清,用-20℃预冷的丙酮(含0.07% β-ME) 洗涤沉淀3次。(5)蛋白质沉淀真空干燥后,加入适量蛋白裂解液(7 mol/L尿素, 2 mol/L硫脲, 4% CHAPS, 1% DTT),4℃溶解沉淀。(6)4℃,12 000 r/min离心30 min,取上清。(7)2-D Clean-Up Kit纯化,Bradford法测定蛋白浓度后,分装,-80℃保存。
作者贡献
施涯邻、王金子和王志强是本研究的实验设计和实验研究的执行人,并完成数据分析,论文初稿的写作;蒙姣荣和罗兴录参与实验设计,试验结果分析;陈保善是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家自然科学基金课题(基于转录组学和蛋白组学的木薯新种质创建的基础研究, 30960203)和广西科技基础条件平台建设项目(09-007-01, 10-046-02)资助。特别感谢广西大学国家重点实验室技术支撑组的工作人员对本实验的支持。
参考文献
Carpentier S.C., Witters E., Laukens K., Deckers P., Swennen R., and Panis B., 2005, Preparation of protein extracts from recalcitrant plant tissues: An evaluation of different methods for two-dimensional gel electrophoresis analysis, Proteomics, 5(10): 2497-2507 doi:10.1002/pmic.200401222
Cathala G., Savouret J.F., Mendez B., West B.L., Karin M., Martial J.A., and Baxter J.D., 1983, A method for isolation of intact, translationally active ribonucleic acid, DNA, 2(4): 329-335 doi:10.1089/dna.1983.2.329
Chirgwin J.M., Przybyla A.E., MacDonald R.J., and Rutter W.J., 1979, Isolation of biologically active ribonucleic acid from sources enriched in ribonuclease, Biochemistry, 18(24): 5294-5299 doi:10.1021/bi00591a005
Chomczynski P., and Sacchi N., 1987, Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction, Analytical Biochemistry, 162(1): 156-159 doi:10.1016/0003-2697(87)90021-2 doi:10.1006/abio.1987.9999
Damerval C., De Vienne D., Zivy M., and Thiellement H., 1986, Technical improvements in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins, Electrophoresis, 7(1): 52-54 doi:10.1002/elps.1150070108
Gorg A., Postel W., Domscheit A., and Gunther S., 1988, Two-dimensional electrophoresis with immobilized pH gradients of leaf proteins from barley (Hordeum vulgare): method, reproducibility and genetic aspects, Electrophoresis, 9(11): 681-692 doi:10.1002/elps.1150091103
Hurkman W.J., and Tanaka C.K., 1986, Solubilization of plant membrane proteins for analysis by two-dimensional gel electrophoresis, Plant Physiology, 81(3): 802-806 doi:10.1104/pp.81.3.802
Isaacson T., Damasceno C.M., Saravanan R.S., He Y., Catala C., Saladie M., and Rose J.K., 2006, Sample extraction techniques for enhanced proteomic analysis of plant tissues, Nature Protocols, 1(2): 769-774 doi:10.1038/nprot.2006.102
Logemann J., Schell J., and Willmitzer L., 1987, Improved method for the isolation of RNA from plant tissues, Analytical Biochemistry, 163(1): 16-20 doi:10.1016/0003-2697(87)90086-8
Newbury H.J., and Possingham J.V., 1977, Factors affecting the extraction of intact ribonucleic Acid from plant tissues containing interfering phenolic compounds, Plant Physiology, 60(4): 543-547 doi:10.1104/pp.60.4.543
Oates C.G., 1997, Towards an understanding of starch granule structure and hydrolysis, Trends in Food Science & Technology, 8(11): 375-382 doi:10.1016/S0924-2244(97)01090-X
Rabilloud T., 1996, Solubilization of proteins for electrophoretic analyses, Electrophoresis, 17(5): 813-829 doi:10.1002/elps.1150170503
Santoni V., Bellini C., and Caboche M., 1994, Use of two-dimensional protein-pattern analysis for the characterization of Arabidopsis thaliana mutants, Planta, 192(4): 557-566 doi:10.1007/BF00203594
Saravanan R.S., and Rose J.K., 2004, A critical evaluation of sample extraction techniques for enhanced proteomic analysis of recalcitrant plant tissues, Proteomics, 4(9): 2522-2532 doi:10.1002/pmic.200300789
Schuster A.M., and Davies E., 1983, Ribonucleic Acid and protein metabolism in pea epicotyls: I. The aging process, Plant Physiology, 73(3): 809-816 doi:10.1104/pp.73.3.809
Souza C.R.B.d., Almeida E.R.P.d., Carvalho L.J.C.B., and Gander E.S., 2003, Studies toward the identification of transcription factors in cassava storage root, Brazilian Journal of Plant Physiology, 15(3): 167-170 doi:10.1590/S1677-04202003000300006
Sripati C.E., Groner Y., and Warner J.R., 1976, Methylated, blocked 5' termini of yeast mRNA, The Journal of Biological Chemistry, 251(10): 2898-2904
Su X., and Gibor A., 1988, A method for RNA isolation from marine macro-algae, Analytical Biochemistry, 174(2): 650-657 doi:10.1016/0003-2697(88)90068-1
Taylor N., Chavarriaga P., Raemakers K., Siritunga D., and Zhang P., 2004, Development and application of transgenic technologies in cassava, Plant Molecular Biology, 56(4): 671-688 doi:10.1007/s11103-004-4872-x
Wang J.Z., Shi Y.L., Tang M., Li X.P., Shang J.J., and Chen B.S., 2010, Evaluation of infection by a hypovirus on the protein expression pattern of the chestnut blight fungus by 2-Dimentioal chromatography, Jiyin Zuxue Yu Yingyong Shengwuxue (Genomics and Applied Biology), 29(3): 441-446 (王金子, 施涯邻, 唐梅, 李小平, 商巾杰, 陈保善, 2010, 应用二维液相色谱评价低毒病毒感染对板栗疫病菌总蛋白表达的影响, 基因组学与应用生物学, 29(3): 441-446)
Wang W., Scali M., Vignani R., Spadafora A., Sensi E., Mazzuca S., and Cresti M., 2003, Protein extraction for two-dimensional electrophoresis from olive leaf, a plant tissue containing high levels of interfering compounds, Electrophoresis, 24(14): 2369-2375 doi:10.1002/elps.200305500