 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 73 篇 doi: 10.5376/mpb.cn.2011.09.0073
收稿日期: 2011年06月08日 接受日期: 2011年06月14日 发表日期: 2011年06月14日
耿雪芹等, 2011, 影响月季不同外植体愈伤组织形态及其分化的因素, 分子植物育种 Vol.9 No.73 (doi: 10.5376/mpb.cn.2011.09.0073)
以‘艾菲尔铁塔’(Eiffel Tower)、‘坦尼克’(Tineke)、‘双面佳人’(Double Girl)等11个月季品种的3种外植体为材料,研究了不同品种及外植体产生愈伤组织的能力,以及影响愈伤组织形态和分化的因素。诱导的愈伤组织可分为绿色、黄绿、黄白等3种颜色,及紧实、松脆和松软等3种质地。结果表明,品种是影响愈伤组织色泽和质地、愈伤量及诱导率的主要因素,不同品种的愈伤诱导率差异显著,且愈伤组织色泽、质地在相同处理下也有差异,叶柄是诱导愈伤组织的适宜外植体,叶片次之,花丝最差。‘艾菲尔铁塔’、‘坦尼克’的叶片愈伤组织诱导率均可达到100%,‘宠爱小姐’和‘卡罗拉’的叶柄诱导率最高为100%;而‘黑魔术’(Black Magic)和‘双面佳人’(Double Girle)的最高诱导率分别只有64%和39.1%。‘萨曼莎’叶柄的平均诱导率为100%,叶片为82%,花丝为0。暗培养诱导出的愈伤组织虽为黄白色、松软或松脆,但在光培养下容易褐化。以NAA为生长素, ZT、TDZ组合的愈伤量多于KT组合;添加ABA有利于愈伤组织从绿色变为黄绿色,从紧实变为松脆,这种色泽和质地的变化有利于分化。添加葡萄糖或活性碳有利于愈伤组织的形态变化及其增殖和分化。该研究有助于根据色泽、质地等形态特征判断愈伤组织的分化能力,进而调整培养基和培养条件,提高月季愈伤组织的分化率。
月季(Rosa hybrid L.)作为重要的观赏植物,由于缺乏纯系以及由染色体数目差异造成了高度的不亲和,传统的育种方法存在一定的局限性,而分子育种技术可以有目的的操作基因,能只改变单一性状而保持其它性状的不变,为月季的品种改良提供了新途径。利用转基因技术对其性状进行改良的研究越来越多(Dohm et al., 2001; Li et al.; 2003; Kim et al.; 2009; Vergne et al.; 2010)。但由于再生、转化效率低,只有很少的研究取得成功(Katsumoto等, 2007)。因此,月季植株的离体再生成为了研究瓶颈(Kamo等, 2005; 高莉萍和包满珠, 2005; 林娅等, 2006; 瞿素萍等, 2007)。月季植株再生主要有器官发生途径和体细胞胚发生途径两种,又依据中间是否经过没有分化细胞增殖即愈伤组织形成阶段分为直接再生和间接再生(林娅, 2006)。
大多数的月季品种都能够诱导出愈伤组织,但是愈伤组织很难分化并再生出植株。林娅等(2006)研究了9个月季品种的再生,只有‘金斯莱克’和‘萨曼莎’的愈伤组织能够分化。瞿素萍等(2007)以‘卡罗拉’、‘沃蒂’、‘维斯利亚’、‘坦尼克’和‘巴比伦’5种月季的叶片为外植体进行再生研究,结果发现不同品种,月季的再生能力不同。以叶片、叶柄、茎段、花丝和胚等外植体已获得再生植株。Kamo等(2005)通过‘红衣主教’的胚性愈伤组织获得了再生植株。Kim等(2009)以‘R. rugosa’的合子胚为外植体通过间接体细胞胚发生途径途径得到了再生植株。赵培培等(2009)分别以丰花月季叶片、叶柄和茎段为外植体,进行了愈伤组织的诱导及植株再生的研究,约5%的愈伤组织在培养30 d 后分化出不定芽。Vergne等(2010)以古老月季品种‘月月红’的叶片为外植体,诱导出胚性愈伤组织并获得了再生植株。
不同因素如植物生长调节剂或品种等对愈伤组织诱导率的影响研究较多,但这些因素对愈伤组织形态的影响以及具有不同形态的愈伤组织在诱导分化再生植株上是否存在差异的研究较少报道。本文以‘坦尼克’(Tineke)、‘埃菲尔铁塔’(Eiffel Tower)等11个月季品种的3种外植体为材料进行了愈伤组织的诱导及分化研究。通过愈伤组织质地、色泽的比较研究,以期探讨其形态差异的影响因素,找出主要影响因子,及不同的愈伤组织形态是否具有分化差异性,为今后建立高效愈伤再生体系供理论依据。
1结果与分析
1.1不同品种月季的愈伤组织诱导率、形态特征存在很大差异
月季品种不同,愈伤组织诱导率、形态特征有很大差异(表1)。将诱导率百分数进行方差分析(p=0.05)结果表明,愈伤组织诱导率品种之间有差异(p<0.01),品种是影响愈伤组织诱导的主要影响因子。‘坦尼克’、‘休姆主教’、‘宠爱小姐’、‘卓越’在培养基上诱导率虽为100%,但颜色、质地和诱导量均不同,‘双面佳人’、‘萨曼莎’、‘金斯莱克’、‘绿野’和‘樱桃白兰地’愈伤组织诱导率分别为25.3%、82.3%、56.0%、53.0% 和 40.0%,并且愈伤组织的质地、颜色和诱导量也存在较大差异。
 表1 不同品种月季叶片愈伤组织诱导率、诱导量及形态统计 注: G: 绿色, YG: 黄绿; YW: 黄白, S: 松软, C: 紧实, F: 松脆; +诱导量少, ++诱导量中等, +++诱导量多, (下同) Table 1 Induction rate, quantity and modality of rose leaf callus from different cultivars Note: G: Green, YG: Yellow Green; YW: Yellow White; S: Soft, C: Compact, F: Friable; + means the callus was little and only on the edge of leaflets, ++ means the breadth of callus circle was around 0.5 cm and +++ was more than 0.5 cm, (The same as below) |
1.2叶柄是诱导愈伤组织的合适外植体
分别取‘萨曼莎’、‘黑魔术’、‘卡罗拉’和‘俏佳人’的叶片、叶柄、花丝等外植体各30个,重复实验三次,进行愈伤组织诱导率和形态特征的观测(图1)。结果表明同一品种的不同外植体,愈伤组织的诱导率和形态特征差异显著(表2)。‘萨曼莎’、‘黑魔术’的叶片和叶柄在相同培养基上,产生愈伤组织的能力具有显著性差异(p=0.01<0.05)。叶柄的愈伤诱导率最高,质地松脆;叶片、茎段次之,质地紧实;花丝诱导率低,可能与花丝的高度分化有关。
 表2 不同外植体愈伤组织诱导结果 Table 2 The results of callus induction from different explants |
图1不同外植体诱导的愈伤组织 注: A: 叶片; B: 叶柄; C: 花丝 Figure 1 The callus induced from different explants Note: A: Leaf ; B: Petiole; C: Filament |
1.3生长素对愈伤组织诱导率、形态特征的影响
‘黑魔术’、‘卡罗拉’和‘俏佳人’的叶柄产生愈伤组织受生长素的影响(表3)。方差分析(α=0.05)结果表明,3次重复处理的结果无显著性差异(p=0.454>0.05),同一品种的月季叶柄在不同生长素的培养基上愈伤组织的诱导率差异显著(p=0<0.05)。6-BA与2,4-D的组合对愈伤组织的诱导率明显高于6-BA与NAA的组合,并且在一定范围内,愈伤组织诱导率随着生长素浓度的增加而提高,月季叶柄在只含有细胞分裂素6-BA的培养基也不能产生愈伤组织。
生长素还影响愈伤组织的颜色和质地。随着生长素浓度的升高,愈伤组织的颜色逐渐变浅,质地由紧实变为松脆。如‘卡罗拉’叶柄产生的愈伤组织的颜色为绿色、黄绿、黄白,质地为紧实和松脆。
 表3 不同浓度NAA和2,4-D对月季叶柄愈伤组织诱导的影响 注: G: 绿色, YG: 黄绿, YW: 黄白; S: 松软, C: 紧实, F: 松脆; a, b, c, d表示在5%水平上差异显著 Table 3 The factor s of different NAA and 2,4-D on the induction of rose callus from petioles Note: G: Green, YG: Yellow Green, YW: Yellow White; S: Soft, C: Compact, F: Friable; a, b, c, d indicates significant difference at 5% |
1.4细胞分裂素的种类影响愈伤组织的颜色和质地
‘埃菲尔铁塔’、‘坦尼克’和‘双面佳人’等的叶片切块后接入含不同浓度细胞分裂素KT (0 mg/L~4.0 mg/L)、TDZ(0 mg/L~4.0 mg/L)、ZT(0 mg/L~4.0 mg/L)和NAA2.0 mg/L的培养基上,愈伤组织的诱导率差异不显著(p>0.05),但是愈伤组织的形态差异显著(表4)。不同的细胞分裂素与NAA在适当的浓度范围内均可诱导出愈伤组织,但愈伤量随浓度的变化而变化。在含有KT和ZT的培养基上,愈伤组织的颜色为黄绿色,质地松脆。ZT、TDZ与NAA组合愈伤量明显多于KT组合,但是TDZ诱导的愈伤组织容易褐化。ZT组合在诱导率与诱导量上优于TDZ、KT组合。细胞分裂素的浓度对于愈伤组织的再生能力没有显著的影响作用。
表4 细胞分裂素的浓度及种类影响愈伤组织的颜色和质地 注: G: 绿色; YG: 黄绿; YW: 黄白; S: 松软, C: 紧实; F: 松脆; +: 诱导量少; ++: 诱导量中等; +++: 诱导量多 Table 4 The color and texture of callus were affected by the concentration and kinds of CTKs Note: G: Green; YG: Yellow Green; YW: Yellow White; S: Soft; C: Compact; F: Friable; +: the callus was little and only on the edge of leaflets; ++: the breadth of callus circle was around 0.5 cm; +++: more than 0.5 cm |
1.5光/暗培养影响愈伤组织的颜色和质地
‘艾菲尔铁塔’、‘坦尼克’和‘双面佳人’暗培养条件下的愈伤诱导率与光培养条件下无明显差异,但愈伤组织诱导的启动时间、色泽、质地存在差异。‘艾菲尔铁塔’在光培养条件下3~5 d即可观察到在主叶脉出有愈伤凸起形成,而在暗培养条件下需7~9d。光培养条件下愈伤组织呈黄绿色质地紧实(图2A),暗培养条件下形成愈伤组织数量较少,色泽多为黄白色有褐化现象且质地松脆(图2B)。
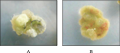 图2 不同培养条件下的‘埃菲尔铁塔’的愈伤生长状况 注: A: 光培养; B: 暗培养 Figure 2 The mophology of callus from ‘Eiffel Tower’ in different conditions Note: A: Light culture; B: Dark culture |
1.6ABA、葡萄糖和活性炭影响愈伤组织的分化
在分化培养基上添加ABA能够促进愈伤组织的增殖,并且15 d后,新增殖的愈伤组织的形态会发生变化(表5)。愈伤组织的颜色由绿色变为黄白色,质地由紧实变为松脆,更有利于愈伤组织的分化(图3A; 图3B)。‘坦尼克’(图4A)和‘双面佳人’(图4B)的愈伤组织在MS+ZT 1.0 +NAA 1.0+ABA 1.0分化出不定芽,‘金斯莱克’在相同培养基上诱导出小植株(图4C)。
在培养基上添加葡萄糖和活性炭,‘埃菲尔铁塔’愈伤组织的诱导量增加,并且颜色由绿色变为黄绿色,质地有紧实变为松脆。在愈伤组织增殖过程中,用葡萄糖代替蔗糖能够促进体细胞胚的发生,添加活性炭能够通过吸收多余的细胞分裂素,抑制细胞分裂,促进组织分化。因此,添加葡萄糖和活性炭不仅能够改变愈伤组织的形态,并且能够促进分化。最后,‘双面佳人’和‘坦尼克’在添加葡萄糖30 g/L和活性炭1.5 g•L-1的培养基上诱导出不定芽(图5A; 图5B)。
 表5 ABA、葡萄糖和活性炭影响愈伤组织的分化 注: G: 绿色, YG: 黄绿, YW: 黄白; S: 松软, C: 紧实, F松脆; +: 诱导量少; ++: 诱导量中等; +++: 诱导量多; 基本培养基为MS+NAA 1.0+ZT 1.0 Table 5 ABA, glucose and AC affected the differentiation of callus Note: G: Green, YG: Yellow Green, YW: Yellow White; S: Soft, C: Compact, F: Friable; +: the callus was little and only on the edge of leaflets; ++: the breadth of callus circle was around 0.5 cm; +++: more than 0.5 cm; The basic culture medium MS+NAA 1.0+ZT 1.0 |
图3 愈伤组织在分化培养基上的生长状况 注: A: 未添加ABA; B:添加ABA Figure 3 The morphology of callus on the differentiation medium Note: A: Without ABA; B: With ABA |
图4 愈伤组织分化情况 注: A: ‘坦尼克’; B: ‘双面佳人’; C: ‘金斯莱克’ Figure 4 The differentiation of callus Note: A: ‘Tineke’; B: ‘Double Girl’; C: ‘Jimthelanky’ |
 图5 愈伤组织在添加葡萄糖和活性炭的培养基上分化出不定芽 注: A: ‘双面佳人’; B: ‘坦尼克’ Figure 5 The callus differentiated shoots on the medium with glucose and AC Note: A: ‘Double Girle’; B: ‘Tineke’ |
2讨论
许多学者在研究月季不同外植体愈伤组织培养时发现,品种、外植体、生长调节物质等因素均不同程度影响愈伤组织的诱导、增殖及分化。Li等(2002)以3个月季品种为材料进行研究,只有‘Carefree Beauty’能够分化并且再生。任桂芳等(2004)对24个月季品种进行了再生培养其中只有12个品种能够形成再生植株,并指出品种是决定月季再生培养的关键因素。林娅等(2006)以9个月季品种为试材进行再生培养,结果只有2个品种‘金斯莱克’和‘坦尼克’能够再生出小植株。本试验研究表明,品种不仅是愈伤组织的诱导率、诱导量的主要决定因素,同样影响愈伤组织的形态特征。‘坦尼克’、‘休姆主教’、‘宠爱小姐’、‘卓越’的愈伤组织诱导率普遍较高,可达到100%,而‘双面佳人’只诱导出少量愈伤组织,诱导率为39.1%。由此可见,品种是影响愈伤组织诱导的主要因素。因此,选择合适的品种是实验取得成功的关键因素。
不同的外植体影响愈伤组织的诱导率和诱导量。Rout等(1999)研究指出‘Landora’叶柄的愈伤组织诱导率可达92%,而茎段只有76%。以‘Royal Bassino’叶柄、叶片和节间为外植体,张常青等(2005)指出叶柄的芽再生率为57.1%,高于叶片和节间。瞿素萍等(2007)以丰花月季的叶片和茎段为外植体,结果表明叶片的诱导率为90%高于茎段。
不同细胞分裂素与NAA组合影响叶片愈伤组织诱导率和愈伤量,ZT与NAA组合更利于‘坦尼克’、‘埃菲尔铁塔’、‘双面佳人’3个品种叶片愈伤组织的诱导。同时,不同的外植体,愈伤组织的诱导率、诱导量也不同,‘黑魔术’、‘卡罗拉’、‘俏佳人’叶柄的愈伤组织的诱导率均可达到100%,而以花丝作为外植体,愈伤诱导率最高为19.4%,这与外植体的分化程度有关,花丝的分化程度高,花丝细长,不易成活更不容易诱导出愈伤组织。本次试验中‘黑魔术’、‘卡罗拉’和‘俏佳人’的叶柄诱导率为100%,而花丝诱导率只有19.4%。可见,叶柄是合适的外植体。
此外,愈伤组织诱导率差异不显著,但诱导量存在着差异。ZT、TDZ与NAA组合诱导愈伤量多于KT,但综合考虑品种、愈伤诱导率和与其分化并无直接联系,而其形态特征如色泽、质地可能更适合作为判断愈伤组织能否有效分化的依据。所获得的5种形态的愈伤组织中,黄绿色松脆型(YG-F)和黄白色松(YW-F)脆型,色泽均匀、质地松脆,更利于分化培养。如‘艾菲尔铁塔’的愈伤组织诱导率高,但其愈伤组织多为绿色,质地紧实,增殖量大,但没有分化出再生植株;而‘双面佳人’的愈伤诱导率虽然仅为39.1%,其愈伤组织质地松脆易分散色泽为黄白色,在分化培养过程中成功分化出小植株。在叶片、叶柄愈伤组织诱导过程中培养基中添加2,4-D,愈伤组织的诱导率明显高于添加NAA,这与刘军等(2004)的研究发现一致。
光暗培养在愈伤组织诱导率上并无显著差异,但对于愈伤组织诱导启动时间及愈伤组织相态特征有影响。暗培养的愈伤组织启动时间要晚于光培养,而且其愈伤组织量相对较少,色泽为黄白色,但褐化现象严重,质地松软。任桂芳等(2004)研究发现,‘冰山’的叶片暗培养30d,有利于愈伤组织的分化与再生。若能改变其褐化现象,可能更有利于愈伤组织的分化,因此还需在其暗培养处理时间上进行研究。
ABA、活性碳的添加以及碳源的改变,可有效改善增殖愈伤组织的形态,在添加ABA的增殖分化培养基中,新增殖的愈伤组织色泽为黄白色,质地松脆更利于继代培养和分化。Li等(2002)研究表明添加ABA能够促进愈伤组织的增殖和体细胞胚的形成。‘双面佳人’在转入添加了ABA的分化培养基MS+ZT1.0 mg•L-1+NAA0.1 mg/L+ABA1.0 mg/L上分化出叶片。Mundy等(1990)研究表明适当补充外源、低浓度ABA可以提高体细胞胚发生,其机理可能是由于激活相关基因的表达,大量合成贮藏蛋白,诱导胚胎特异性蛋白及晚期胚胎丰富蛋白(LEA)(崔凯荣等, 2000)。在增殖分化阶段改变碳源由蔗糖变为葡萄糖,对体细胞胚胎发生有促进作用;而活性碳的添加则可适当减缓细胞分裂活动,吸附过多细胞分裂素促进组织分化。由此可看出,在多种外源物质的共同作用下不仅可以改变愈伤组织形态,而且可进一步影响其增殖或分化的方向。
3材料与方法
3.1材料
实验以‘坦尼克’(Tineke)、‘埃菲尔铁塔’(Eiffel Tower)、‘双面佳人’(Double Girl)的离体叶片,‘萨蔓莎’(Samantha)、‘金斯莱克’(Jimthelanky)、‘休姆主教’(Hume Basil)、‘宠爱小姐’(Miss Favor)、‘樱桃白兰地’(Cherry Aquavit)、‘蓝丝带’(Blue Ribbon)、‘卓越’(Excellence)、‘绿野’(Wild Green)的活体叶片为外植体,材料来源于中国农业大学园林植物种质资源与遗传育种实验室温室;以‘黑魔术’(Black Magic)、‘卡罗拉’(Carola)、‘俏佳人’(Beautiful Girl)、‘外交家’(Diplomat)、‘艳红’(Fresh Red)、‘萨蔓莎’(Samantha)的叶柄和花丝为外植体,材料取自中国农业科学院蔬菜花卉研究所月季课题组南口基地温室。
3.2离体培养和愈伤组织的观察
取新生幼叶,经洗衣粉表面消毒和流水冲洗30 min后,用0.1%的HgCl2灭菌2 min,无菌蒸馏水冲洗3~5遍,垂直叶脉切为0.5~1.0 cm2叶盘(离体叶片直接切取),叶柄切成0.5 cm长的片段,接入愈伤组织诱导培养基。培养基均含卡拉胶4.5 g•L-1,蔗糖30 g•L-1,pH调至5.8~6.2,在1.0~1.5 kg/cm2压力下高温灭菌20~25 min。分别于1周、2周、4周后观察愈伤组织诱导情况,分析不同激素种类和浓度组成的培养基对月季愈伤组织诱导量、质地、色泽的影响。诱导出愈伤组织后转入继代和分化培养基。继代培养基为诱导愈伤效果较好的愈伤组织诱导培养基。
取直径为15 mm未开放的花蕾,经以上消毒处理后用刀片切开,切取10 mm花丝,平放到原始培养基上。先暗培养3周后转入光培养,4周后观测愈伤诱导率和生长状况。然后在继代培养基上培养4周,再转移到胚性愈伤组织分化培养基上。
实验采用3次重复,每次30个外植体,通过SPSS分析软件进行方差分析,统计品种、外植体和激素对愈伤组织诱导率的影响。愈伤组织诱导率=诱导出愈伤组织的外植体数/接入外植体数。
根据观察,诱导出的愈伤组织色泽可分为绿色(G)、黄绿色(YG)、黄白色(YW)三种,质地包括松软(S)、松脆(F)、紧实(C)三种,可归纳为五种类型:绿色紧实型(G-C)、黄绿色紧实型(YG-C)、黄绿色松脆型(YG-F)、黄绿色松软性型(YG-S)、黄白色松脆型(YW-F)(图6)。
图6 愈伤组织的五种形态类型 Figure 6 Five modality types of callus |
3.3不同激素处理
以浓度为2.0 mg/LNAA分别与细胞分裂素1.0 mg/L、2.0 mg/L、4.0 mg/L的ZT、TDZ、KT,及1.0 mg/LNAA、2.0 mg/LNAA、4.0 mg/LNAA与ZT 0.5 mg/L、1.0 mg/L、2.0 mg/L、4.0 mg/L组成叶片愈伤组织诱导培养基组;愈伤组织分化培养基为添加1.0 mg/L ZT、0.1 mg/L NAA和0.5 mg/L ABA、1.0 mg/L ABA。叶柄诱导培养基为0.5 mg/L BA和0 mg/L NAA、1.0 mg/L NAA、2.0 mg/L NAA、4.0 mg/L NAA,2.5 mg/L 2,4-D、5.0 mg/L 2,4-D、10.0 mg/L 2,4-D;分化培养基为0.5 mg/L BA、5.0 mg/L 2,4-D和0.1 mg/L GA3。花丝的原始培养培养基包括MS的盐和维生素,2.0 mg/L氨基乙酸,0.5 mg/L KT,2.0 mg/L NAA,蔗糖20 g/L,pH 5.7;花丝继代培养培养基包括B5的盐, 15.0 mg/L VB1,1.5 mg/L VB6, 100 mg/L肌醇,2.0 mg/L氨基乙酸,1.5 mg/L尼克酸,329 mg/L硫酸铵,1.5 mg/L ZT,2.0 mg/L 2,4-D,蔗糖20 g/L,pH 5.6;花丝胚性愈伤组织培养培养基包括MS的盐,5.0 mg/L VB1,1.5 mg/L VB6,100/mg•L肌醇,2.0 mg/L氨基乙酸, 1.5 mg/L尼克酸,Km-8pVitamins1倍液,1.5 mg/L ZT,0.25 mg/L NAA,1.0 mg/L GA3,蔗糖20 g/L,pH 5.7。
3.4暗培养的处理
愈伤组织诱导阶段对外植体分别进行16 h光照/8 h黑暗以及黑暗两种培养方式,4周后结束暗培养处理,进行正常处理,观察愈伤组织诱导情况,比较愈伤组织形态差异。
3.5培养基中添加ABA、活性炭和葡萄糖
4周后,叶片诱导出的愈伤组织转接到MS+NAA 1.0+ZT 1.0培养基上,并且添加ABA (0 mg/L, 0.5 mg/L, 1.0 mg/L),活性炭1.5 g/L,糖分别为蔗糖和葡萄糖各30 g/L,促进愈伤组织的分化与再生。观察记录愈伤组织分化率、色泽、质地,通过方差分析研究培养基附加物对愈伤组织继代和分化的影响。
作者贡献
耿雪芹、冯莹是本研究的实验设计和实验研究的执行人;耿雪芹及冯莹完成数据分析,论文初稿的写作;耿雪芹参与实验设计,试验结果分析;刘青林是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由国家高技术研究发展计划(863计划)课题(2006AA10Z187)资助。作者感谢两位同行评审人的评审建议和修改建议。
参考文献
Cui K.R., Xing G.S., Zhou G.K., Liu X.M., and Wang Y.F., 2000, The induced and regulatory effects of plant hormones in somatic embryogenesis, Yichuan (Hereditas), 22(5): 349-354 (崔凯荣, 邢更生, 周功克, 刘新民, 王亚馥, 2000, 植物激素对体细胞胚胎发生的诱导与调节, 遗传, 22(5): 349-354)
Dohm A., Ludwig C., Schilling D., and Debener T., 2001, Transformation of roses with genes for antifungal proteins, Acta Horticulturae, 547: 27-34
Gao L.P., and Bao M.Z., 2005, Callus induction and plant regeneration of rosa hybrida ‘Samantha’, Yuanyi Xuebao (Acta Horticulturae Sinica), 32(3):534-536 (高莉萍, 包满珠, 2005, 月季‘萨曼莎’愈伤组织的诱导及植株再生, 园艺学报, 32(3):534-536)
Kamo K., Jones B., Bolar J., and Smith F., 2005, Regeneration from long-term embryogenic callus of the Rosa hybrida cultivar Kardinal, In Vitro Cellular and Developmental Biology Plant, 41(1): 32-36 http://dx.doi.org/10.1079/IVP2004599
Katsumoto Y., Mizutani M.F., Fukui Y., Brugliera F., Holton T.A., Karan M., Nakamura N., Sakakibara K.Y., Togami J., Pigeaire A., Guo Q.T., Nehra N.S., Lu C.Y., Dyson B.K., Tsuda S., Ashikari T., Kusumi T., Mason J.G., and Tanaka Y., 2007, Engineering of the rose flavonoid flavonoid biosynthetic pathway successfully generated blue-hued flowers accumulating delphinidin, Plant Cell Physiol, 48(11): 1589-1600 http://dx.doi.org/10.1093/pcp/pcm131 PMid:17925311
Liu J., Feng Z., Zhao L.Y., Sun W.G., Han J., and Yang C.Q., 2004, The Study of Inducing Callus to the Leaves of Rosa chinensis, Journal of Shandong Forestry Science and Technology, (3): 15-16 (刘军, 丰震, 赵兰勇, 孙维国, 张美蓉, 韩进, 杨传强, 2004, 影响月季叶片愈伤组织诱导因素的初步探讨, 山东林业科技, (3): 15-16
Li X.Q., Gasic K., Cammue B., 2003, Transgenic rose lines harboring an antimicrobial protein gene, Ace-AMP1, demonstrate enhanced resistance to powdery mildew (Sphaerotheca pannosa), Planta, 218(2): 226-232 http://dx.doi.org/10.1007/s00425-003-1093-5 PMid:14508687
Li X.Q., Krasnyanski S.F., and Korban S.S., 2002, Somatic embryogenesis, secondary somatic embryogenesis, and shoot organogenesis in Rosa, Journal of Plant Physiology, 159(3): 313-319 http://dx.doi.org/10.1078/0176-1617-00688
Lin Y., Zheng Y.M., and Liu Q.L., 2006, Factors in callus induction and differentiation on Rosa, Fenzi Zhiwu Yuzhong (Molecular Plant Breeding), 4(2): 223-227 (林娅, 郑玉梅, 刘青林, 2006, 影响月季愈伤组织诱导和分化的因素, 分子植物育种, 4(2): 223-227)
Mundy J., Shinozaki K.Y., and Chua N.H., 1990, Nuclear proteins bind conserved elements in the abseisic acid-responsive promoter of a ricrab gene, Proc. Natl. Acad. Sci. USA, 97: 1406-1410 http://dx.doi.org/10.1073/pnas.87.4.1406
Vergne P., Maene M., Gabant G., Chauvet A.L., Debener T., and Bendahmane M., 2010, Somatic embryogenesis and transformation of the diploid Rosa chinensis cv Old Blush, Plant cell, Tissue and Organ Culture, 100: 73-81 http://dx.doi.org/10.1007/s11240-009-9621-z
Qu S.P., Wang J.H., Tang K.X., Zhang H., Wang L.H., and Su Y., 2007, Leaf culture for 5 cut Chinese Rose (Ros a chinensis) cultivars and effects of genotypes on regeneration ability, Xinan Daxue Xuebao (Journal of Southwest University (Natural Science Edition)), 29(12):108-112 (瞿素萍, 王继华, 唐开学, 张颢, 王丽花, 苏艳, 2007, 5个切花月季品种的叶片离体培养和再生能力的基因型效应, 西南大学学报, 29(12): 108-112)
Ren G.F., Wang J.H., Feng H., Li Y., and Shi X.B., 2004, Establishment of plant regeneration from leaves explants of Rosa hybrida, Yuanyi Xuebao (Acta Horticulture Sinica), 31(4): 533-536 (任桂芳, 王建红, 冯慧, 李毅, 李燕, 施雪波, 2004, 现代月季(Rosa hybrida)叶片再生体系的建立, 园艺学报, 31(4): 533-536)
Rout G.R., Debata B.k., and Das P., 1999, In vitro regeneration of shoots from callus cultures of Rosa hybrid L.cv.Landora, Indian Journal of Experimental Biology, 30(1): 15-18
Kim S. W., Oh M.J., Liu J.R., 2009, Somatic embryogenesis and plant regeneration in zygotic embryo explant cultures of rugosa rose, Plant Biotechnol Report, 3(3): 199-203 http://dx.doi.org/10.1007/s11816-009-0092-9
Zhang C.Q., Hong B., Wang H.Q., and Gao J.P., 2005, High efficiency of in Vitro micropropagation and regeneration for ground cover Rose ‘Royal Bassino’, Yuanyi Xuebao (Acta Horticulturae Sinica), 32(6): 1065-1069 (张常青, 洪波, 王海琴, 高俊平, 2005, 地被月季‘Royal Bassino’高频再生体系的建立, 园艺学报, 32(6): 1065-1069)
Zhao P.P., Che D.D., Wang J.G., Fan J.P., and Gong S.F, 2008, Establishment of rose (Rosa chinensis var . floribunda) regeneration system, Dongbei Nongye Daxue Xuebao (Journal of Northeast Agricultural University), 39(6): 30-32 (赵培培, 车代弟, 王金刚, 樊金萍, 龚束芳, 2008, 丰花月季再生体系的建立, 东北农业大学学报, 39(6): 30-32)