 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 91 篇 doi: 10.5376/mpb.cn.2011.09.0091
收稿日期: 2011年06月13日 接受日期: 2011年07月01日 发表日期: 2011年07月11日
引用格式(中文):
付蓉蓉等, 2011, 番茄黄化曲叶病的Ty-1和Ty-3抗性基因的PCR鉴定, 分子植物育种(online) Vol.9 No.91 pp.1647-1653 (doi: 10.5376/mpb. cn.2011.09.0091)
引用格式(英文):
Fu et al., 2011, PCR Identification of Ty-1 and Ty-3 Resistant Gene to Tomato Yellow Leaf Curl Virus, Fenzi Zhiwu Yuzhong (online) (Molecular Plant Breeding) Vol.9 No.91 pp.1647-1653 (doi: 10.5376/mpb.cn.2011.09.0091)
采用PCR方法对番茄黄化曲叶病(Tomato yellow leaf curl virus, TYLCV)抗病材料及感病材料的抗性基因Ty-1,Ty-2和Ty-3进行鉴定,并用田间自然发病的方法对这些材料的抗性进行验证。实验结果表明:PCR方法可迅速,准确地鉴定番茄黄化曲叶病抗性,且同时含有纯合Ty-1和Ty-3抗性基因的番茄材料有更高更稳定的抗性;番茄黄化曲叶病的Ty-1和Ty-3抗性基因为不完全显性遗传。所以在番茄黄化曲叶病抗病育种中,可用PCR方法快速筛选抗源,将多种抗病基因聚合在一个品种中,以培育对番茄黄化曲叶病具有更高更稳定抗性的番茄品种。
番茄黄化曲叶病(TYLCV)是限制番茄生产的重要病害之一,该病害于1939~1940年在以色列首次发现(Picó et al., 1996),是由双生病毒科(Geminiviridae)菜豆金色花叶病毒属(Begomovirus)的番茄黄化曲叶病毒(Tomato yellow leaf curl virus, TYLCV)引起的,并通过烟粉虱(Bemisia tobaci) 传播。番茄黄化曲叶病开始只在热带和亚热带地区发生,中国的比较温暖的南方地区,如广东、广西、台湾和云南等地在20世纪90年代曾零星发生。20世纪 90年代以来,随着全球气候变暖,烟粉虱大量繁殖及传播,致使番茄黄化曲叶病在40多个国家大面积爆发而且逐年加重,已严重地限制了世界各个地区番茄的生产(Varma and Maltathi, 2003; Boulton, 2003)。尤其是2005年以来,番茄黄化曲叶病在华南,华东等地大面积暴发,使番茄的生产受到了极其严重的损失(何自福等, 2005; 岳宁等, 2008; 王东生等, 2006, 长江蔬菜, 10: 25-26; 吴永汉等, 2007, 中国蔬菜, 5: 57-58; 赵统敏等, 2007; 赵统敏等, 2008, 江苏农业科学, 6: 114-115),近几年已扩展至北京,天津,河北等北方地区。但不同地区的番茄黄化曲叶病毒变异较大,使得番茄黄化曲叶病抗病育种进展缓慢,而抗病性鉴定是抗病育种的重要基础,从抗源筛选、后代选择、直到品种推广的全过程都离不开抗病性鉴定。但TYLCV不能通过人工摩擦接种和机械传毒,所以传统抗病性鉴定方法为,利用带毒烟粉虱进行接种,然后调查植株的症状,但这会受到植株及烟粉虱的生长条件、气候、土壤等外界环境的影响,且工作量较大。运用分子标记进行辅助育种可避免复杂的抗性鉴定步骤,迅速检测抗病基因,筛选抗性植株,加快育种进程。本文主要研究番茄黄化曲叶病分子标记抗病性鉴定体系的建立,并通过田间自然发病的方法进行验证,以确定番茄所含的番茄黄化曲叶病抗性基因对其抗性的影响,以期为中国番茄黄化曲叶抗病育种工作提供一些信息。
1结果与分析
1.1 Ty-1抗性基因检测结果
以与Ty-1抗性基因紧密连锁的CAPS1标记为引物的扩增结果表明(图1; 图2),所有基因型的植株都扩增出398 bp的特异片段,但Ty-1基因的398 bp特异片段经TaqⅠ酶切后为303 bp和98 bp的特异片段,ty-1基因的398 bp的特异片段不能被TaqⅠ酶切。所以材料1,2,3,5,9,10的基因型为Ty-1/ty-1;材料4,7,8的基因型为Ty-1/Ty-1;材料6,7,8的基因型为ty-1/ty-1。
图1 Ty-1基因的CAPS引物扩增结果 Figure 1 The amplification of Ty-1 gene using CAPS1 primer |
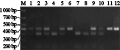 图2 Ty-1基因的CAPS1引物扩增后经TAQI酶切结果 Figure 2 The amplification of Ty-1 gene using CAPS1 primer with TAQI Digestion |
1.2 Ty-2抗性基因检测结果
以与Ty-2抗性基因紧密连锁的SCAR2标记为引物扩增结果表明(图3),所有材料均没有出现Ty-2基因900 bp的特异片段,仅扩增出ty-2基因的800 bp的特异片段,表明本所有鉴定材料均不含Ty-2抗性基因。
图3 Ty-2基因的SCAR2引物扩增结果 Figure 3 The amplification fragments of Ty-2 gene using SCAR2 primer |
1.3 Ty-3抗性基因检测结果
以与Ty-3紧密连锁的SCAR3标记为引物的扩增结果表明,Ty-3基因仅扩增出650 bp的特异片段,ty-3基因仅扩增出的320 bp的特异片段(图4)。所以材料1,2,4,7,8的基因型为Ty-3/Ty-3,材料3,5,9,10的基因型为Ty-3/ty-3,材料6,11,12的基因型为ty-3/ty-3。
图4 Ty-3基因的SCAR3引物扩增结果 Figure 4 The amplification of Ty-3 gene using SCAR3 primer |
1.4大田验证结果
试验所用12份番茄材料被携带TYLCV病毒的烟粉虱侵染后,对其进行抗病性鉴定。鉴定结果如下:12份材料中有3份免疫,7份抗病,2份高感(表1)。
 表1 番茄黄化曲叶病毒病抗性调查表 Table 1 The resistance evaluation to tomato yellow leaf curl virus |
田间试验结果表明,同时含有两种纯合抗性基因的品种,所有植株均无任何病状,群体表现为免疫;含有两种抗性基因,且一种抗性基因为纯合,另一种抗性基因为杂合的品种,大部分植株没有病状,只有少数植株有轻微的病状,群体表现为抗病;只含有一种纯合抗性基因,或含有两种杂合抗性基因的品种,部分植株没有病状,少数植株有轻微的病状,个别有严重的病状,群体表现为抗病,但接近感病;不含有任何抗性基因的品种,大部分植株都有严重的病状,个别植株症状轻微,群体表现为高度感病。
2讨论
分子标记鉴定的结果与大田试验的结果一致,含有Ty-1或Ty-3抗性基因的番茄品种表现出不同程度的抗性,而不含番茄黄化曲叶病的抗性基因的品种表现出高度感病,但传统鉴定方法受环境影响较大,随植株的生长状况及烟粉虱爆发情况不同而表现出不同的抗性,且植株在侵染病毒后要经过一段时间才可通过传统方法鉴定其抗性,而使用PCR方法不受环境影响,并可准备快速的检测抗病基因,进而筛选抗性植株,加快育种进程。
另外,田间试验结果表明,在所有同时含有Ty-1和Ty-3抗性基因的品种中,含有纯合Ty-1和Ty-3抗性基因的品种的抗性要明显高于含有杂合Ty-1和纯合Ty-3抗性基因的品种,说明番茄黄化曲叶病的Ty-1抗性基因的遗传可能为不完全显性遗传;含有杂合Ty-1和纯合Ty-3抗性基因的品种的抗性要明显高于含杂合Ty-1和杂合Ty-3抗性基因的品种,说明番茄黄化曲叶病的Ty-3抗性基因的遗传可能为不完全显性遗传。
经过育种学家多年的努力,在抗番茄黄化曲叶病育种方面已经取得了显著成就。但是目前,大多抗番茄黄化曲叶病的商业杂交种,基本都是导入了单个抗性基因,当病害不是太严重时,表现为抗病;但当病害大规模发生时,它们的抗性较低,接近感病。而将多个抗性基因聚合到一个品种中,可以提高番茄对番茄黄化曲叶病的抗性。并且随着番茄黄化曲叶病的Ty-1、Ty-2、Ty-3、Ty-4及Ty-5抗性基因的定位及分子标记工作的进行(Zamir et al., 1994; Hanson et al., 2006; Garcia1, et al., 2007, http://www.plantpath.wisc.edu/, Geminivirus Resistant Tomatoes/Markers/MAS-Protocols/Ty2-TGC-Garcia.pdf; Jensen, et al., 2007, http://www.plantpath.wisc.edu/Geminivirus ResistantTomatoes/Markers/MAS-Protocols/Ty3a-allele.pdf; Ji et al., 2007; Ji et al., 2009; Anbinder et al., 2009),育种学家可以利用相关的分子标记更加准确快速地筛选抗原,并结合传统育种将其抗性基因聚合到一个品种中,从而培育出具有更高、更广、更持久抗性的番茄新品种。
因此,加强种质资源和抗病品种的引进,筛选并创造新的育种材料,并聚合不同效应的抗病基因,培育具有更广、更持久抗病性的番茄新品种成为番茄黄化曲叶病抗病育种的主要方向。
3材料与方法
3.1材料
本实验所用的材料1~10为实验室从国外引种的番茄黄化曲叶病抗病材料,11~12为感病栽培品种材料,材料品种及来源见表2。
表2 材料品种及来源 Table 2 Names and sources of materials |
3.2引物合成
鉴定番茄黄化曲叶病Ty-1抗性基因所使用的CAPS1标记引物参照Zamir等人的设计(Zamir et al., 1994),鉴定Ty-2抗性基因所使用的SCAR2标记引物参照Garcia等人的设计(Garcia1 et al),鉴定Ty-3抗性基因所使用的SCAR3标记引物参照Katie等人的设计(Jensen et al., 2007)。引物序列及其扩增产物的长度见表3和表4,所用引物由上海生物工程技术公司合成。
表3 抗性基因及鉴定所用引物序列 Table 3 The resistance gene and the sequences of primers used in the identification |
表4 不同抗病材料抗性基因的基因型及其标记所扩增产物的长度 Table 4 The genotypes of materials with different resistant gene,and the amplified fragments length by the markers |
3.3 PCR扩增与检测
用CTAB法提取12份番茄样品的叶片总DNA,作为PCR的模板。用于PCR反应的试剂均购自上海生物工程技术公司。PCR反应体系如下:模板DNA 1 μL,正向引物1 μL (2 μmoL),反向引物1 μL (2 μmoL),dNTP (10 mmol/L) 0.8 μL,10× Buffer 2 μL,Mg2+ 1.6 μL,Taq酶0.5 μL,补充ddH2O至20 μL。PCR反应程序如下:94℃变性5 min;然后94℃,30 s,55℃,60 s,72℃,1.5 min,共35个循环;最后72℃延伸10 min。然后取PCR产物于1.5%琼脂糖凝胶电泳,观察并用凝胶成像系统拍照保存。
3.4田间自然发病验证
2010年9月3日于浦江基地大棚内发现第一株有番茄黄化曲叶病症状的番茄材料,然后每天赶虫一次,使番茄苗均匀受毒。一个月后统计番茄材料的抗、感病情况。依据Lapidot等(Lapidot et al., 2001)的抗性分级方法,计算病情指数,公式如下:病情指数=(∑(病级×各级植株数))/(调查总株数×最高病级)。
作者贡献
付蓉蓉,刘杨和陈火英是本研究的实验设计和实验研究的执行人;付蓉蓉完成数据分析,论文初稿的写作;付蓉蓉和刘杨参与实验设计,试验结果分析;陈火英是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由上海市科技兴农重点攻关项目(沪农科攻字(2007)第5-1号)和上海市重点学科建设项目(B209)共同资助。作者感谢研究生李翔同学在本实验过程中的技术支持和有益的建议。
参考文献
Anbinder I., Reuveni M., Azari R., Paran I., Nahon S., Shlomo H., Chen L., Lapidot M., and Levin I., 2009, Molecular dissection of Tomato leaf curl virus resistance in tomato line TY172 derived from Solanum peruvianum, Theor. Appl. Genet., 119(3): 519-530 http://dx.doi.org/10.1007/s00122-009-1060-z
Boulton M.I., 2003, Geminiviruses: major threats to world agriculture, Annals of Applied Biology, 142(2): 143 http://dx.doi.org/10.1111/j.1744-7348.2003.tb00239.x
Hanson P.M., Green S.K., and Kuo G., 2006, Ty-2 a gene on chromosome 11 conditioning geminivirus resistance in tomato, Tomato Genetic Cooperative Report, 56: 17-18
He Z.F., Yu H., and Luo F.F., 2005, The molecular characteristics of DNA-A of tomato leaf curl Guangdong virus isolate G3, Zhiwu Bingli Xuebao (Acta Phytopathologica Sinica), 35(3): 208-213 (何自福, 虞皓, 罗方芳, 2005, 广东番茄曲叶病毒G3分离物基因组DNA-A的分子特征, 植物病理学报, 35(3): 208-213)
Ji Y.F., Schuster D.J., and Scott J.W., 2007, Ty-3, a begomovirus resistance locus near the Tomato yellow leaf curl virus resistance locus Ty-1 on chromosome 6 of tomato, Mol. Breeding, 20(3): 271-284 http://dx.doi.org/10.1007/s11032-007-9089-7http://dx.doi.org/10.1007/s11032-007-9102-1
Ji Y.F., Scott J.W., Schuster D.J., and Maxwell D.P., 2009, Molecular mapping of Ty-4, a new tomato yellow leaf curl virus resistance locus on chromosome 3 of tomato, Journal of the American Society for Horticultural Science, 134(2): 281-288
Lapidot M., Friedmanm M., Pilowsky M., Ben-Joseph R., and Cohen S., 2001, Effect of host plant resistance to tomato yellow leaf curl virus (TYLCV) on virus acquisition and transmission by Its whitefly vector, Virology, 91(12): 1209-1213
Picó B., Diez M.J., and Nuez F., 1996, Viral diseases causing the greatest economic losses to the tomato crop Ⅱ, The tomato yellow leaf curl virus: A review, Science Horticuture, 67(3-4): 151-196 http://dx.doi.org/10.1016/S0304-4238(96)00945-4
Varma A., and Maltathi V.G., 2003, Emerging geminivirus problems: A serious threat to crop production, Annals of Applied Biology, 142(2): 145-164 http://dx.doi.org/10.1111/j.1744-7348.2003.tb00240.x
Yue N., Ding M., Dong J.H., Luo Y.Q., and Zhang Z.K., 2008, Genetic diversity and distribution of tomato yellow leaf curl China virus in Yunnan province, Yunnan Duxue Xuebao (Journal of Yunnan University (Natural Sciences Edition)), 30(S1): 57-62 (岳宁, 丁铭, 董家红, 罗延青, 张仲凯, 2008, 中国番茄黄化曲叶病毒在云南的发生分布及其遗传多样性, 云南大学学报(自然科学版), 30(S1): 57-62)
Zamir D., Ekstein-Michelson I., Zakay Y., Navot N., Zeidan M., Sarfatti M., Eshed Y., Harel E., Pleban T., van-Oss H., Kedar N., Rabinowitch H.D., and Czosnek H., 1994, Mapping and introgression of a tomato yellow leaf curl virus tolerance gene, TY-1, Theor. Appl. Genet., 88(2): 141-146 http://dx.doi.org/10.1007/BF00225889
Zhao T.M., Yu W.G., Zhou Y.J., and Ji Y.H., 2007, Occurrence and diagnosis of tomato yellow leaf curl disease (TYLCD) in Jiangsu province, Jiangsu Nongye Xuebao (Jiangsu Journal of Agricultural Sciences), 23(6): 654-655 (赵统敏, 余文贵, 周益军, 季英华, 2007, 江苏省番茄黄化曲叶病毒病(TYLCD)的发生与诊断初报, 江苏农业学报, 23(6): 654-655)