2.国家小麦改良中心泰安分中心, 山东农业大学, 泰安, 271018
 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2010 年, 第 8 卷, 第 4 篇 doi: 10.5376/mpb.cn.2010.01.0004
收稿日期: 2010年05月06日 接受日期: 2010年06月10日 发表日期: 2010年10月07日
Qi et al., 2010, Molecular Tagging Wheat Powdery Mildew Resistance Gene Pm21 by EST-SSR and STS Markers, Molecular Plant Breeding(online) Vol.1 No.4 (doi:10.5376/mpb.2010.01.0004)
为丰富抗白粉病基因Pm21的分子标记类型,方便分子标记辅助育种,本研究利用含有抗白粉病基因Pm21的小麦种质系CB033和感染小麦白粉病的普通小麦品种辉县红杂交构建F2分离群体,采用优选小群体分析法进行了分子标记筛选。结果表明,在定位于小麦第六部分同源群的258个SSR、EST-SSR和STS标记中,102个标记能在亲本间揭示出多态性差异,2个EST-SSR标记(Xcfe164, Xedm129)和1个STS标记(Xcinau188)可在优选小群体中能扩增出特异性谱带;利用F2群体进行标记连锁分析,获得EST-SSR标记Xcfe164、 Xedm129和STS标记Xcinau188,它们与抗白粉病基因Pm21的连锁距离分别是3.75 cM、1.26 cM 和0.98 cM。利用F2:3家系对3个标记进行验证,结果证明:它们是Pm21基因可靠的分子标记,适合用于Pm21基因的分子标记辅助选择。
由专性寄生真菌小麦白粉菌(Erysiphe graminis.f.sp triticale)引起的小麦白粉病是小麦的主要病害之一,小麦感染白粉病后可导致穗粒数减少、粒重下降、品质变劣、产量降低。随着半矮杆小麦品种的推广和小麦生产水平的提高,白粉病在我国各麦区经常发生和流行,危害程度日趋严重,已成为影响和限制小麦高产、稳产、优质的一大障碍(王心宇等, 2001)。因此,发掘利用抗白粉病基因,筛选和培育抗病品种是防治小麦白粉病的有效途径。由中国从簇毛麦中发现定位的抗白粉病基因Pm21,是目前最为有效的抗病基因之一,其抗性强、抗谱广,能抗中国目前所有的白粉菌的菌系或生理小种,并且对120个欧洲小种也具有抗性(陈孝等, 1997; Huang et al., 1997),它已被成功地转入到普通小麦中,并定位于6VS/6AL的短臂上(齐莉莉等, 1995)。
目前,报道的与Pm21基因连锁的分子标记主要包括以下四大类:RAPD、AFLP、SCAR和STS标记。如Qi等(1996)筛选到可以追踪Pm21的RAPD标记OPH17-1400,之后Liu等(1999) 进一步将其转化为与Pm21连锁的SCAR (sequence characterized applied region)标记SCAR-1400和SCAR-1265;李辉等(2005)用120个随机引物对6D/6V代换系Pm930640进行RAPD分析,获得5个 6VS 的特异标记;Cao等(2006)根据抗白粉病基因的序列开发出能鉴定6VS的共显性分子标记 NAU/XiBao15- 902 (CINAU15 – 902) ;Chen等(2006)根据小麦 LRR(leucine-rich repeat)序列开发出能鉴定 6VS 的共显性分子标记 NAU/ XiBao16 - 1085(即CINAU16- 1085);王春梅等(2007)选用11个 RGA(Resistance Gene Analogy)和 17对STS引物筛选出分别位于6V短臂0.58~0.70和0.00~0.45区段的 CINAU17-1086 和CINAU18-723两个连锁标记;王振英等(2007)开发的RAPD引物(OPK08910)和AFLP引物(3对)可作为源自簇毛麦Pm21基因的选择标记。Wei等(2009)开发了一个能同时鉴定Pm12和Pm21的EST-SSR标记(XCAU127)。由于RAPD标记稳定性较低、重现性较差,限制了其在植物育种标记辅助选择中的应用;AFLP标记由于技术繁琐,费用昂贵且不易自动化,过程时间长,因此也限制了在植物育种标记辅助选择中的应用。目前,用于Pm21基因标记辅助选择的分子标记主要有SCAR1265(Liu et al., 1999)、SCAR1400(Liu et al., 1999)、CINAU171086(王春梅等, 2007)、CINAU18723(王春梅等, 2007)、STS标记CINAU15902 (Cao et al., 2006)和CINAU161650(Chen et al., 2006)。
本研究利用定位在第六部分同源群上的258个SSR、EST-SSR和STS标记对Pm21进行了连锁分子标记筛选,以期获得与Pm21紧密连锁的SSR、EST-SSR和STS等新型分子标记,丰富Pm21的分子标记类型,方便分子标记辅助育种。
1结果与分析
1.1小麦白粉病抗性鉴定
调查结果表明,在感病对照辉县红充分发病的情况下,抗病亲本CB033表现为免疫。在调查的213株CB033/辉县红F2群体中,抗病单株153株,感病单株60株,经χ2检验(χ2=1.401<χ20.05,P>0.05)差异不显著,抗病和感病单株的分离符合3:1的分离比例(表1)。
|
Table 1 Chi-square text and genetic analysis of F2 derived from the cross between CB033 and Hui xianhong |
1.2多态性引物的筛选
选用第六部分同源群上的258个SSR、EST-SSR和STS标记对亲本CB033和和辉县红进行标记的初次筛选,共获得102对多态性标记。利用筛选的多态性标记在F2分离群体中进行优选小群体筛选,获得3对与抗白粉病基因pm21有连锁关系的特异性标记,分别是EST-SSR引物Xcfe164、 Xedm129和STS引物Xcinau188。Xcfe164在10个典型抗病单株中能够扩增出大小为123 bp的带,在10个典型感病单株中不能扩增出此带(图1A);Xedm129在10个典型抗病单株中能够扩增出大小为233 bp、243 bp和321 bp的3条带,在10个典型感病单株中不能扩增出此3条带(图1B);Xcinau188在10个典型抗病单株中能够扩增出大小为335 bp的带,在10个典型感病单株中不能扩增出此带(图1C)。
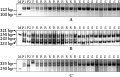 图1 分别为Xcfe164、Xedm129和Xcinau188在F2群体10个典型抗病单株和10个典型感病单株中的带型检测结果 Figure 1 Amplification products by Xcfe164, Xedm129 and Xcinau188 in resistant parent CB033 (P1), susceptible parent Hui xianhong (P2), 10 typical resistant individuals and 10 typical susceptible individuals of F2 |
1.3分子标记连锁分析
为了进一步检测上述3个标记是否与抗白粉病基因Pm21连锁,进一步利用F2分离群体进行了连锁分析。结果表明,3个标记均与基因Pm21紧密连锁, F2群体中抗、感基因型的分离都符合期望的分离比例3:1 (表1);标记Xcfe164、Xedm129和Xcinau188与抗白粉病基因Pm21的连锁距离分别是3.75 cM、1.26 cM和0.98 cM (图2)。F2部分单株的扩增结果(图3)。
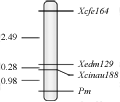 图2 F2群体中抗白粉病基因Pm21的分子标记遗传连锁图谱 Figure 2 Linkage maps of the Pm21 in the F2 populations |
图3 Xcfe164在部分F2群体的带型检测结果 Figure 3 Amplification products by Xcfe164 in resistant parent CB033 (P1), susceptible parent Hui xianhong (P2), part individuals of F2 |
1.4分子标记的验证
为了验证标记Xcfe164、Xcinau188和Xedm129的可靠性,利用共显性标记NAU/XiBao15- 902 (曹爱忠等, 2006) 在F2选取纯合抗病单株和纯合感病单株种成F2:3家系,进一步进行了抗病性鉴定和标记验证。结果表明,在调查的130株F2:3家系中62株纯合抗病单株对白粉病均表现免疫,68株感病单株均表现感染(图4);3个标记也均能扩增出相应的标记带。从而证明上述3个标记是可靠的。F2:3家系部分单株的扩增结果(图5A; 图5B)。
 图4 CB033和辉县红后代F2:3家系的抗性表现 Figure 4 Resistant performance of CB033 and hui xianghong’ derivetives |
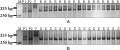 图5 Xcinau188在部分F2:3家系纯合抗病, 感病单株的带型检测结果 Figure 5 Amplification products by Xcinau188 in resistant parent Line CB033 (P1), susceptible parent Hui xianhong (P2), part pure resistant individuals of F2:3 |
2讨论
本研究筛选到与Pm21基因连锁的EST-SSR标记Xcfe164 、Xedm129和STS标记Xcnau188,丰富了Pm21基因的分子标记类型。由于EST是从cDNA文库中挑选克隆的基因表达序列片断,STS是根据单拷贝DNA片段两端的序列设计特异引物而扩增的特异序列,可以直接获得基因表达的信息,因此利用上述信息开发的EST-SSR和STS标记可靠性较好。本研究获得的上述3个标记与Pm21基因的遗传距离均较小,其中Xcfe164和Xedm129与Pm21基因的遗传距离分别为3.75 cM和1.26 cM, Xcinau188与Pm21基因的遗传距离为0.98 cM,因此它们在Pm21基因的标记辅助选择中具有利用价值,可用于标记辅助育种。本实验室利用上述3个标记进行Pm21基因的辅助选择也证明了它们的可靠性。
3材料与方法
3.1小麦材料
本实验所用的供试材料为含抗白粉病基因Pm21的小麦种质系CB033,普通小麦品种辉县红和辉县红与CB033杂交产生的F1、F2和F2:3家系。抗病种质系CB033由中国农业科学院陈孝研究员惠赠,国家小麦改良中心泰安分中心保存。
3.2引物
选用覆盖小麦第六部分同源群上的258对引物,共包括三大类分子标记,即基因组SSR、EST-SSR和STS (袁园园等, 2010)。以上所有引物均由上海生物工程技术有限责任公司合成;10×PCR Buffer、dNTPs和Taq酶等均为大连宝生物工程有限公司产品。
3.3小麦白粉病抗性鉴定
利用感病亲本辉县红作为感病对照种成感染行,以白粉病E15菌种在感染行内接种,对F1、F2及F2:3家系材料进行白粉病诱发感染;当辉县红充分发病时,调查亲本、F1、F2及F2:3家系的白粉病抗性,分析各后代群体的抗、感分离情况。
白粉病分级标准为6级分级标准:
0型:免疫,植株无病斑;
0;型:坏死反应,叶片有枯死斑;
1型:高抗,病斑小(一般直径小于1 mm),菌丝层稀薄可见绿色叶面,偶见较大病斑,但仍透绿,产孢量极少;
2型:中抗,叶片病斑直径小于1 mm,但菌丝层较厚,不透绿,能产生一定量孢子;
3型:中感,叶片病斑多,一般直径大于1 mm,菌丝层厚,产孢量大,但病斑不连片;
4型:高感,叶片病斑直径大于1 mm,菌丝层厚,产孢量多,病斑连片(详见盛宝钦,1988, 植物保护, 1: 49),
其中0型,0;型,1型、2型为抗病,3型、4型为感病。白粉病E15菌种由中国农业科学院李洪杰博士提供。
3.4总DNA的提取
按照SDS-酚法提取植株幼嫩叶片的DNA (Devos et al., 1993)。
3.5 PCR扩增及电泳检测
反应体系为15 μL,扩增程序使用降落PCR (touchdown PCR),扩增结束后10℃保存(袁园园等, 2010)。扩增反应所用仪器为美国Bio-Rad公司生产的9600 Thermal Cycler型热循环仪。扩增产物经8%非变性聚丙稀酰胺凝胶电泳,硝酸银染色。
3.6标记分析
选用优选小群体分析法进行分析(Hao et al., 2008),即选择典型的抗病单株10株(即白粉病级别为0或0;型的单株)和典型的感病单株10株(白粉病级别为4型的单株)分别提取总DNA,然后进行PCR扩增和电泳分析,寻找抗感性状(表现型)和扩增带型(基因型)基本一致的标记(选取标准参见宗浩等, 2009),然后进一步在F2分离群体中进行验证,计算所筛得标记与基因(Pm21)之间的连锁遗传距离。利用卡方检验(χ2),确定分离群体中观测值和期望值的符合度。微卫星标记与基因Pm21间的遗传距离用JoinMap软件进行计算,最后用MapDraw绘制遗传连锁图谱(刘仁虎等, 2003)。
作者贡献
作者亓晓蕾对本项研究做了主要贡献,包括最初的实验设计、引物的查询与合成、实验数据的分析及论文初稿的写作等;作者崔法参与了实验数据的初步处理和论文初稿的修改工作;作者余利参与了整个实验的过程;作者丁安明参与了实验数据的处理工作;作者李君与陈桂玲参与了实验的初步准备工作;作者王洪刚协调本项实验的顺利进行并参与了实验设计与论文的修改工作。所有作者均已阅读和赞同本文的最终稿。
致谢
感谢师兄郝元峰在本文论最初的构思中提出了非常有用的建议;感谢师妹包黎明与吴瑕在本实验过程中给予了大力帮助,使实验顺利完成;感谢陈孝研究员惠赠小麦种质CB033,为本实验提供了实验材料;感谢李洪杰博士提供了白粉病E15病菌,使本实验得到了准确的抗感分离结果。本实验所用的标记均来自GrainGenes2.0 及相关文献(文章中有说明),并均由上海生工生物工程有限公司合成;本实验所用的10×PCR Buffer, dNTPs and Taq酶均由大连宝生物工程有限公司合成。中国农业科学院对本研究的部分工作给予了一定的支持,在此表示衷心的感谢。本论文所有权归山东农业大学所有,在此非常感谢国家自然科学基金(30771349)的资助。
参考文献
Cao A.Z., Wang X.E., Chen Y.P., Zou X.W., and Chen P.D., 2006, A sequence- specific PCR marker linked with Pm21 distinguishes chromosome 6AS, 6BS, 6DS of Triticum aestivum and 6VS of Haynaldia villosa, Plant Breed, 125: 201-205 doi:10.1111/j.1439-0523.2006.01222.x
Chen P.D., Qi L.L., Zhou B., Zhang S.Z., and Liu D.J., 1995, Development and molecular cytogenetic analysis of wheat-Haynaldia villosa 6VS/6AI. translocation lines Specifying resistance to powdery mildew, Theor. Appl. Genet., 91: 1125-1128 doi:10.1007/BF00223930
Chen X., Shi A.N., and Shang L.M., 1997, The resistance reaction of h.villosa to powdery mildew isolates and its expression in wheat background, Acta Phytopathologica sinica, 27(1): 17-22 (陈孝, 施爱农, 尚立民, 1997, 簇毛麦对不同白粉病菌菌系的抗性反应及其在小麦遗传背景下的表达,植物病理学报, 27(1): 17-22)
Chen Y.P., Wang H.Z., Cao A.Z., Wang C.M., and Chen P.D., 2006, Cloning of a resistance gene analog from wheat and development of a co-dominant PCR marker for Pm21, J. Integr. Plant Biol., 48: 715-721 doi:10.1111/j.1744-7909.2006.00257.x
Devos K.M., Millan T., and Gale M.D., 1993, Comparative RFLP maps of the homeologous group-2 chromosomes of wheat, rye and barley, Theoretical and Applied Genetics, 85: 784-792
Hao Y.F., Liu A.F., Wang Y.H., Feng D.S., Gao J.R., Li X.F., Liu S.B., and Wang H.G., 2008, Pm23: a new allele of Pm4 located on chromosome 2AL in wheat, Theoretical and Applied Genetics, 117: 1205-1212 doi:10.1007/s00122-008-0827-y
Huang X.Q., Hsam S.L.K., and Zeller F.J., 1997, Identification of powdery mildew resistance genes in common wheat (Triticum aestivum L. em Thell.). IX. Cultivars, land races and breeding lines grown in China, PlantBreed, 116: 233-238 doi:10.1111/j.1439-0523.1997.tb00988.x
Li H., Chen X., Shi A.N., Kong F.J., Leath S., Murphy J.P., and Jia X., 2005, Characterization of RAPD markers and RFLP marker linked to powdery mildew resistant gene derived from different H.villosa, Scientia Agricultura Sinica, 38(3): 439-445 (李辉, 陈孝, 施爱农, 孔凡晶, Leath S., Murphy J.P., 贾旭, 2005, 簇毛麦抗白粉病基因的RAPD及RFLP标记, 中国农业科学, 38(3): 439-445)
Li G.P., Chen P.D., Zhang S.Z., Wang X., He Z.H., Zhang Y., Zhao H., Huang H.Y., and Zhou X.C., 2007, Effects of the 6VS/6AL translocation on agronomic traits and dough properties of wheat, Euphytica, 155: 305- 313 doi:10.1007/s10681-006-9332-z
Liu R.H., and Meng J.L., 2003, MapDraw: A microsoft excel Macro for drawing genetic linkage maps based on given genetic linkage data, Yichuan (Hereditas), 25(3): 317-321 (刘仁虎, 孟金陵, 2003, MapDraw, 在Excel中绘制遗传连锁图的宏, 遗传, 25(3): 317-32l)
Liu Z., Sun Q., Ni Z., and Yang T., 1999, Development of SCAR markers linked to the Pm21 gene conferring resistance to powdery mildew in common wheat, Plant Breeding, 118: 215-219 doi:10.1046/j.1439-0523.1999.118003215.x
Liu Z.Y., Sun Q.X.,, Li H.J., Ni Z.F., Yang Z.M., Tang B.R., Yang A.D., and Jia X., 1999, Molecular identification and marker-assisted selection of Pm21 gene conferring resistance to powdery mildew in wheat, (Yichuan Xuebao)Acta Genedca Sinica, 26(6): 673-682 (刘志勇, 孙其信, 李洪杰, 倪中福, 杨作民, 唐伯让, 杨爱东, 贾旭, 1999, 小麦抗白粉病基因Pm21的分子鉴定和标记辅助选择, 遗传学报, 26(6): 673-682)
Qi L.L., Cao M.S., Chen P.D., Li W.L., and Liu D.J., 1996, Identification, mapping and application of polymorphic DNA associated with resistance gene Pm21 of wheat, Genome, 39: 191-197 doi:10.1139/g96-025
Qi L.L., Chen P.D., Liu D.J., Zhou B., and Zhang S.Z., 1995, The Gene Pm21—A new source for resistance to wheat powdery mildew, Acta Agronomica Sinica, (3): 57-262 (齐莉莉, 陈佩度, 刘大钧, 周波, 张守忠, 1995, 小麦白粉病新抗源—基因Pm21, 作物学报, (3): 257-262)
Song W., Xie C.J., Du J.K., Xie H., Liu Q., Ni Z.F., Yang T.M., Sun Q.X., and Liu Z.Y., 2009, A “one-marker-for-two-genes ”approach for efficient molecular discrimination of Pm12 and Pm21 conferring resistance to powdery mildew in wheat, Mol. Breeding, 23: 357-363 doi:10.1007/s11032-008-9235-x
Wang C.M., Bie T.D., Chen Q.Z., Cao A.Z., and Chen P.D., 2007, Development and application of molecular markers specific to chromosome 6VS of Haynaldia villosa, Acta Agronomica Sinica, 33(10): 1595-1600 (王春梅, 别同德, 陈全战, 曹爱忠, 陈佩度, 2007, 簇毛麦6V染色体短臂特异分子标记的开发和应用, 作物学报, 33(10): 1595-1600)
Wang X.Y., Chen P.D., and Zhang S.Z., 2001, Pyramiding and marker-assisted selection for powdery mildew resistance genes in common wheat, Acta Genetica Sinica, 28(7): 640-646 (王心宇, 陈佩度, 张守忠, 2001, 小麦白粉病抗性基因的聚合及其分子标记辅助选择, 遗传学报, 28(7): 640-646)
Wang Z.Y., Zhao H.M., Hong J.X., Chen L.Y., Zhu J., Li G., Peng Y.K., Xie C.J., Liu Z.Y., Sun Q.X., and Yang Z.M., 2007, Identification and analysis of four novel molecular markers linked to powdery mildew resistance gene Pm21 in 6VS chromosome short arm of Haynaldia villosa, Acta Agronomica Sinica, 33(4): 605-611 (王振英, 赵红梅, 洪敬欣, 陈丽媛, 朱婕, 李刚,彭永康, 解超杰, 刘志勇, 孙其信, 杨作民, 2007, 簇毛麦6VS上4个新分子标记的鉴定及与抗白粉病基因Pm21的连锁分析, 作物学报, 33(4): 605-611)
Yuan Y.Y., Wang Q.Z., Cui F., Zhang J. T., Du B., and Wang H.G., 2010, Specific loci in genome of wheat milestone parent bima 4 and their transmission in derivatives, Acta Agronomica Sinica, 36(1): 9-l6 (袁园园, 王庆专, 崔 法, 张景涛, 杜斌, 王洪刚, 2010, 小麦骨干亲本碧蚂4号的基因组特异位点及其在衍生后代中的传递, 作物学报, 36(1): 9-l6)
Zong H., Cui F., Bao Y.G., Zhao C.H., Wang Y.H., Du B., Wang Q.Z., and Wang H.G., 2009, Developing molecular markers for the Rht gene in dwarfing germplasm line shannong 495, Journal of Triticeae Crops, 29(3): 385-389 (宗浩, 崔法, 鲍印广, 赵春华, 王玉海, 杜斌, 王庆专, 王洪刚, 2009, 小麦矮秆种质系山农495矮秆基因的分子标记定位, 麦类作物学报, 29(3): 385-389)