1.江苏徐州甘薯研究中心/中国农业科学院甘薯研究所, 徐州, 221121
2.环境生物工程研究中心, 韩国生命工学研究院, 大田, 305-806

作者

通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 82 篇 doi: 10.5376/mpb.cn.2011.09.0082
收稿日期: 2011年05月16日 接受日期: 2011年06月22日 发表日期: 2011年06月24日
转录因子(transcription factor),又称反式作用因子,是能与位于转录起始位点上游50 bp~5 000 bp的顺式作用元件(cis-acting elements)、沉默子(silencer)或增强子(enhancer)特异性结合的一类蛋白,其通过与启动子(promoter)区域的结合,激活或抑制下游基因在特定时间和空间的转录与表达。植物体内存在大量的转录因子,在拟南芥中,全基因组中超过5%的基因用于编码大约1 500种转录因子。根据与DNA结合区域的特点,这些转录因子可以分为若干个家族(Riechmann et al., 2000)。
WRKY蛋白家族是近年来发现的又一类植物特有的转录调节因子,因在N-端含有由WRKYGQK组成的高度保守的氨基酸序列而得名。目前,人们已从多种植物中分离出该家族的成员,并对其生理特性进行深入研究(Chen and Chen, 2000;Sun et al., 2003; Lagace and Matton, 2004; Zhang et al., 2004; Xu et al., 2004; Borrone et al., 2004; Ashida et al., 2002; Lambais, 2001; Pnueli et al., 2002)。WRKY蛋白能专一性结合((T) (T) TGAC (C/T)序列,而这种结合特定DNA序列的功能是由WRKY蛋白中的WRKY结构域行使的(Eulgem et al., 1999)。研究表明,WRKY蛋白广泛地参与植物对生物、非生物胁迫的应答反应、植物衰老和器官发育等一系列生理活动,在植物的抗逆境反应中起着非常重要的作用。
虽然IbSPF1是第一个从植物中克隆得到的WRKY超家族成员(Ishiguro and Nakamura, 1994),但是其生物学功能一直没有得到深入了解。本实验以日本甘薯品种‘Kokei No.14’总RNA为模板,成功地克隆了IbSPF1基因cDNA,构建起含有不同启动子(CaMV 35S和SWPA2)的IbSPF1基因植物表达载体,对进一步研究IbSPF1基因的生物特性以及转基因甘薯的抗逆性有重要意义,并为抗逆植物基因工程的进一步研究提供参考。
1结果与分析
1.1 IbSPF1基因的克隆及序列测定
参照Ishiguro和Nakamura (1994)报道的甘薯基因cDNA序列,设计一对基因特异性引物(GSP, 由韩国SolGent公司合成),IbSPF1-Forward:5’-GGATCCATGGCTGCTTCT TCAGGGACAATA-3’(下划线部分为BamHⅠ酶切位点);IbSPF1-Reverse:5’-GGATCCTCAAGCTAGCAATGTGTCCAGAAA-3’(下划线部分为BamHⅠ酶切位点)。按照以上设计引物对IbSPF1基因进行PCR扩增,用1%琼脂糖凝胶电泳检测PCR产物显示一条1.7 kb左右长度的DNA片段(图1),该产物经凝胶回收试剂盒回收克隆到T-Blunt载体上,转至大肠杆菌DH5α。挑取4个阳性克隆用碱裂解法提取质粒,BamHⅠ酶切后,编号为2、3和4的克隆均可扩增出预期的目的片段(图2)。测序结果表明,3号克隆序列与NCBI上登录的序列仅有一个核苷酸差异(图3),相似度高达99.99%。
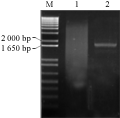
图1 RT-PCR扩增结果
注: M: 分子量Marker; 1: 以Oligo (dT)为引物所得PCR产物; 2: 以GSP为引物所得PCR产物
Figure 1 RT-PCR amplification of IbSPF1 cDNA
Note: M: Marker; 1: The PCR product with Oligo (dT) primer; 2: The PCR product with GSP primer |
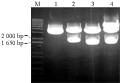
图2 重组质粒T-Blunt-IbSPF1酶切检测
注: M: 分子量Marker; 1~4: 质粒酶切结果
Figure 2 Detection of remodeled plasmid T-Blunt- IbSPF1 digested with BamHI
Note: M: Marker; 1~4: The results of plasmid digested with restriction endonuclease |

图3 获得的IbSPF1基因序列与NCBI登录序列比对(部分序列)
注: 红色标识表示的是两基因之间核苷酸差异序列
Figure 3 Comparison of cloned IbSPF1 gene with NCBI one (part of sequence)
Note: The difference between DNA sequence of cloned IbSPF1 gene with NCBI one is indicated by red mark |
1.2植物表达载体的构建与鉴定
将IbSPF1基因分别与质粒pCAMBIA2300-CaMV 35S和pCAMBIA2300-SWPA2连接后得到单克隆,用引物对1(CaMV 35S int-For和IbSPF1-Reverse)和引物对2(SWPA2 c-term-For和IbSPF1-Reverse)进行克隆PCR检测,以鉴定IbSPF1片段与pCAMBIA2300-CaMV 35S或pCAMBIA2300-SWPA2的连接方向的正确性。在挑取的7个pCAMBIA2300-CaMV 35S-IbSPF1阳性克隆中共有2个克隆得到了预期的目的片段(图4),表明编号分别为4和8的克隆连接方向正确;在挑取的5个pCAMBIA2300-SWPA2-IbSPF1阳性克隆中共有4个克隆得到了预期的目的片段(图5),结果显示编号为3、4、5和6的克隆连接方向正确。提取质粒后,用BamHI酶切以上连接方向正确的阳性克隆,所检测的六个克隆酶切后皆可以得到大小为1 650 bp的片段(图6),表明植物表达载体pCAMBIA2300-CaMV 35S-IbSPF1和pCAMBIA2300-SWPA2-IbSPF1已构建成功(图7)。
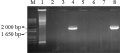
图4 IbSPF1片段与pCAMBIA2300-CaMV 35S的连接方向鉴定
Figure 4 Orientation identification of IbSPF1 fragment in pCAMBIA2300-CaMV 35S
注: M: 分子量Marker; 1: 空pCAMBIA2300-CaMV 35S载体; 4, 8: 阳性克隆
Note: M: Marker; 1: The empty pCAMBIA2300-CaMV 35S vector; 4, 8: The positive clones |
.png)
图5 IbSPF1片段与pCAMBIA2300-SWPA2的连接方向鉴定
注: M: 分子量Marker; 1: 空pCAMBIA2300-SWPA2载体; 3~6: 阳性克隆
Figure 5 Orientation identification of IbSPF1 fragment in pCAMBIA2300-SWPA2
Note: M: Marker; 1: The empty pCAMBIA2300-SWPA2 vector; 3~6: The positive clones |
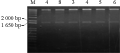
图6 重组质粒pCAMBIA2300-CaMV 35S (或SWPA2)-IbSPF1酶切检测
注:CaMV35S_p: 4,8; SWPA2_p: 3,4,5,6
Figure 6 Detection of remodeled plasmid pCAMBIA2300-CaMV 35S (or SWPA2)-IbSPF1 by enzyme restriction
Note: CaMV35S_p: 4,8; SWPA2_p: 3,4,5,6 |

图7 植物表达载体pCAMBIA2300-CaMV 35S(或SWPA2)-IbSPF1的构造
Figure 7 Diagrgam for construct of plant expression vector pCAMBIA2300-CaMV 35S (or SWPA2)-IbSPF1 |
1.3根癌农杆菌的转化与鉴定
采用冻融法将含有两个不同启动子的重组表达载体导入农杆菌EHA105中,分别得到许多转化子。以根癌农杆菌中纯化的质粒为模板,用IbSPF1基因的特异引物进行PCR检测(图8; 图9):所挑取的四个转化子和阳性对照的DNA中均能扩增出与IbSPF1 cDNA片段大小相同的片段,而阴性对照未能扩增出相应条带,说明重组质粒确已转入根癌农杆菌。
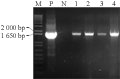
图8 pCAMBIA2300-CaMV 35S-IbSPF1导入根癌农杆菌结果鉴定
注: M: 分子量Marker; P: 阳性对照; N: 阴性对照; 1~4: 阳性克隆子
Figure 8 Identification of transformant for pCAMBIA2300-CaMV 35S-IbSPF1 into Agrobacterium tumefaciens strain EHA105
Note: M: Marker; P: The positive control; N: The negative control; 1~4: The positive clones |
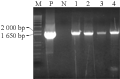
图9 pCAMBIA2300- SWPA2-IbSPF1导入根癌农杆菌结果鉴定
注: M: 分子量Marker; P: 阳性对照; N: 阴性对照; 1~4: 阳性克隆子
Figure 9 Identification of transformant for pCAMBIA2300- SWPA2-IbSPF1 into Agrobacterium tumefaciens strain EHA105
Note: M: Marker; P: The positive control; N: The negative control; 1~4: The positive clones |
2讨论
WRKY蛋白是DNA结合的调节蛋白,通过与目标基因上的W盒元件互作,在转录水平上调控基因的表达。各种高等植物当机体受到机械损伤、病原物侵害或者非生物胁迫诱导时,WRKY基因都能大量而快速的表达。研究证实,有三分之二的拟南芥WRKY基因被病原侵染或被植物防卫反应的信号分子水杨酸诱导(Dong et al., 2003)。水稻受真菌病原体 M. grisea侵染后,在被测试的45个OsWRKY基因中有15个基因的表达显著增加,而其中12个受M. grisea诱导的OsWRKY基因也不同程度的受到细菌病原体Xanthomonas oryzae pv. oryzae (Xoo)的差异调控(Ryu et al., 2006)。(仇玉萍等, 2004, 科学通报, 49(18): 1860-1869)对获得的13个水稻WRKY基因进行Northern blotting分析,发现其中10个WRKY基因的表达受到NaCl、PEG、低温(4℃)和高温(42℃)等4种非生物逆境因子胁迫的影响,但其诱导表达模式在各种胁迫及胁迫诱导时间上均存在着很大的差异,这种基因诱导表达模式的差异可能体现于它们之间的生物学功能的差异,在水稻抵抗不同非生物胁迫或不同抗逆境信号转导中可能发挥不同的作用。在实验过程中,我们利用RT-PCR技术对IbSPF1基因在甘薯不同生长部位以及病原菌浸染、干旱胁迫和NaCl处理下的表达谱进行了初步研究,发现其表达方式存在着很大的区别(结果未发表),说明IbSPF1基因同许多WRKY家族成员一样,可能参与调控植物抗逆反应,这为转基因抗逆甘薯材料的获得提供了一种新的思路。我们相信,随着研究的深入,人们将会对IbSPF1基因的功能和生理特性进一步了解,IbSPF1基因将会在植物抗逆遗传转化研究中发挥越来越重要的作用。
CaMV 35S启动子是一种高效的组成型启动子,常用于调控植物外源基因的表达。但是利用诱导型启动子(特别是胁迫诱导型启动子)来精细调控基因表达,可能更加有利于毒害胁迫下植物抗逆蛋白的产生(Yoshida and Shinmyo, 2000)。SWPA2启动子是从甘薯悬浮培养组织中得到的一种氧化胁迫诱导的POD启动子(Kim et al., 2003),它的表达受各种氧化胁迫,如过氧化氢、UV照射及机械伤害的诱导。因此,SWPA2启动子有助于转基因植物中抗性基因的精确表达以及转基因细胞和植株中一些有益药物蛋白成分的大量生产。与此同时,SWPA2启动子对于氧化胁迫过程中的信号转导研究具有重大的意义。我们构建了含有不同启动子(CaMV 35S和SWPA2)的植物表达载体,目前正在进行载体的遗传转化试验,并取得了一些较好的结果,这些都为今后探索组成型启动子和胁迫诱导型启动子在转基因植物抗逆效果上的差异提供研究基础。
3材料与方法
3.1实验材料
3.1.1植物材料
甘薯栽培品种高系14 (Ipomoea batatas L. Lam. cv. Kokei No.14) 由韩国生命工学院环境生命工学研究中心植物抗氧化研究组繁育与保存,选取15 d~20 d的组培苗幼嫩茎叶为试材。
3.1.2菌株及质粒
供试的感受态大肠杆菌(Escherichia coli)菌株DH5α、克隆载体T-Blunt均为韩国SolGent公司产品;感受态根癌农杆菌(Agrobacterium tumefaciens)菌株EHA105、分别含有植物组成型启动子CaMV 35S和甘薯过氧化物诱导型启动子SWPA2 (Kim et al., 2003)的植物表达载体pCAMBIA2300(抗性标记为卡那霉素)由韩国生命工学院环境生命工学研究中心植物抗氧化研究组构建与保存。
3.1.3实验试剂
DNA限制性内切酶、Ex-Taq酶、Pfu高保真酶、牛小肠碱性磷酸酶(CIAP)和dNTP购自TaRaKa;T4 DNA连接酶购自Promega;逆转录(RT)试剂盒购自Fermentas;DNA凝胶产物回收试剂盒购自Real Biotech;DNA分子量Marker和高纯度质粒小提中量试剂盒购自SolGent,其他试剂为TaKaRa产品。
3.2实验方法
3.2.1植物RNA的提取和纯化
采用TRIzol法(Invitrogen公司)提取甘薯总RNA,具体提取方法参考说明书进行。测定浓度后,将其置于-20℃保存,以备后用。
3.2.2 PCR扩增及其产物回收
首先,按照逆转录试剂盒的说明书要求,分别以GSP和Oligo (dT)为引物将RNA转录为cDNA。接着对IbSPF1基因进行PCR扩增,扩增条件为94℃预变性2 min;94℃变性60 s,56℃退火45 s,72℃延伸90 s,25个循环;于72℃延伸10 min,PCR产物用韩国Real Biotech公司DNA凝胶回收试剂盒进行回收。
3.2.3中间载体的构建及测序
将回收的目的DNA片段与T-Blunt载体连接,转化大肠杆菌DH5α感受态细胞,在含卡那霉素的培养基上蓝白斑筛选,用碱法小批量抽提质粒,并作电泳鉴定和限制性内切酶分析。酶切鉴定片段大小正确后,将扩增片段送韩国SolGent公司测序。
3.2.4植物重组表达载体的构建及转化根癌农杆菌
将含有IbSPF1基因的T-Blunt载体用BamHI酶切,回收小片断后,克隆到经BamHI酶切的pCAMBIA2300载体(分别含有CaMV 35S和SWPA2启动子)上,构建成植物表达载体。冻融法转化根癌农杆菌EHA105 (An, 1987)。
作者贡献
后猛、郑在哲和安哲汉是本研究的实验设计和实验研究的执行人;后猛、郑在哲和郭尚洙完成数据分析,论文初稿的写作;马代夫参与实验设计,试验结果分析;李强是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由中韩国际合作项目“应用生物技术防治沙漠化的耐旱植物开发研究”、国家高技术研究发展计划(863计划)(2009AA10Z102)、国家科技支撑计划(2009BADA7B03)和江苏省“六大人才高峰”(2008201)共同资助。作者感谢韩国生命工学研究院环境生物工程研究中心植物抗氧化研究组各位成员在本实验过程中的技术支持和有益建议。本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
An G., 1987, Binary Ti vectors for plant transformation and promoter analysis, Methods Enzymol, 153: 292-305 http://dx.doi.org/10.1016/0076-6879(87)53060-9
Ashida Y., Nishimoto M., Matsushima A., Watanabe J., and Hirata T., 2002, Molecular cloning and mRNA expression of geraniol-inducible genes in cultured shoot primordia of Matricaria chamomilla, Biosci Biotechnol Bioche., 66(11): 2511-2514 http://dx.doi.org/10.1271/bbb.66.2511 PMid:12506999
Borrone J.W., Kuhn D.N., and Schnell R.J., 2004, Isolation, characterization, and development of WRKY genes as useful genetic markers in Theobroma cacao, Theor. Appl. Genet., 109(3): 495-507
http://dx.doi.org/10.1007/s00122-004-1662-4 PMid:15148571
Chen C., and Chen Z., 2000, Isolation and characterization of two pathogen-and salicylic acid-induced genes encoding WRKY DNA binding proteins from tobacco, Plant Mol. Biol., 42(2): 387-396
http://dx.doi.org/10.1023/A:1006399311615 PMid:10794538
Dong J.X., Chen C.H., and Chen Z.X., 2003, Expression profiles of the Arabidopsis WRKY gene superfamily during plant defense response, Plant Mol. Biol., 51(1): 21-37 http://dx.doi.org/10.1023/A:1020780022549 PMid:12602888
Eulgem T., Rushton P.J., Schmelzer E., Hahlbrock K., and Somssich I.E., 1999, Early nuclear events in plant defense signaling: rapid gene activation by WRKY transcription factors, EMBO J., 18(17): 4689-4699
http://dx.doi.org/10.1093/emboj/18.17.4689 PMid:10469648 PMCid:1171542
Ishiguro S., and Nakamura K., 1994, Characterization of a cDNA encoding a novel DNA-binding protein, SPF1, that recognizes SP8 sequences in the 5´ upstream regions of genes coding for sporamin and β-amylase from sweet potato, Mol Gen. Genet, 244(6): 563-571 PMid:7969025
Kim K.Y., Kwon S.Y., Lee H.S., Hur Y., Bang J.W., and Kwak S.S., 2003, A novel oxidative stress-inducible peroxidase promoter from sweetpotato: Molecular cloning and characterization in transgenic tobacco plants and cultured cells, Plant Mol. Biol., 51(6): 831-838 http://dx.doi.org/10.1023/A:1023045218815 PMid:12777043
Lagace M., and Matton D.P., 2004, Characterization of a WRKY transcription factor expressed in late torpedo-stage embryos of Solanum chacoense, Planta, 219(1): 185-189 http://dx.doi.org/10.1007/s00425-004-1253-2 PMid:15045588
Lambais M.R., 2001, In silico differential display of defense-related expressed sequence tags from sugarcane tissues infected with diazotrophic endophytes, Genet. Mol. Biol., 24(1-4): 103-111 http://dx.doi.org/10.1590/S1415-47572001000100015
Pnueli L., Hallak-Herr E., Rozenberg M., Cohen M., Goloubinoff P., Kaplan A., and Mittler R., 2002, Molecular and biochemical mechanisms associated with dormancy and drought tolerance in the desert legume Retama raetam, Plant J., 31(3): 319-330 http://dx.doi.org/10.1046/j.1365-313X.2002.01364.x PMid:12164811
Riechmann J.L., Heard J., Martin G., Reuber L., Jiang C., Keddie J., Adam L., Pineda O., Ratcliffe O.J., Samaha R.R., Creelman R., Pilgrim M., Broun P., Zhang J.Z., Ghandehari D., Sherman B.K., and Yu G., 2000, Arabidopsis transcription factors: Genome-wide comparative analysis among eukaryotes, Science, 290(5499): 2105-2110 http://dx.doi.org/10.1126/science.290.5499.2105 PMid:11118137
Ryu H.S., Han M.H., Lee S.K., Cho J.I., Ryoo N., Heu S., Lee Y.H., Bhoo S.H., Wang G.L., Hahn T.R., and Jeon J.S., 2006, A comprehensive expression analysis of the WRKY gene superfamily in rice plants during defense response, Plant Cell Rep., 25(8): 836-847 http://dx.doi.org/10.1007/s00299-006-0138-1 PMid:16528562
Sun C.X., Palmqvist S., Olsson H., Boren M., Ahlandsberg S., and Jansson C., 2003, A novel WRKY transcription factor, SUSIBA2, Participates in sugar signaling in barley by binding to the sugar-responsive elements of the iso1 promoter, Plant Cell, 15(9): 2076-2092 http://dx.doi.org/10.1105/tpc.014597 PMCid:181332
Xu Y.H., Wang J.W., Wang S., Wang J.Y., and Chen X.Y., 2004, Characterization of GaWRKY1, a cotton transcription factor that regulates the sesquiterpene synthase gene (+)-δ-Cadinene synthase-A, Plant Physiol., 135(1): 507-515 http://dx.doi.org/10.1104/pp.104.038612 PMid:15133151 PMCid:429402
Yoshida K., and Shinmyo A., 2000, Transgene expression systems in plant, a natural bioreactor, J. Biosci Bioeng, 90(4): 353-362 http://dx.doi.org/10.1016/S1389-1723(01)80001-3 http://dx.doi.org/10.1263/jbb.90.353 PMid:16232872
Zhang Z.L., Xie Z., Zou X.L., Casaretto J., Ho D.T.H., and Shen Q.X.J., 2004, A rice WRKY gene encodes a transcriptional repressor of the gibberellin signaling pathway in aleurone cells, Plant Physiol., 134(4): 1500-1513 http://dx.doi.org/10.1104/pp.103.034967 PMid:15047897 PMCid:419826
 作者
作者  通讯作者
通讯作者


![]()

.png)

![]()

