 作者
作者  通讯作者
通讯作者
《分子植物育种》网络版, 2011 年, 第 9 卷, 第 84 篇 doi: 10.5376/mpb.cn.2011.09.0084
收稿日期: 2011年05月13日 接受日期: 2011年06月20日 发表日期: 2011年06月27日
高雅等, 2011, 小麦微核心种质Glu-B3位点低分子量麦谷蛋白亚基等位基因的PCR检测, 分子植物育种 Vol.9 No.84(doi: 10.5376/mpb.cn.2011.09.0084)
低分子量麦谷蛋白亚基(LMW-GS)对普通小麦的加工品质有重要影响。本试验对中国小麦微核心种质中285份小麦品种采用10对Glu-B3位点特异性引物进行了Glu-B3位点的9个低分子量麦谷蛋白亚基等位基因类型的PCR检测,结果确定了284份品种各自的Glu-B3位点等位基因类型,另外1份品种为新的未知等位基因类型。其中c等位基因的品种数目最多,占总品种数高达56.49%,其次是e和i等位基因占32.28%,等位基因a、b、d、f、g分别为18.60%、27.37%、28.77%、12.98%、15.79%,等位基因h分布最少为3.55%,未知类型只占0.36%,9个等位基因按检出率大小排列顺序为c>i=e>d>b >a>g>f>h。对面筋强度作用最小的c亚基检出率是对面筋强度作用较大的b亚基的2倍以上。带有b亚基的品种可作为优质新品种培育的候选亲本。
小麦的储藏蛋白主要由聚合的麦谷蛋白和单节显性的醇溶蛋白组成(An et al., 2006),他们都对食品加工品质有重要影响(Shewry和Halford, 2002)。麦谷蛋白又被分为低分子量麦谷蛋白亚基(LMW-GS)和高分子量麦谷蛋白亚基(HMW-GS) (Bietz et al., 1975)。这些蛋白通过二硫键连接在一起形成麦谷蛋白大聚体(Gras et al., 2001)来影响面团的品质如粘弹性和延展性,而良好的弹性和延展性是制作优质面包的基础(Payne et al., 1987; Luo et al., 2001)。HMW-GS基因的等位变异及其与加工品质的关系已经得到广泛的研究,且依据聚合酶链式反应开发的DNA标记也已用于区分重要的Glu-1的等位基因Ax2*、Bx7、Bx7*、Bx17、By8、By9和Dx5 (Kasarda et al., 1988; Ma et al., 2003; Gale, et al., 2005; Butow et al., 2004; Lei et al., 2006)。近十几年来对LMW-GS的研究也越来越多,编码LMW-GS的基因也通过对普通小麦品种间染色体代换系和中国春缺体-四体、端体进行单向电泳和双向电泳分析得到定位,其在1A、1B和1D染色体上都有且大多数位于染色体短臂末端,距离着丝点42 cm~46 cm的Glu-A3、B3和D3位点,(Gupta和Shepherd, 1990; Jackson et al., 1983),分别与Gli-A1(1.3cm)、Gli-B1(2cm)和Gli-D1紧密连锁。Ikeda等从几个小麦品种中克隆并测序出包括超过100个序列标签的基因, 假基因和部分基因的LMW-GS家族(Pitts et al., 1988; Cloutier et al., 2001; Ikeda et al., 2002; Zhang et al., 2004; Zhao et al., 2006; Zhao et al., 2007)。随后LMW-GS等位基因变异渐已明确,普通小麦在Glu-A3位点有6个,a、b、c、d、e和f,Glu-B3位点有9个,a、b、c、d、e、f、g、h和i,Glu-D3位点有5个,a、b、c、d和e。在蛋白质水平,Gupta和Shepherd(1990)对普通小麦品种的LMW-GS蛋白进行SDS-PAGE电泳发现了多达20种带型。
LMW-GS由于其数目较多、分子量小且与大量的醇溶蛋白在电泳图谱上相互重叠,因此有关LMW-GS基因的等位变异及其与品质参数之间关系的研究报道相对较少(Kasarda, 1989)。开发特异功能标记追踪不同LMW-GS的基因,能避开通过复杂的蛋白质电泳分析小麦品种低分子量麦谷蛋白亚基各等位基因的组成,并为确定单个不同类型的LMW-GS对品质的影响并应用于育种提供了可能(Andersen和Lu¨bberstedt, 2003)。随着对LMW-GS编码基因序列的深入研究,已不断开发出针对LMW-GS位点的特异性引物(D’Ovidio et al., 1997; Campenhout et al., 1995; 赵惠贤等, 2004)。2004年,Zhang等开发了一套Glu-A3位点的等位基因PCR标记;2009年,Wang等又开发出Glu-B3位点的一套等位基因特异性引物(Zhang, 2004; Wang, 2009)。本文试图采用Wang等开发的一套Glu-B3位点等位基因特异引物对我国小麦微核心种质进行鉴定,以期了解我国小麦微核心种质Glu-B3位点低分子量麦谷蛋白亚基等位基因的分布状况,为进一步的研究提供依据。
1结果与分析
1.1 PCR检测Glu-B3位点特异性强的引物
根据L. H. Wang提供的10对引物和相应PCR反应条件,对整个微核心种质材料进行了检测。反应结果显示:Glu-B3位点等位基因a-d、fg、g-i引物的特异性很强,只扩增出唯一产物且与表1的分子量相当。
采用引物对SB1F/SB1R分别对285份微核心种质材料进行Glu-B3a基因克隆,检测结果显示,除了所有品种都能扩增出700 bp左右条带外,只有18.6%的品种能扩增出1 095 bp的目的条带,其他81.4%的品种没有扩增出目的条带,部分电泳结果如图1所示。
|
图1 特异引物SB1F/SB1R (Glu-B3a)的PCR扩增产物电泳检测图 Figure 1 PCR products of specific primer SB1F/SB1R (allele a) set on agarose gel electrophoresis |
采用引物对SB2F/SB2R,SB3F/SB3R,SB4F/SB4R,SB6F/SB6R,SB7F/SB7R,SB8F/SB8R,SB9F/SB9R分别对285份微核心种质材料进行Glu-B3b、c、d、fg、g、h、i基因克隆,检测结果显示,这7对引物特异性都很好,只能扩增出与之对应的目标产物,部分电泳结果如图2所示。
 图2 7对等位基因特异引物的PCR扩增产物电泳检测图 注: a: gluB3b; b:gluB3c; c: gluB3d; d: gluB3fg; e: gluB3g; f: gluB3h; g: gluB3i Figure 2 PCR products of seven gene-specific primer sets on agarose gel electrophoresis Note: a: gluB3b; b:gluB3c; c: gluB3d; d: gluB3fg; e: gluB3g; f: gluB3h; g: gluB3i |
1.2 PCR检测Glu-B3位点特异性弱的引物
反应结果表明:等位基因e和bef的引物SB5F/SB5R和SB10F/SB10R特异性不强,有非特异的条带出现。但并不影响检测结果,目的条带仍然很清晰(图3)。
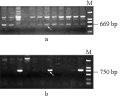 图3 2对等位基因特异引物的PCR扩增产物电泳检测图 注: a: gluB3e; b: gluB3bef Figure 3 PCR products of two gene-specific primer sets on agarose gel electrophoresis Note: a: gluB3e; b: gluB3bef |
1.3针对Glu-B3位点等位基因f的检测
在提供的10对引物里,对于等位基因f没有特异的引物进行检测,鉴于此,等位基因f的鉴定要综合b、e、fg、g和bef的PCR结果才能得出,只有当等位基因b、e、g都不存在而fg或bef存在时Glu-B3位点的等位基因鉴定为f。若均无这10对特异引物PCR扩增产物时,认为此品种的Glu-B3位点含未知类型等位基因,有待进一步开发。
1.4 Glu-B3位点各等位基因的分布
本研究获得了285份核心种质的Glu-A3位点各等位基因组成(表1),并有1份未知新的等位基因类型品种。由表1可知,以c等位基因的品种数目最多,占总品种数百分比高达56.49%,其次是e和i等位基因占32.28%,等位基因a、b、d、f、g分别为18.60%、27.37%、28.77%、12.98%和15.79%,等位基因h分布最少为3.55%,未知类型只占0.36%。但并不是一个品种就只含有一个等位基因,一般都有含有2-3个,有的品种甚至含有5个等位基因。随着新的等位基因的发现,品种的含量会更丰富。
 表1微核心种质资源中Glu-B3各等位基因的分布 注: A: 等位基因品种数; C: 中国小麦微核心种质总数 Table1 Glu-B3 alleles distribution in Chinese bread wheat micro core collections Note: A: The number of alleles variety; C: The number of Chinese bread wheat micro core collections |
2讨论
2.1关于Glu-B3位点在小麦微核心种质中的分布
培育优质小麦和提高小麦产量的基础是具有优质的种质资源,而培育优质新品种就要透彻、全面地对整个种质资源进行研究,挑选出最适合的育种亲本。微核心种质资源以最小资源数量代表了整个物种种质资源的遗传多样性,研究微核心种质基因分布就可基本了解整个种质基因资源状况。本文通过对微核心种质进行检测结果表明:在中国小麦微核心种质中Glu-B3位点的9个等位基因类型都存在,c等位基因分布最广,h等位基因分布最少,各个等位基因类型以c等位基因的检出率最高,按数目多少排列为c>i>e>b=d>a>g>f>h。另外,1个品种已知的9个等位基因类型均不含有,它是含有未知的一个类型还是多个类型,有待进一步考证。
在低分子量麦谷蛋白亚基Glu-B3位点等位基因对品质效应的研究中,Glu-B3位点编码的谷蛋白对品质贡献大小发现,由Glu-B3c和Glu-B3j编码的低分子量谷蛋白对品质贡献较大,其次为Glu-B3a、Glu-B3k和Glu-B3b。对面筋强度的贡献而言:Glu-B3b>Glu-B3c,就Rmax而言,Glu-B3等位基因各亚基:i>b=a>e=f=g=h>c。Glu-B3位点的d和b等位基因对面团延展性的作用大于其它等位基因。Zhao等证实Glu-B3位点对和面时间的贡献为:Glu-B3b>Glu-B3c(Zhao et al., 1997)。在我国种质资源中,在面团延展性方面起很大作用的d和b等位基因所占的比例才为27.37%:对面筋强度作用较大和最小的亚基分别为b亚基和c亚基,b亚基占27.37%;而c亚基却在种质中占56.49%,是b亚基的2倍多。对Rmax来说,分布最广的c亚基却贡献最小。可见针对LMW-GS的亚基组成,从国外引进优质品种和从不同品种寻找最优组合品种可能是我国小麦品质优化的两条重要的途径。
2.2 PCR扩增鉴定小麦低分子量麦谷蛋白亚基基因的实用性
LMW-GS基因的编码区很完整不含内含子且长度在1 000 bp左右,在核苷酸组成上N-端和C-端序列较为保守,只有中间区域发生突变,这些特征使得直接从基因组中分离并用PCR方法扩增出低分子量谷蛋白基因成为可能。随着研究的不断深入,已经成功克隆了很多的不同染色体组上的LMW-GS基因。本文采用Wang开发出的Glu-B3位点a、b、c、d、e、f、g、h、i等位基因的10对特异引物对中国小麦微核心种质进行扩增,其中a-d、fg、g-i亚基的引物特异性很强,e和bef亚基的引物特异性不好。这些特异分子标记都能很好地检测绝大部分品种,确定各亚基在微核心种质的分布情况。285份材料中存在1份材料,10对引物的PCR扩增均无产物,推测它可能含有Glu-B3位点新的未知的等位基因,可见PCR方法还可用于开发新的亚基类型。Glu-A3位点各等位基因的特异性标记已经开发出来,并得到了很好的运用。为了全面研究中国小麦的整个LMW-GS的分布,为育种亲本选育提供依据,开发Glu-D3位点的相应各等位基因的特异性标记迫在眉睫。
3材料与方法
3.1实验材料
中国小麦微核心种质共285个品种,由中国农科院作物所作物种质资源与生物技术重点实验室提供。
3.2实验方法
3.2.1基因组DNA的提取
选取1-2粒(籽粒小的取2粒)种子,用单粒磨粉机磨碎后放入2.0 mL离心管中,采用SDS-Tris饱和酚法提取小麦基因组总DNA,用紫外分光光度计检测DNA浓度,1.5%琼脂糖电泳检测DNA质量,-20℃下保存备用。
3.2.2 PCR 检测
PCR反应体系总体积为10 uL,其中含1×PCR Buffer,2.5 mmol/L MgCl2 ,0.1 mmol/L dNTP,上下游引物各20 µmol/L,0.1 U的Taq聚合酶和20 ngDNA模板。反应体系配好后,覆盖一层石腊油防止挥发,在Bio-Rad My Cycler 1.0 PCR仪上进行扩增。Glu-B3位点各等位基因的特异引物序列及目标片段长度详见表2。
PCR反应程序为:94℃预变性5 min;94℃ 35 s,55-62℃ 35 s,72℃ 1 min 30 s,共35个循环;72℃延伸8 min;4℃保存。PCR扩增产物用1.2%琼脂糖凝胶,经120V电压电泳0.5h分离,EB染色,Bio-Rad凝胶成像系统成像保存。
作者贡献
高雅、牛存秀、刘方方是本研究的实验设计和实验研究的执行人;司红起、高雅完成数据分析,论文初稿的写作;牛存秀、刘方方参与实验设计,试验结果分析;马传喜、司红起是项目的构思者及负责人,指导实验设计,数据分析,论文写作与修改。全体作者都阅读并同意最终的文本。
致谢
本研究由本研究由现代农业产业技术体系(nycytx-03)和国家科技支撑计划(2009BADA6B01)共同资助,本文中提到了我们实验中涉及的有关试剂供应商和测序服务商,这并非我们为这些试剂供应商和测序服务商的产品和服务提供推荐或背书。
参考文献
An X., Zhang Q., Yan Y., Li Q., Zhang Y., Wang A., Pei Y., Tian J., Wang H., Hsam S.L., and Zeller F.J., 2006, Cloning and molecular characterization of three novel LMW-i glutenin subunit genes from cultivated einkorn (Triticum monococcum L.). Theor. Appl. Genet., 113(3): 385-395 http://dx.doi.org/10.1007/s00122-006-0299-x PMid:16775696
Andersen J.R., and Lu¨bberstedt T., 2003, Functional markers in plants, Trends Plant Sci., 8(11): 554-560 http://dx.doi.org/10.1016/j.tplants.2003.09.010 PMid:14607101
Bietz J.A., Shepherd K.W., and Wall J.S., 1976, Single kernel analysis of glutenin: Use in wheat genetics and breeding, Cereal Chem, 52(4): 513-532
Butow B.J., Gale K.R., Ikea J., Juha’sz A., Bedo Z., Tama’s L., and Gianibelli M.C., 2004, Dissemination of the highly expressed Bx7 glutenin subunit (Glu-B1al allele) in wheat as revealed by novel PCR markers and RP-HPLC, Theor. Appl. Genet., 109(7): 1525-1535 http://dx.doi.org/10.1007/s00122-004-1776-8 PMid:15340686
Campenhout S., Stappen J., Sagi L., and Volckaert G., 1995, Locus-specific primers for LMW glutenin genes on each of the group 1 chromosomes of hexaploid wheat, Theor. Appl. Genet., 91(2): 313-319
http://dx.doi.org/10.1007/BF00220893
Cloutier S., Rampitsch C., Penner G.A., and Lukow O.M., 2001, Cloning and expression of a LMW-i glutenin gene, J. Cereal Sci., 33(2): 143-154 http://dx.doi.org/10.1006/jcrs.2000.0359
D’Ovidio R., Simeone M., Masci S., and Porceddu E., 1997, Molecular characterization of a LMW-GS gene located on chromosome 1B and the development of primers specific for the Glu-B3 complex locus in durum wheat, Theor. Appl. Genet., 95(7): 1119-1126 http://dx.doi.org/10.1007/s001220050671
Gale K.R., 2005, Diagnostic DNA markers for quality traits in wheat, Cereal Sci., 41(2): 181-192 http://dx.doi.org/10.1016/j.jcs.2004.09.002
Gras P.W., Anderssen R.S., Keentock M., Bekes F., and Appels R., 2001, Gluten protein functionality in wheat flour processing: A review, Agric Res., 52(12): 1311-1323 http://dx.doi.org/10.1071/AR01068
Gupta R.B., and Shepherd K.W., 1990, Two-step one-dimensional SDS-PAGE analysis of LMW subunits of glutenin, Theor. Appl. Genet., 80: 65-74 http://dx.doi.org/10.1007/BF00224017 http://dx.doi.org/10.1007/BF00224384
Ikeda T.M., Nagamine T., Fukuoka H., and Yano H., 2002, Identification of new low-molecular-weight glutenin subunit genes in wheat, Theor. Appl. Genet., 104(4): 680-687
http://dx.doi.org/10.1007/s001220100756 PMid:12582674
Jackson E.A., Holt L.M., and Payne P.I., 1983, Characterisation of high-molecular-weight gliadin and low-molecular-weight glutenin subunits of wheat endosperm by two-dimentional electrophoresis and chromosomal localisation of their controlling genes, Theor. Appl. Genet., 66(1): 29-37 http://dx.doi.org/10.1007/BF00281844
Kasarda D.D., Tao H.P., Evans P.K., and Yuen S.W., 1988, Sequencing of protein from a single step of a 2-D gel pattern N-terminal sequence of a major wheat LMW-glutenin subunit, J. Exp. Bot., 39: 899-906
http://dx.doi.org/10.1093/jxb/39.7.899
Kasarda D.D., 1989, Glutenin structure in relation to wheat quality, In: Pomeranz Y., Wheat is Unique, American Association of Cereal Chemists, St. Paul. MN, pp.277-302
Wang L.H., Zhao X.L., He Z.H., Ma W., Appels R., Pen˜a R.J., and Xia X.C., 2009, Characterization of low-molecular-weight glutenin subunit Glu-B3 genes and development of STS markers in common wheat (Triticum aestivum L.), Theor. Appl. Genet., 118(3): 525-539 http://dx.doi.org/10.1007/s00122-008-0918-9 PMid:18989655
Lei Z.S., Gale K.R., He Z.H., Gianibeli C., Larroque O., Xia X.C., Butow B.J., and Ma W., 2006, Y-type gene specific markers for enhanced discrimination of high-molecular weight glutenin alleles at the Glu-B1 locus in hexaploid wheat, Cereal Sci., 43(1): 94-101 http://dx.doi.org/10.1016/j.jcs.2005.08.003
Luo C., Griffin W.B., Branlard G., McNeil D.L., 2001, Comparison of low- and high- molecular-weight wheat glutenin allele effects on flour quality. Theor. Appl. Genet., 102: 1088-1098 http://dx.doi.org/10.1007/s001220000433
Ma W., Zhang W., and Gale K.R., 2003, Multiplex-PCR typing of high molecular weight glutenin alleles in wheat, Euphytica, 134(1): 51-60 http://dx.doi.org/10.1023/A:1026191918704
Payne P.I., 1987, Genetics of wheat storage proteins and the effect of allelic variation on bread-making quality, Annu Rev Plant Physiol, 38:141-153 http://dx.doi.org/10.1146/annurev.arplant.38.1.141
http://dx.doi.org/10.1146/annurev.pp.38.060187.001041
Pitts E.G., Rafalski J.A., and Hedgcoth C., 1988, Nucleotide sequence and encoded amino acid sequence of a genomic gene region for a low molecular weight glutenin, Nucleic Acids Res., 16(23): 11376
http://dx.doi.org/10.1093/nar/16.23.11376 PMid:3205747 PMCid:339026
Shewry P.R., and Halford N.G., 2002, Cereal seed storage proteins: Structure, properties and role in grain utilization, Expl Bot., 53(370): 947-958 http://dx.doi.org/10.1093/jexbot/53.370.947 PMid:11912237
Zhang W., Gianibelli M.C., Rampling L.R., Gale K.R., 2004, Characterisation and marker development for low molecular weight glutenin genes from Glu-A3 alleles of bread wheat (Triticum aestivum L), Theor Appl Genet 108(7): 1409-1419 http://dx.doi.org/10.1007/s00122-003-1558-8 PMid:14727031
Zhao H.X., Guo A.G., Hu S.W., Fan S.H., Zhang D.P., Ren S.L., and Wang R.J., 2004, Development of primers specific for LMW-GS Genes at Glu-D3 and Glu-B3 loci and PCR Amplification, Zuo wu Xuebao (Acta Agronomica Sinic), 30(2): 126-130 (赵惠贤, 郭蔼光, 胡胜武, 范三红, 张大鹏, 任思霖, 王瑞娟, 2004, 小麦Glu-D3和Glu-B3位点LMW-GS基因特异引物设计与PCR扩增, 作物学报, 30(2): 126-130)
Zhao H.X., Xue X.Z., Mares D, and Feng J.L., 1997, Effect of auelic variation of gIutenin subunit loci Glu-1 and Glu-3 on wheat quality, Zuo wu Xuebao (ACTA Agronomica Sinica), 23(6): 646-654 (赵惠贤, 薛秀庄, Mares D, 冯军礼, 1997, 麦谷蛋白亚基Glu-1和Glu-3位点基因等位变异对小麦品质特性的影响, 作物学报, 23(6): 646-654)
Zhao X.L., Xia X.C., He Z.H., Gale K.R., Lei Z.S., Appels R., and Ma W., 2006, Characterization of three low-molecular-weight Glu-D3 subunit genes in common wheat, Theor. Appl. Genet., 113(7): 1247-1259
http://dx.doi.org/10.1007/s00122-006-0379-y PMid:16941095
Zhao X.L., Xia X.C., He Z.H., Lei Z.S., Appels R., Yang Y., Sun Q.X., and Ma W., 2007, Novel DNA variations to characterize low molecular weight glutenin Glu-D3 genes and develop STS markers in common wheat, Theor. Appl. Genet., 114(3): 451-460 http://dx.doi.org/10.1007/s00122-006-0445-5 PMid:17106734
